



過渡金屬催化的芳基鹵代物硫醚化反應(yīng)是合成芳基硫化物的一種有效方法,在醫(yī)藥、材料和天然產(chǎn)物中都有廣泛的應(yīng)用。然而,傳統(tǒng)過渡金屬催化的芳基鹵代物硫醚化反應(yīng)通常需要使用強(qiáng)堿以從硫醇生成硫醇鹽,此外,還需要高溫(高達(dá)200 °C)和/或特別設(shè)計(jì)的配體 (圖1a),這在很大程度上限制了官能團(tuán)的耐受性。為了解決這些問題,2013年,J. C. Peters和G. C. Fu等人率先開發(fā)了一種0 °C下光誘導(dǎo)銅催化的芳基鹵代物硫醚化反應(yīng),但仍然需要強(qiáng)堿NaOt-Bu。在這一開創(chuàng)性工作的啟發(fā)下,化學(xué)家們發(fā)展了其他幾種室溫下,弱堿存在下,光氧化還原介導(dǎo)的芳基鹵代物硫醚化反應(yīng) (圖1b),然而,室溫下電化學(xué)促進(jìn)的芳基、雜芳基溴代物和氯代物的硫醚化反應(yīng)仍未得到發(fā)展。
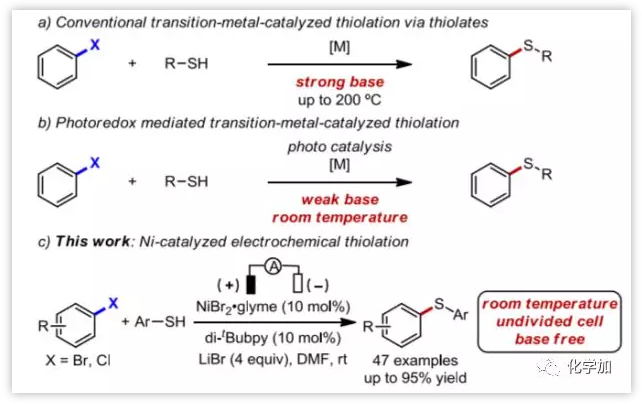
圖1. 芳基鹵代物的催化硫醚化反應(yīng) (圖片來源:Angew. Chem. Int. Ed.)
上海有機(jī)所梅天勝課題組致力于金屬催化和有機(jī)電合成的交叉研究。利用金屬催化的高選擇性以及電氧化還原能力的可調(diào)性,拓展了金屬有機(jī)電化學(xué)在合成化學(xué)中的應(yīng)用。 近年來,該課題組發(fā)展了一系列構(gòu)建C–N、C–C、C–O鍵的方法 (J. Am. Chem. Soc.2018, 140, 11487–11494; ACS Catal. 2018, 8, 7179–7189; Chin. J. Chem. 2018, 36, 338–352; Org. Chem. Front. 2018, 5, 2244–2248;Organometallics 2018, DOI: 10.1021/acs.organomet.8b00550; J. Am. Chem. Soc. 2017, 139, 3293; Org. Lett. 2017, 19, 2905; Chem. Commun. 2017, 53, 12189) 。利用電能驅(qū)動(dòng)化學(xué)轉(zhuǎn)化,避免了使用當(dāng)量的化學(xué)氧化劑和還原劑。2017年,Baran等人報(bào)道了在溫和反應(yīng)條件下,通過成對(duì)電解的方式,芳基鹵代物的Ni-催化胺化反應(yīng),其中同一反應(yīng)體系中可以獲得鎳催化劑的不同氧化態(tài)。在本篇Angew中,梅天勝課題組報(bào)道了室溫下Ni-催化芳基和雜芳基溴代物和氯代物的硫醚化反應(yīng),且反應(yīng)不需要外加堿。
首先,作者以4-溴三氟甲基苯(1a)與4-甲基苯硫酚(2a)為模型底物,在不同反應(yīng)條件下考察了電化學(xué)硫醚化反應(yīng)(圖2)。可以看出,在10 mol% NiBr2·glyme和4當(dāng)量LiBr存在下,在4.0 mA下恒流電解,DMF中室溫反應(yīng)6 h,能以85%的分離產(chǎn)率得到目標(biāo)產(chǎn)物(3a)。NiBr2、NiCl2·glyme、Ni(OAc)2·4H2O或Ni(acac)2導(dǎo)致產(chǎn)率下降或無反應(yīng)。配體篩選中4,4’-二叔丁基-2,2’-聯(lián)吡啶L1的產(chǎn)率最高。Al犧牲陽極的產(chǎn)率中等,Mg電極的效果更好,而其它陽極電極如Pt,RVC是無效的。在反應(yīng)結(jié)束時(shí),大部分Mg陽極被氧化。除Ni-泡沫電極外,RVC、石墨和Pt等其它陰極電極也是有效的。控制實(shí)驗(yàn)表明,NiBr2·glyme和電流是該反應(yīng)所必需的。
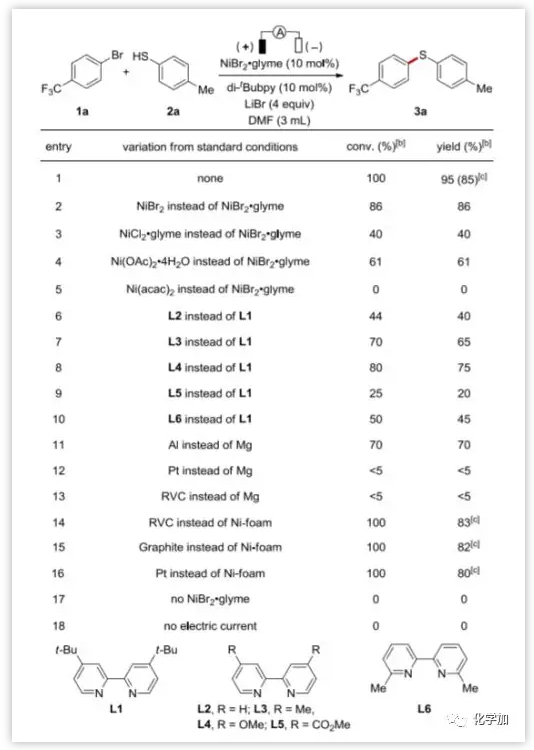
圖2. 反應(yīng)條件的優(yōu)化 (圖片來源:Angew. Chem. Int. Ed.)
有了最佳反應(yīng)條件,作者進(jìn)一步探討了反應(yīng)的底物范圍和局限性。如圖3所示,芳烴被各種官能團(tuán)如酯、腈、硝基、三氟甲硫基、乙酰基、醛、磺酰基、氯、氟和甲氧基等基團(tuán)取代(3b-3s),都取得了良好到優(yōu)秀的產(chǎn)率。一般來說,含缺電子取代基的芳基溴代物反應(yīng)良好。此外,各種雜環(huán)如吡啶、喹啉、嘧啶、噠嗪、苯并噻吩和吲哚底物在該電化學(xué)硫醚化工藝中也都具有良好的耐受性。然而,在目前的條件下,富電子芳烴并不反應(yīng),這可能是由于Ni(0)物種和芳基鹵代物不易氧化加成所導(dǎo)致的。
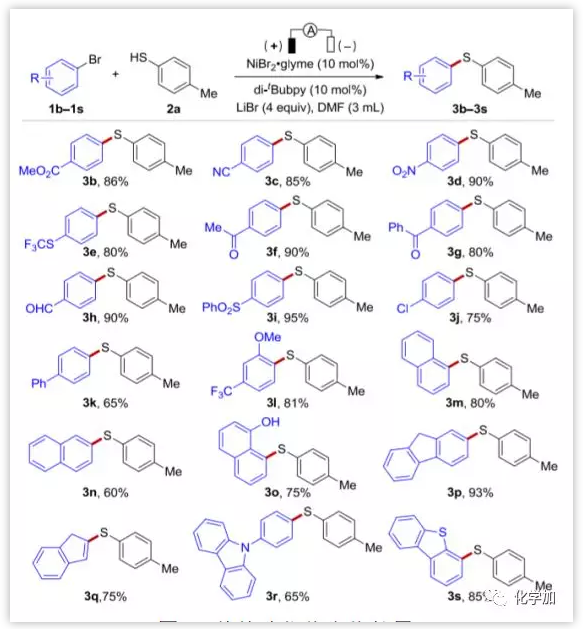
圖3. 芳基溴代物底物擴(kuò)展 (圖片來源:Angew. Chem. Int. Ed.)
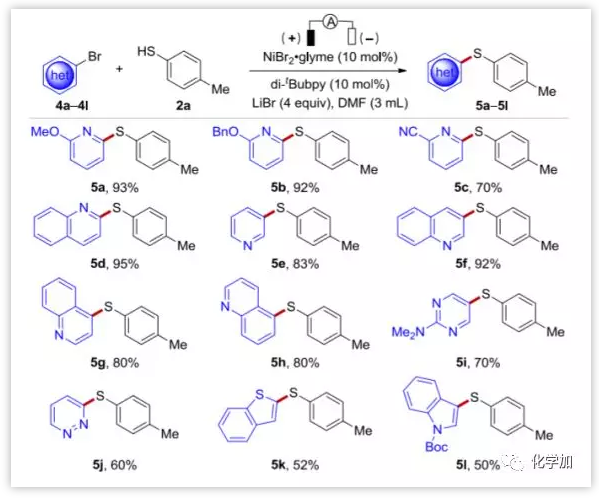
圖4. 雜芳基溴代物底物擴(kuò)展 (圖片來源:Angew. Chem. Int. Ed.)
接下來,作者研究了一系列廉價(jià)易得的芳基氯代物的反應(yīng)活性。同樣,缺電子的芳基氯代物和吡啶基氯代物在標(biāo)準(zhǔn)反應(yīng)條件下都是有效的,能以良好的產(chǎn)率得到相應(yīng)的芳基硫化物(圖5)。此外,含有多種官能團(tuán)的芳基硫醇,包括甲氧基、烷基、氟、三氟甲基,也都是可以耐受的(8a-8g, 3b),并給出了優(yōu)良的產(chǎn)率(圖6)。

圖5. 芳基氯代物底物擴(kuò)展 (圖片來源:Angew. Chem. Int. Ed.)
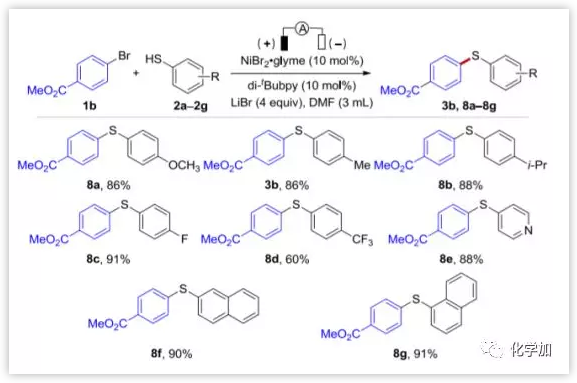
圖6. 芳基硫醇底物擴(kuò)展 (圖片來源:Angew. Chem. Int. Ed.)
此外,作者還嘗試了克級(jí)規(guī)模制備的實(shí)驗(yàn),在標(biāo)準(zhǔn)的電化學(xué)硫醚化反應(yīng)條件下,6.0 mmol底物1h,能以60%的產(chǎn)率得到所需產(chǎn)品3h。
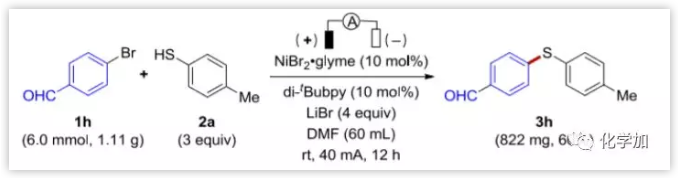
圖7. 規(guī)模制備實(shí)驗(yàn) (圖片來源:Angew. Chem. Int. Ed.)
雖然現(xiàn)階段對(duì)反應(yīng)機(jī)理還沒有很好的了解,但作者也作了一些重要的機(jī)理驗(yàn)證實(shí)驗(yàn)。鎂陽極在反應(yīng)后幾乎被消耗掉,說明Mg陽極上發(fā)生了Mg0到Mg2+的氧化反應(yīng)。在標(biāo)準(zhǔn)條件下,在得到所需的產(chǎn)物3a同時(shí)還以良好的收率得到了二硫化物10(圖8a),在沒有鎳催化劑的情況下,也能生成10,這可能是由硫自由基的二聚反應(yīng)產(chǎn)生的。用TEMPO捕獲硫自由基,以30%的產(chǎn)率得到化合物11,進(jìn)一步支持了硫自由基的生成。同樣,在沒有鎳催化劑的情況下,也得到了化合物11(圖8b)。為了了解Mg陽極上產(chǎn)生硫自由基的原因,作者進(jìn)行了循環(huán)伏安(CV)實(shí)驗(yàn),研究了Mg陽極、硫醇2a和硫醇鹽9的氧化還原電位。Mg的起始氧化電位約為-0.7 V vs. Ag/Ag+,雖然由于Mg的氧化,沒有觀察到硫醇2a和硫醇鹽9的氧化峰,但在硫醇鹽9存在時(shí),氧化電流明顯降低,這可能意味著硫醇鹽正在發(fā)生氧化反應(yīng)。當(dāng)使用鋁或玻碳陽極時(shí),硫醇鹽9的氧化波分別為-1.2 V和-0.8 V vs. Ag/Ag+,這些數(shù)據(jù)表明硫醇鹽氧化生成硫自由基是可能的。
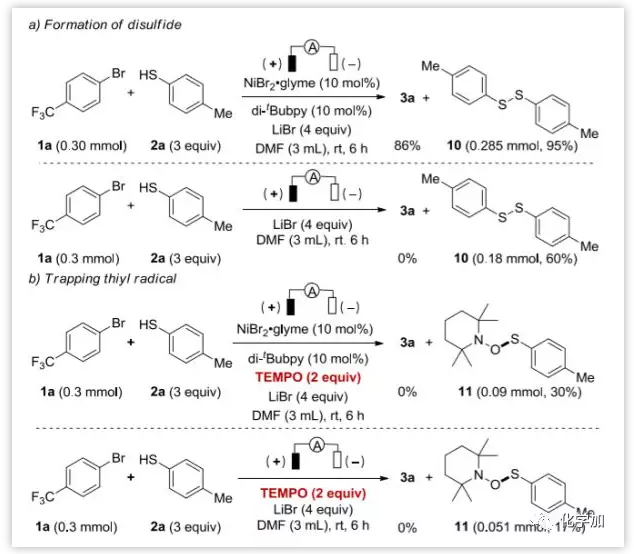
圖8. 機(jī)理研究實(shí)驗(yàn) (圖片來源:Angew. Chem. Int. Ed.)
根據(jù)文獻(xiàn)報(bào)道和實(shí)驗(yàn)數(shù)據(jù),作者提出了如圖9所示的可能機(jī)理。Ni(II)或Ni(I)通過陰極還原形成Ni(0)物種,Ni(0)和芳基鹵代物發(fā)生氧化加成,生成芳基Ni(II)配合物12,該配合物與硫醇鹽反應(yīng)生成中間體13,13還原消除得到了產(chǎn)物和Ni(0)物種(路徑a)。或者,也有可能經(jīng)過路徑b,涉及硫自由基過程。
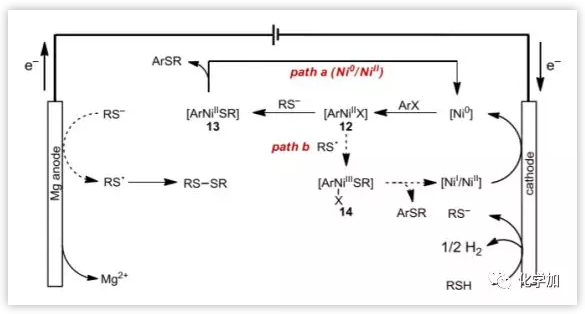
圖9. 可能的反應(yīng)機(jī)理 (圖片來源:Angew. Chem. Int. Ed.)
總結(jié):梅天勝課題組開發(fā)了在無隔膜電解池中,鎳催化的芳基或雜芳基溴和氯代物的硫醚化反應(yīng)。該反應(yīng)條件溫和、不需外加堿,為芳基硫化物的合成提供了一種有效的新方法。
JACS 上海有機(jī)所梅天勝課題組實(shí)現(xiàn)首例銅催化的電氧化促進(jìn)的芳烴碳?xì)滏I胺化反應(yīng)
上海有機(jī)所梅天勝課題組發(fā)表JACS 報(bào)道電化學(xué)氧化促進(jìn)的碳?xì)滏I官能團(tuán)化反應(yīng)新進(jìn)展
撰稿人:詩(shī)路化語
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn