



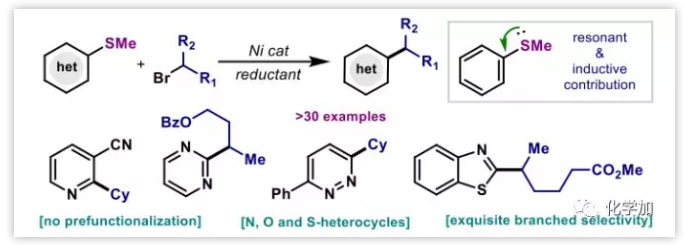
交叉偶聯(lián)反應(yīng)廣泛應(yīng)用于合成雜環(huán)生物活性化合物中,其中大多數(shù)的親電試劑主要是雜芳基鹵化物,但雜芳基鹵化物具有穩(wěn)定性差,容易水解等問(wèn)題。Liebeskind-Srogl偶聯(lián)反應(yīng)即金屬催化的硫酯和硼酸的C(sp2)-C(sp2)偶聯(lián)反應(yīng)拓展了C-C交叉偶聯(lián)反應(yīng)的范圍,并且已證明用于雜芳烴的合成。雙親電試劑的交叉偶聯(lián)反應(yīng)具有高效、簡(jiǎn)單、實(shí)用的優(yōu)點(diǎn),避免了制備有機(jī)金屬試劑,但目前芳基親電試劑僅涉及各種鹵代烴。與芳基鹵代烴相比,C(sp2)-S鍵活化存在三個(gè)難點(diǎn):①SMe負(fù)離子的配位能力強(qiáng);②硫原子容易使催化劑中毒;③硫原子使芳烴富電子,更難發(fā)生偶聯(lián)反應(yīng)。在本文中,作者報(bào)道了Ni催化的C-SMe鍵活化的還原交叉偶聯(lián)反應(yīng)(圖1)。
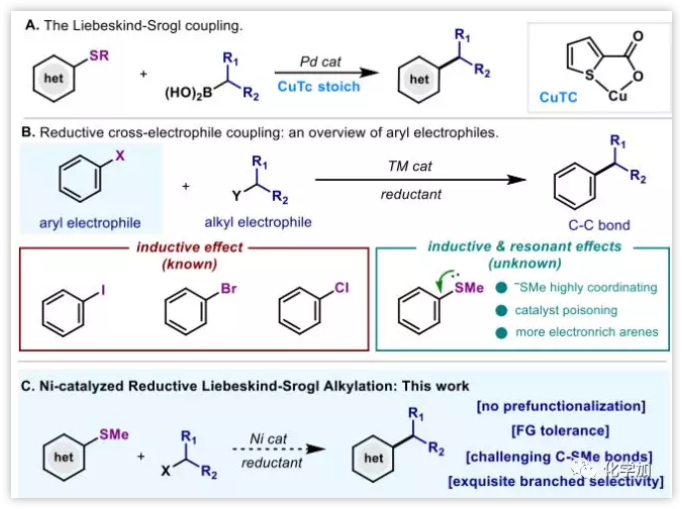
圖1:反應(yīng)背景(來(lái)源:J. Am. Chem. Soc.)
作者首先選用芳基甲硫醚1和CyBr(2)用作偶聯(lián)反應(yīng)的模板底物對(duì)反應(yīng)條件進(jìn)行了優(yōu)化。發(fā)現(xiàn)Ni的富電子配體以及鋅粉對(duì)反應(yīng)是必須的,用錳替換鋅時(shí)反應(yīng)幾乎不能發(fā)生。堿的強(qiáng)度也對(duì)反應(yīng)至關(guān)重要,將磷酸二氫鉀換成磷酸氫二鉀或者磷酸鉀時(shí),產(chǎn)率都有所下降。不加分子篩或者降低溫度都會(huì)使產(chǎn)率降低(圖2)。
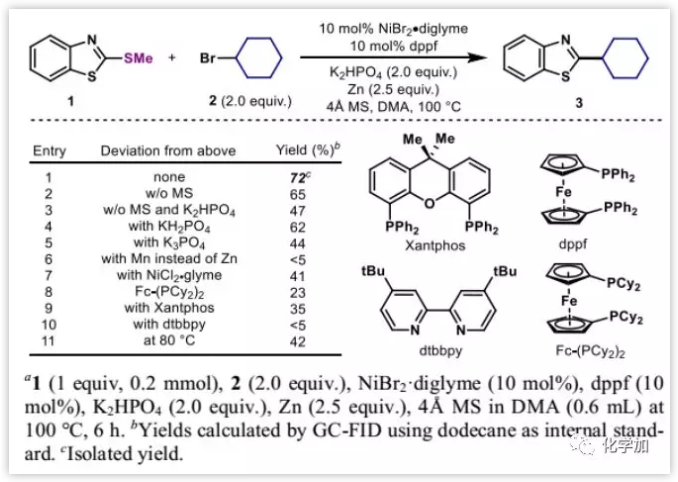
圖2:條件優(yōu)化(來(lái)源:J. Am. Chem. Soc.)
得到最優(yōu)反應(yīng)條件后,作者又對(duì)底物范圍進(jìn)行了研究。含有各種官能團(tuán)取代的苯并噻唑衍生物底物,如:腈基、氟、烷基、酯、醚、三氟甲基和噻吩都能很好的反應(yīng)。對(duì)于其他的雜環(huán)芳烴,如苯并噁唑硫醚、2-吡啶、2-喹啉、1-異喹啉、2-嘧啶和3-噠嗪也都具有很好的耐受性。溴代烷烴也具有很寬的底物范圍,四元、五元和七元環(huán)溴代烷烴以及雙環(huán)降冰片基都能以良好的收率得到偶聯(lián)產(chǎn)物。雜環(huán)溴代烷烴如4-四氫吡喃和4-哌啶也以良好的收率順利反應(yīng)。對(duì)于不同的非環(huán)狀的溴代烷烴,都能得到單一異構(gòu)體的支鏈產(chǎn)物。帶有較長(zhǎng)烷基鏈代替甲基的其他硫醚也能反應(yīng),盡管產(chǎn)率較低(圖3)。
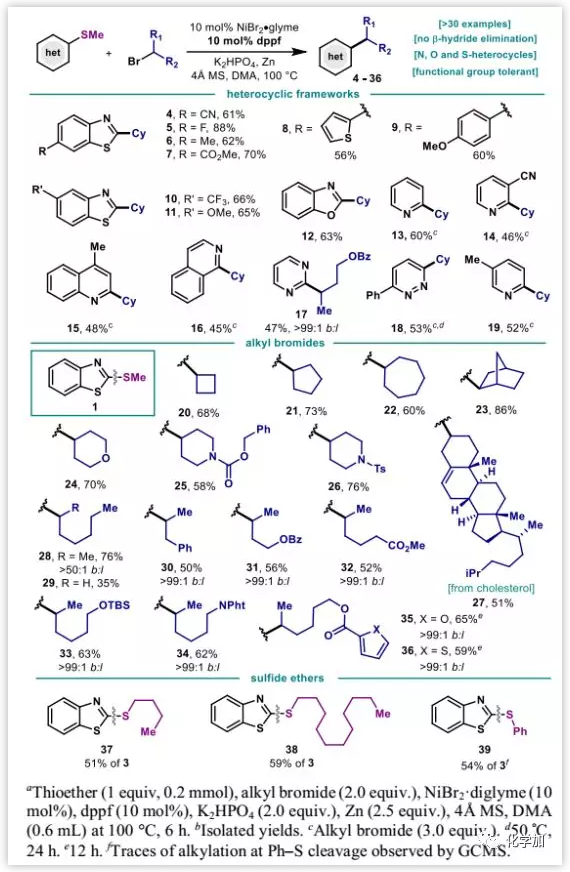
圖3:底物拓展(來(lái)源:J. Am. Chem. Soc.)
反應(yīng)在10mmol規(guī)模下,以67%的產(chǎn)率得到偶聯(lián)產(chǎn)物證明了該反應(yīng)的放大性潛力。作者接下來(lái)又研究了該反應(yīng)在藥物分子合成中的應(yīng)用。苯并噻唑硫醚40在還原烷基化(88%)后,C(sp2)-F催化胺化以81%的產(chǎn)率得到藥物分子41,并且以同樣的方法得到伯胺取代的產(chǎn)物42(圖4)。
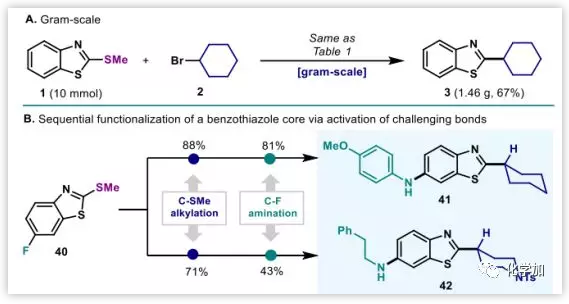
圖4:放大及衍生化(來(lái)源:J. Am. Chem. Soc.)
作者進(jìn)行了一系列對(duì)照試驗(yàn)驗(yàn)證了該反應(yīng)的機(jī)理。環(huán)丙基甲基溴的開(kāi)環(huán)現(xiàn)象表明了反應(yīng)經(jīng)過(guò)碳中心自由基路線。添加TEMPO以及1,1-二苯基乙烯的實(shí)驗(yàn)可能表明烷基自由基的non-cage現(xiàn)象,但5-exo-trig非環(huán)化和環(huán)化產(chǎn)物的比例并不隨催化劑的增多而改變的實(shí)驗(yàn)表明不然。有趣的是,2-溴丙基苯在還原條件下偶聯(lián)僅得到支鏈產(chǎn)物30-B,相反,在相同條件下2-戊基溴化鋅的反應(yīng)得到30-B和30-L(1.5:1)的混合物,因此否定了有機(jī)鹵化鋅作為中間體的猜想。總之,Ni負(fù)責(zé)自由基的形成,并發(fā)生快速的籠式反彈。另外,開(kāi)鏈溴代烷烴觀察到的非異構(gòu)化指出Ni/膦配合物從較高氧化態(tài)快速還原消除(圖5)。
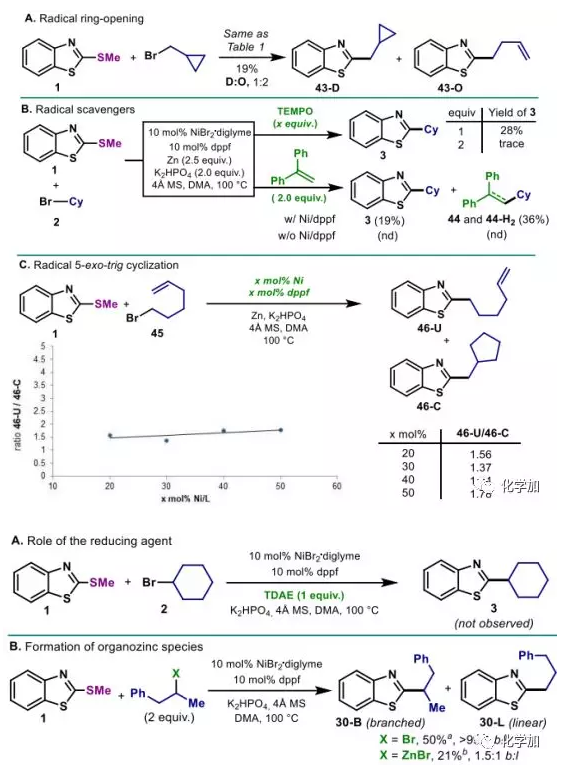
圖5:機(jī)理研究(來(lái)源:J. Am. Chem. Soc.)
總結(jié):德國(guó)馬克斯普朗克煤炭研究所的Josep Cornella課題組報(bào)道了Ni催化的雜芳基C-SMe與溴代烷烴的C-S鍵活化的還原偶聯(lián)反應(yīng)。該反應(yīng)底物范圍廣、官能團(tuán)兼容性好。能夠應(yīng)用于雜芳烴藥物分子的合成。
撰稿人:殘?jiān)?/span>
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn