

單分子親核取代(SN1)和雙分子親核取代(SN2)都是成熟的教科書化學(Fig. 1A),然而關于三級親電試劑的不對稱親核取代的報道卻屈指可數。Sun課題組報道的是氧穩定化的正離子加成,而Jacobsen課題組發展了無雜原子穩定化的碳正離子不對稱烯丙基化反應(Fig. 1B)。SN2反應與SN1反應相比,更多被應用于動力學拆分。Fu通過單電子轉移引發的自由基SRN1反應成功實現了消旋的三級烷基氯和胺進的不對稱交叉偶聯(Fig. 1B)。
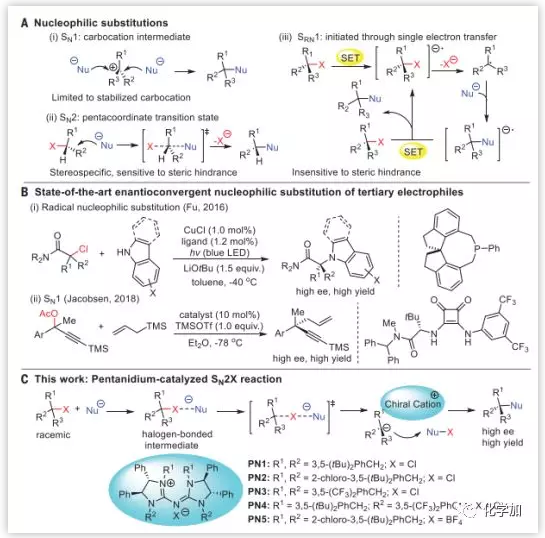
Fig. 1. 親核取代反應(A)親核取代SN1,SN2和SRN1(B)三級碳親電試劑的對映親核取代(C)本文工作:Pentanidium催化親鹵親電對映性取代 圖片來源: Science
與人們認識的SN2機理不同,另一種取代途徑SN2X是親核試劑(Nu)進攻離去基團,和鹵原子X相互作用,產生碳負離子和新的親電中間體(Nu–X),然后碳負離子取代Nu–X的X生成取代產物。SN2X反應往往發生在親核試劑進攻Sp3碳中心受阻后,更傾向于進攻鹵原子,因此可用于合成擁擠的三級和四級碳中心。
近日,來自南洋理工大學的Choon-Hong Tan課題組和新加坡設計大學的Richmond Lee課題組合作報道了在手性陽離子“盤扭五氮胍鹽(Pentanidium)”催化劑控制下硫代羧酸鹽(或疊氮化物)取代活化的三級溴代烷,生成具有高對映選擇性的取代產物(DOI: 10.1126/science.aau7797)。通過實驗和計算化學研究,證明了此反應是通過SN2X機理實現。
作者選擇被活化的三級溴代烷1a作為模板底物,進行了條件篩選。測試了在5 %的“盤扭五氮胍鹽(Pentanidium)”催化下一系列硫代羧酸鹽的取代反應(Fig. 2A),發現當2b和PN4組合時反應效果最佳。然后作者篩選了不同底物類型(Fig. 2B),苯基、噻吩基和呋喃基硫代羧酸鹽均有良好的反應性;一級和二級的烷基取代底物反應情況良好(3d到3h);烯丙基和炔丙基在此反應中也有較好兼容性(3i到3k,3l);對于芐基取代基,不論吸電子基團還是給電子基團都有較好的產率和ee值(3m到3q) ;對多種芐基和萘甲基底物也有較好反應性(5a到5h);但對于呋喃甲基和噻吩甲基的取代底物,雖然產率受影響不大,其ee值卻有明顯下降(5i 和 5j)。
然后作者研究了其他親核試劑的反應性。有機疊氮化合物是有機合成中的重要砌塊,然而合成手性三級有機疊氮化合物的方法屈指可數,且均是從高光學純的三級鹵代烷出發。作者發現使用前文的催化體系在-40 °C的低溫條件下,在飽和碳酸鈉和二異丙基醚混合溶液中,通過3~4天反應,3 mol %的PN5可將6a和兩當量NaN3緩慢催化轉化為三級疊氮有機化合物,產率為86%, ee值為94% (Fig. 2C) 。作者推測此該反應活性較低的主要原因可能是疊氮化鈉在-40 °C下的溶解度問題。作者拓展了底物范圍,發現烷基、苯乙基底物以及含有烯基和炔基的底物反應產率較高(7b到7c,7h到7j和7m),含有大位阻的取代基的底物產率和ee值稍受影響,會產生質子化副產物(7d到7g) 。將環丙烷和戊烯基取代底物作為自由基探針,發現產物均為常規產物,并無開環和關環產物(7e和7i),說明此反應不大可能是自由基機理反應。底物中的羥基不能兼容,但當使用TBS或乙酰基保護后,產率和ee值無明顯變化。
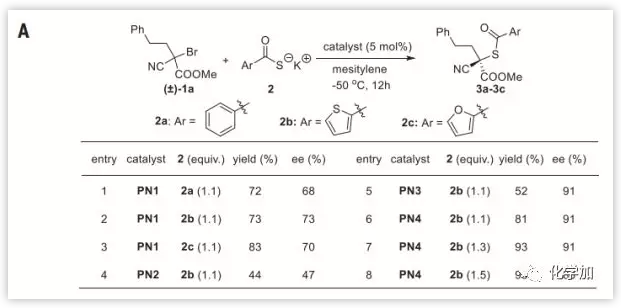

Fig. 2. (A)優化反應條件(B)硫代羧酸鹽對映性取代三級溴代烷(C)疊氮化物對映性取代三級溴代烷 圖片來源: Science
然后作者對反應機理進行了研究,基于(Fig.2C;7e和7i)的反應情況和自由基捕捉劑的捕捉試驗,作者認為自由基機理可以排除(Fig. S1) 。然后分別給體系加入質子源試劑(MeOH, H2O和PhOH)和氫源試劑(1,4-環己二烯,芴, 氧雜蒽和Et3SiH),發現氫源試劑并不能影響反應,而質子源試劑可以促進反應向質子化產物1a-H方向進行。作者推測如果1a-H產生于碳負離子的質子化,那么則可以觀察到此碳負離子的取代基效應。通過對不同取代基的研究得到了一條斜率為+2.57的線性相關曲線,說明吸電子基團對聚集在決速步驟的負離子有穩定化作用(Fig. 3B)。作者設計了碳負離子交換的實驗來驗證提出的碳負離子中間體,將混合的三級溴烷1l和1m-H在標準條件下反應,得到混合的產物3n (產率53%,ee值86%)和3o (產率45%, ee值77%) (Fig. 3C),說明部分來自1l的碳負離子從1m-H攫氫,生成相應的碳負離子,兩種碳負離子均參與了不對稱偶聯反應并生成最終的產物3n和3o。
此時,作者有足夠的證據認為該反應是SN2X機理。SN2X機理的關鍵特征是親核試劑(Nu)進攻鹵原子(X)形成新親電中間體(Nu–X)。為了證明此過程,作者合成出假設的中間體8a,在PN4催化下與來自1a-H碳負離子1a-A進行反應(Fig. 3D),得到了1a(產率12%, ee值0%)和3a(產率66%, ee值82%;與Fig. 2B的3a對比);同樣,利用類似反應也對疊氮反應進行了測試,得到了類似的結果,說明8a和BrN3都是存在的反應中間體。反應中偶聯產物3a和7a均有較高的ee值,而得到的原料三級溴代烷無光學活性,說明本反應手性的引入并非在鹵原子的攫取步驟。作者又將(用手性制備柱分離得到)兩種不同手性的三級溴烷1i進行標準反應條件測試(Fig. 3E),發現從兩種不同手性的原料得到相同的產物(+)-3k (ee值87%),且回收的原料1i為消旋狀態,證明了8a和BrN3產生于SN2X機理,且為兩可親電試劑。碳溴鍵斷裂步驟可逆(Fig.3F)也解釋了手性原料的消旋化。作者也做了對疊氮反應類似的研究(Fig. S2)。
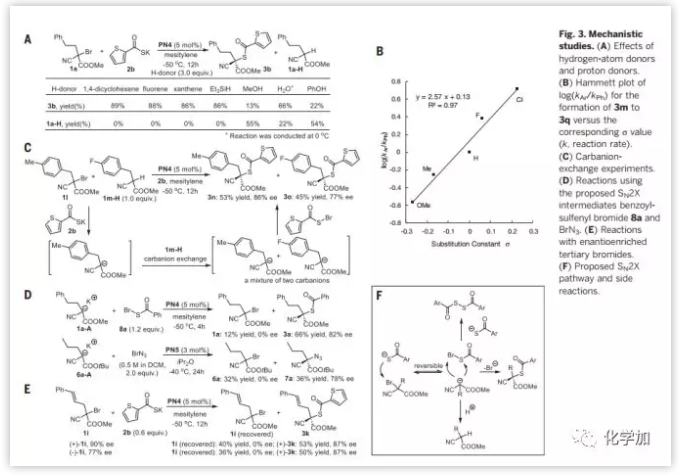
Fig. 3. 機理研究(A)氫源試劑和質子源試劑的影響(B)關于3m到3q的Hammett方程研究 (C)碳正離子交換實驗(D) SN2X反應中間體8a和BrN3的研究(E)光學純的三級溴代烷的反應情況(F)推測的SN2X反應機理和副反應 圖片來源: Science
最后作者進行了計算化學研究。研究發現SN2機理需要通過真實加成反應,其過渡態TS-A能量較高。至于SN2X 機理,通過分子間鹵鍵形成int-B中間體,Br擁有被吸電子的氰基和酯基增強的σ-hole。計算得到int-B的硫-溴鍵長度是3.04 ?,恰好符合鹵鍵的長度,1b中的碳溴鍵被拉長到2.00 ? (Fig. 4),然后被切斷,符合試驗事實。
從int-B最容易實現的動力學步驟是硫代羧酸鹽通過TS-B逐步攫Br,在自發生成S-Br鍵以及碳溴鍵斷裂后,得到由鹵鍵穩定的int-C。亞砜基溴從催化劑解離,留下催化劑和烯醇形成的離子對(cat-enolate)。前文解釋過碳溴鍵的可逆斷裂不具有對映選擇性的,說明是生成手性產物的重要中間體int-D的方向性和催化劑對底物的束縛作用。隨后通過TS-D,經過形成碳硫鍵,最后催化劑同產物解離,完成催化循環。圖中活化能壘TS-B和TS-D 幾乎等能,與亞砜基溴是個兩可親電試劑的實驗結論一致。

Fig. 4. DFT計算。通過DFT計算的SN2和SN2X機理的中間體和過渡態的自由能。球棒模型為幾何優化的int-B和int-C的結構,且描述了關鍵原子間距 圖片來源: Science
結論:鹵鍵在超分子化學和晶體工程中已經得到長足發展,但在有機合成和催化中仍舊處于未開發狀態。本文研究以鹵鍵的作用為基礎,實現了用常規手段難以實現的三級鹵代烷的不對稱親核取代,是親核取代反應發展史上的一塊重要拼圖,也為鹵鍵在有機催化和催化中的應用打開了大門。
撰稿人:暗夜卡賓
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn