

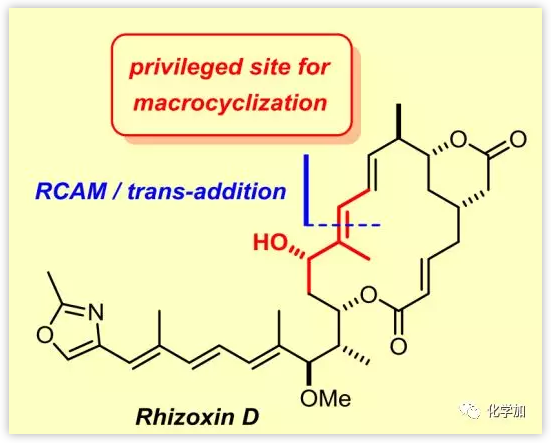
Rhizoxin(3)是從水稻病原真菌(Rhizopus chinensis)的培養基中分離得到的,屬于Burkholderia菌屬的細菌內共生體,還包括多種其他同源物如1和2,均具有抗真菌活性、顯著的體外細胞毒性和體內抗腫瘤活性。不飽和變體rhizoxin D (1)可能是3的生物合成前體,也可以通過化學方法轉化為2和3。由于1的生物活性與2和3的生物活性相似,該不飽和化合物在過去一直是全合成的焦點(Scheme 1)。大環內酯的合成區別主要體現在關環方式的不同,常用的關環方法包括通過HWE反應構建C2-C3烯醇鍵。目前,只有一篇基于分子內Stille交叉偶聯構建1,3-二烯實現大環閉合的全合成報道。德國馬克斯普朗克煤炭研究所Alois Fürstner課題組利用炔烴關環復分解反應完成了Rhizoxin D的全合成。
(圖片來源:Angew. Chem. Int. Ed.)
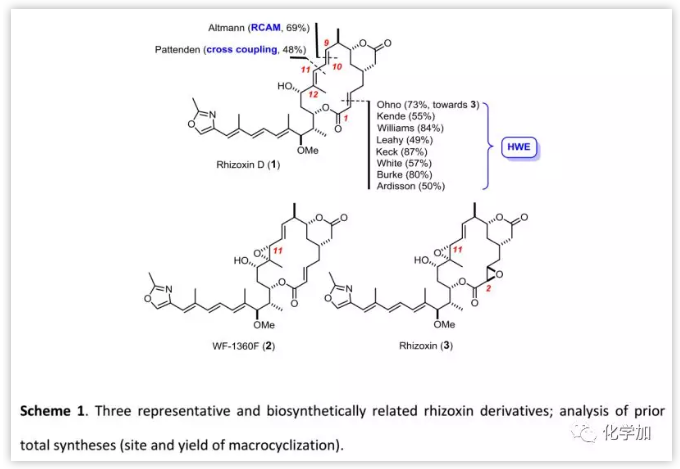
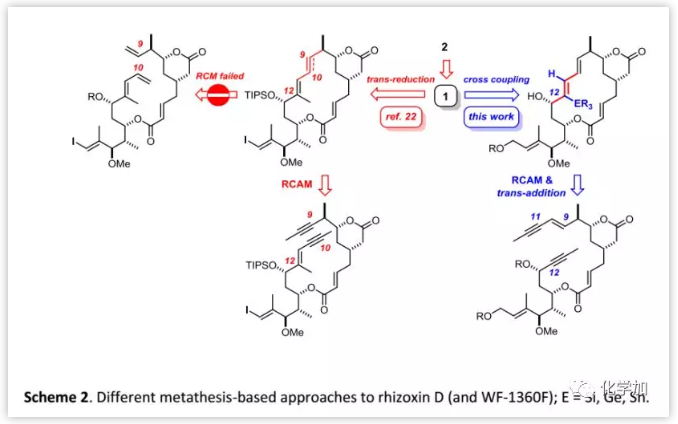
起初,有機化學家嘗試通過閉環烯烴復分解反應(RCM)合成rhizoxins,但Altmann課題組曾報道利用RCM構建二取代C9-C10雙鍵時未能實現閉環(Scheme 2)。與之相比,閉環炔烴復分解(RCAM)卻可以很好地解決這個問題且收率高達69%。然而,大位阻環境使得炔烴被還原為E-烯烴;另一種間接的方法是通過與相應的Co2[CO]6絡合物構建出Z-烯烴,然后經還原解離、自由基異構化得到E-異構體。
(圖片來源:Angew. Chem. Int. Ed.)
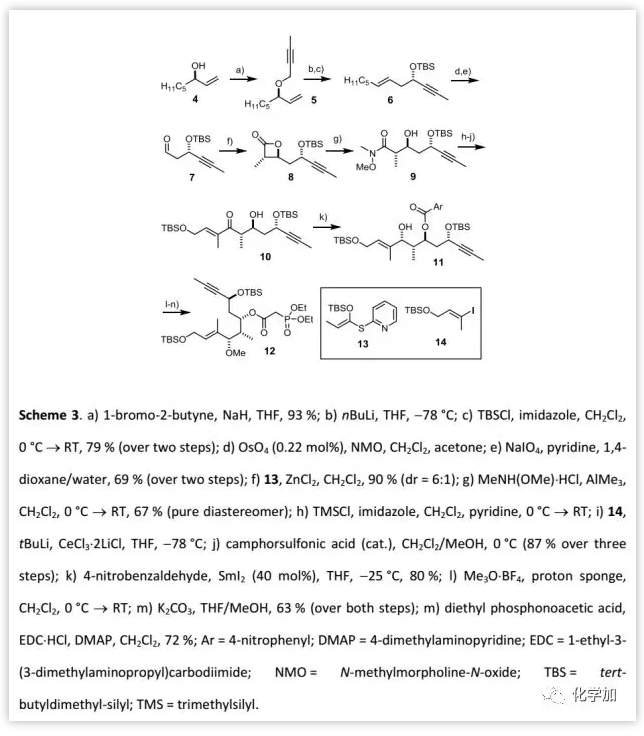
片段12的制備(Scheme 3):
首先,作者以醇4衍生得到的烯丙基炔丙醚5進行[2,3]-Wittig重排得到烯炔6,經雙鍵斷裂氧化得到醛7,然后與混合烯酮縮醛13進行Mukaiyama-型羥醛縮合反應/內酯化得到相應的β-內酯8,經Weinreb反應開環得到Weinreb酰胺9。隨后,將9進行TMS保護后,與14 偶聯得到羥基酮10,其羥基經對硝基苯甲酯保護后,進行Evans-Tishchenko氧化還原酯化引入反式-1,3-二醇片段。最后,對11中的羥基進行甲基化,然后將對硝基苯甲酯交換磷酸乙酯得到化合物12。
(圖片來源:Angew. Chem. Int. Ed.)
片段22的制備及與片段12的連接(Scheme 4):
作者以巴豆醇15為原料,經Sharpless環氧化、開環得到二醇17(≥10:1),然后轉化為末端環氧化物18后,進行格氏反應得到19,其雙鍵經環氧化、水解產生的雙羥基用丙酮叉保護,選擇性還原炔丙基、去縮酮保護后得到二醇21,再選擇性氧化半縮醛得到相當不穩定的醛22。最后,通過HWE反應將22與磷酸酯12連接得到環化前體23。

(圖片來源:Angew. Chem. Int. Ed.)
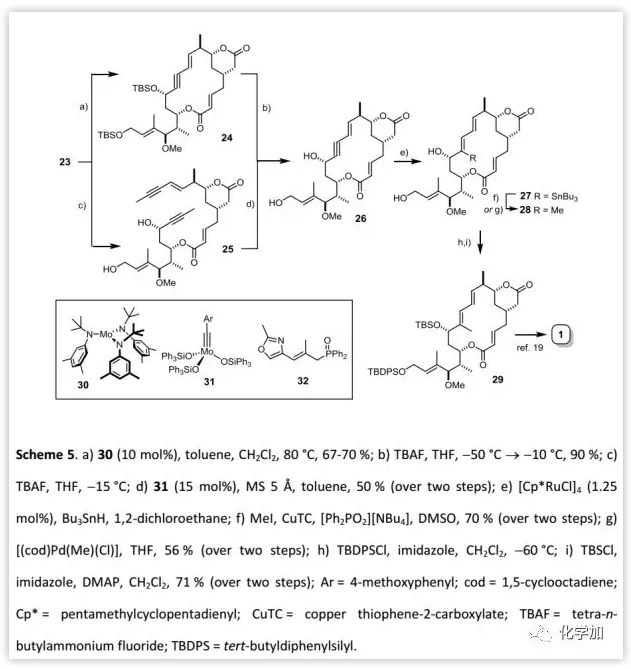
Rhizoxin D的全合成(Scheme 5):
在得到二炔23后,作者利用[Mo(N(t-Bu)Ar)3] (30)/CH2Cl2催化體系實現RCAM并以67-70%的收率得到關環產物24。隨后,作者脫去23中的兩個TBS保護基得到二醇25在催化劑31作用下進行RCAM,得到大環產物26(兩步50%)。接下來,作者對26進行關鍵的炔基選擇性錫氫化反應得到錫烷27,并利用MeI/CuTC/[Ph2PO2][NBu4] 或[(cod)Pd(Cl)(Me)]條件進行C-甲基化得到三取代烯烴28作為單一的區域和立體異構體。然后,按照Pattenden課題組報道的方法將其轉化為29,并最終完成rhizoxin D (1)的全合成。
(圖片來源:Angew. Chem. Int. Ed.)
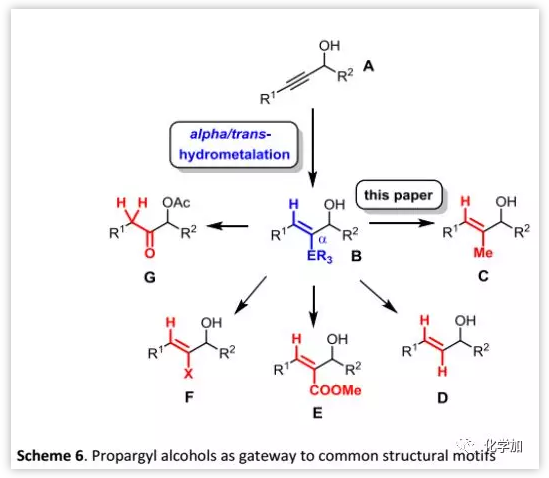
利用炔基選擇性錫氫化反應,還可以靈活地引入各種(三取代)烯烴和相關片段(Scheme 6):除文章涉及的C外,還包括其他很多天然產物,特別是聚酮類天然產物中遇到的亞結構片段如D、E或G等。因此,作者開發的合成策略可以用于大量(生物活性)目標化合物的合成,可能具有更廣泛的相關性。
(圖片來源:Angew. Chem. Int. Ed.)
小結:Alois Fürstner課題組利用炔烴關環復分解反應完成了rhizoxin D的全合成。作者開發的關環方法不同于以往的方法即大環化合物必須在二取代的烯烴位點關環,而是以鄰位為烯丙羥基的三取代C11-C12烯烴作為合成的支點,然后通過一系列炔烴復分解、反式氫化和交叉偶聯得到相應的產物。由于與此完全相同的亞結構(鄰位為烯丙羥基的三取代烯烴)廣泛存在于許多天然產物中,因此,作者開發的關環策略意義重大,具有更廣泛的應用前景。
撰稿人:爽爽的朝陽
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn