

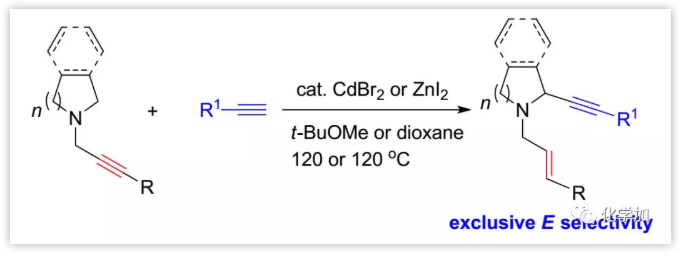
環胺在合成化學以及生物學上均具有重要作用,因此,對其合成方法的開發引起了越來越多的關注。目前,一種方法是通過環胺的α-官能化合成;另一種方法是通過N-保護的環胺與端炔或1-炔基三氟硼酸鹽的氧化偶聯(eq. 1,Scheme 1)或未保護的環胺與端炔和醛的三組分反應構建(eq. 2)。此前,中國科學院上海有機所麻生明院士課題組曾報道了ZnX2、CuI或CuBr2介導的端炔與醛在不同胺存在下進行末端二烯的烯基化以合成丙二烯的方法。Nakamura等人報道在該反應中炔丙胺進行金屬-介導的1,5-H遷移反應是非立體選擇性的。近日,麻生明院士課題組在Chem. Sci.報道了一種高度立體選擇性的N-炔丙基環胺的α-炔基化方法(eq. 3),通過用CdBr2(或ZnI2)催化劑可以得到N-(E)-烯丙基2-炔基環胺。
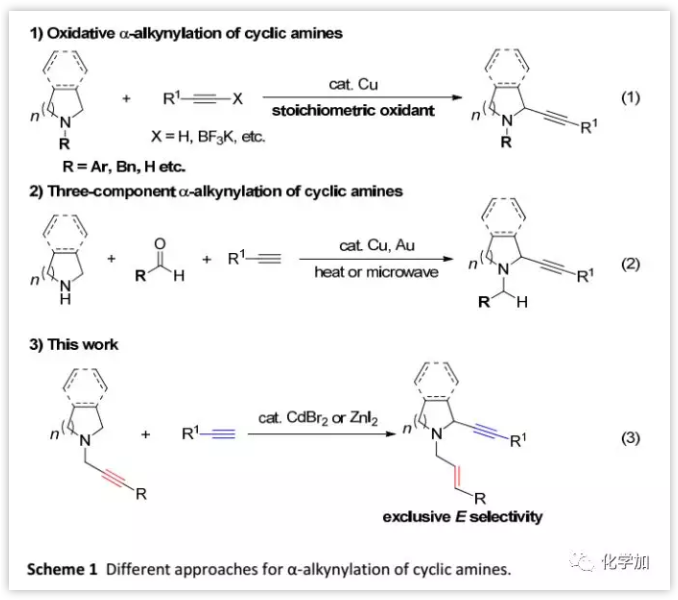
(圖片來源:Chem. Sci.)
反應條件的優化:
作者在胺存在下研究Cu-催化的端炔的丙烯酰化機理時,發現N-炔基胺1a與苯乙炔2a在CuBr催化下反應得到新產物3aa(13%),通過1H NMR分析確定該產物N-烯丙基中的C=C鍵為E式。通過篩選各種金屬鹽進一步優化了反應條件,并且發現CdBr2效果最好,可以42%的產率得到3aa,并且1a回收率為52%;當提高反應溫度(120 ℃)后,產率提高至56%,回收率為20%。

(圖片來源:Chem. Sci.)
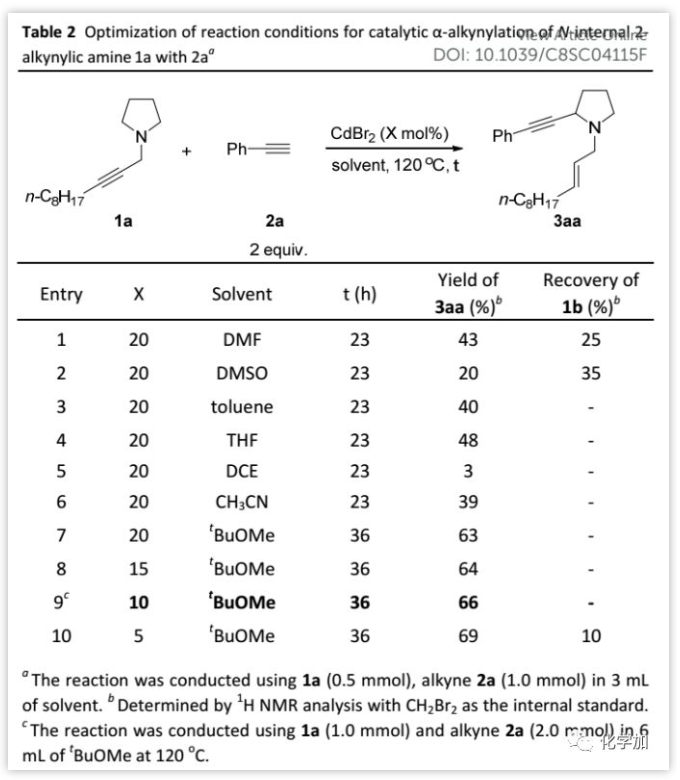
溶劑的作用(Table 2):
接下來,作者篩選了反應溶劑:發現以t-BuOMe作溶劑時,底物1a完全消耗并以63%的產率得到預期產物3aa。此外,將催化劑負載量降至10 mol%時,產率略微提高(66%);進一步降低催化劑負載量會導致1a反應不完全。因此,作者確定了優化的反應條件:反應溫度為120 ℃,溶劑為t-BuOMe,反應配比為1a(1 eq)/2a(2 eq)/CdBr2(10 mol%)。
(圖片來源:Chem. Sci.)
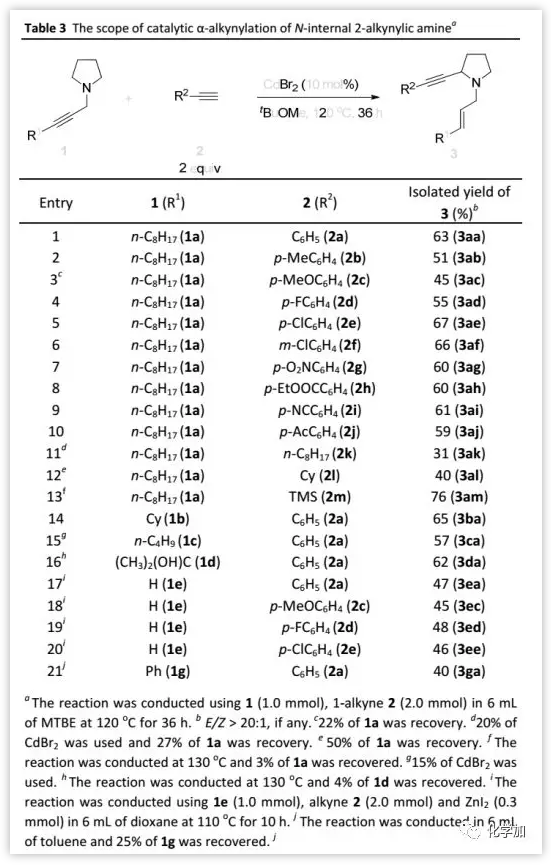
底物的適用范圍(Table 3):
在最佳反應條件下,作者以胺1a為底物篩選了進行α-炔化的末端炔烴的適用范圍。當端炔芳基含有給電子基團如p-Me、p-MeO,吸電子基團如p-F、p-Cl、m-Cl、p-NO2、p-EtOOC、p-CN以及p-Ac時,均可以中等收率得到相應的產物3;當端炔含有烷基取代基時,如1-癸炔和環己基乙炔反應緩慢,產率較低(31%和40%)。此外,TMS乙炔可與1a反應以76%的產率得到3am,其它取代的炔丙胺如1b、1c、1d和1g也可以進行反應并以中等收率(40-65%)得到相應的產物。接下來,作者用含不同官能團如給電子基團p-MeO和吸電子基團p-F、p-Cl取代的芳基乙炔與炔丙胺1e反應,以中等產率得到相應的產物3ea-3ee。
(圖片來源:Chem. Sci.)
首先,作者將優化的反應條件用于N-炔丙基四氫異喹啉衍生物1f和苯乙炔2a的反應(Scheme 2),結果僅以57%的分離產率得到1-烷基化產物。然而,當以ZnI2(10 mol%)為催化劑、1,4-二氧六環為溶劑時,反應以78%的產率得到3fa。另外,TMS乙炔和1-己炔也反應相當。
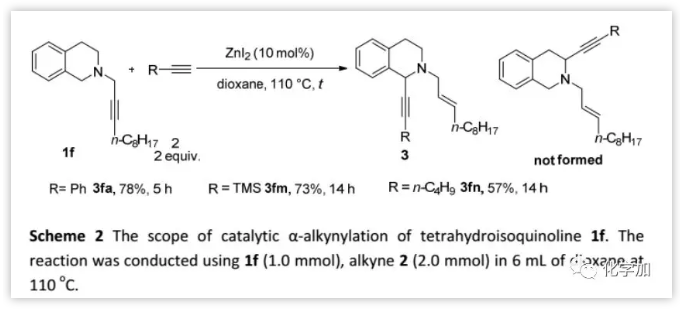
(圖片來源:Chem. Sci.)
對于哌啶衍生物1h,反應需要更大的催化劑負載量并且需要甲苯作溶劑,但收率較低。此外,嗎啉衍生物并不發生反應。
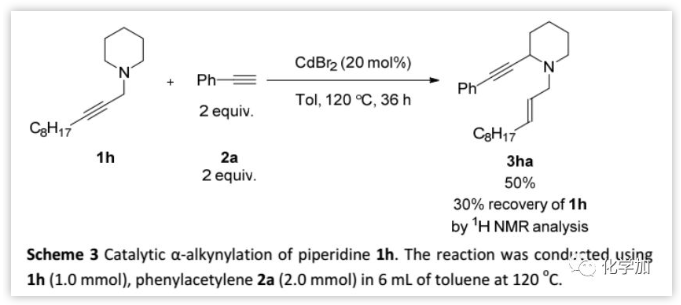
(圖片來源:Chem. Sci.)
此外,作者還研究了幾種非環胺(Scheme 4)。二異丙胺與苯乙炔反應,可以55%的產率得到1,2-十一碳二烯。然而,在標準反應條件下,二異丁胺和二烯丙基胺均未與苯乙炔2a發生反應。
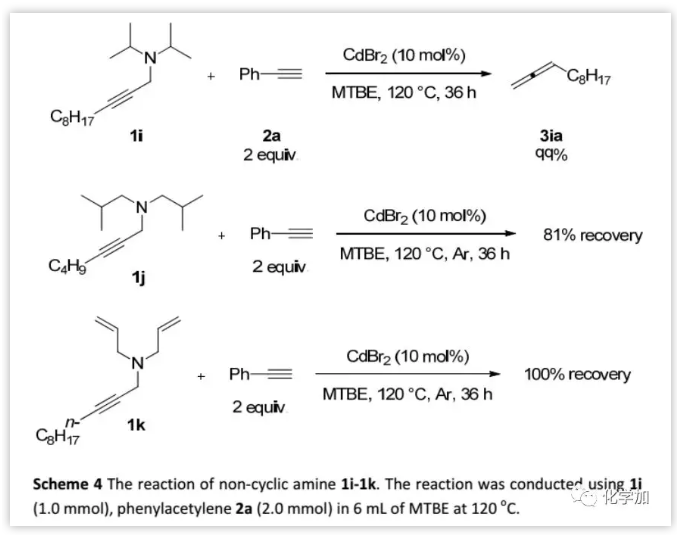
(圖片來源:Chem. Sci.)
氘代實驗(Scheme 5):
為了深入研究反應的機理,在標準條件下,作者用2a處理氘標記的d4-1a得到d4-3aa(95%D),這表明烯丙基的γ-H來自胺的α-位(Scheme 5a)。此外,氘標記的d-2a和1a反應得到產物d2-3aa中,氘代發生在N-烯丙基的2-位(24%D)(Scheme 5b)。在d-2a與3aa反應的對照實驗中,產物不含氘元素(Scheme 5c)。
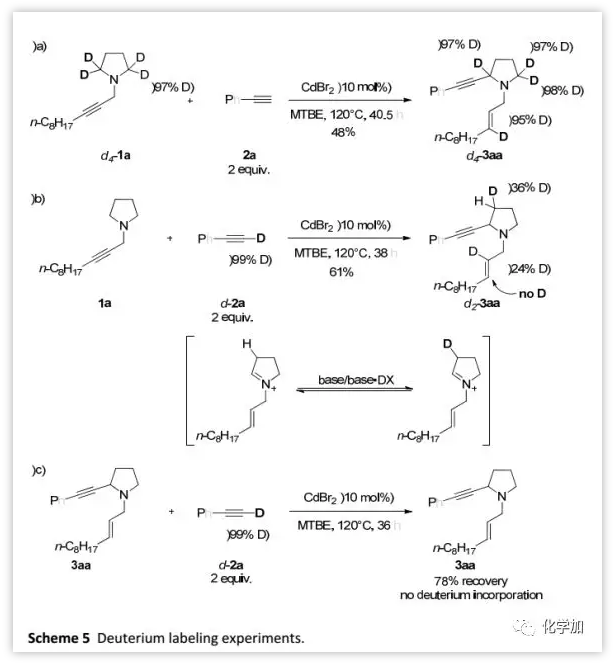
(圖片來源:Chem. Sci.)
基于上述氘代實驗和產物為E構型,作者提出了合理的反應機理(Scheme 6)。炔丙胺1與MX2配位形成Int 1,其經反式-1,5-H遷移形成雙鍵處于E式的陽離子Int 2。隨后,由端炔、CdBr2和胺原位生成的Int 3與亞胺離子Int 2反應得到α-取代的環胺3。此外,由于在eq. b(Scheme 5)的產物中E-烯丙基的3-位未發生氘代,排除了由烯丙胺1'生成產物的可能性,并且CdBr2更易于與C≡C配位從而觸發1,5-H遷移反應。
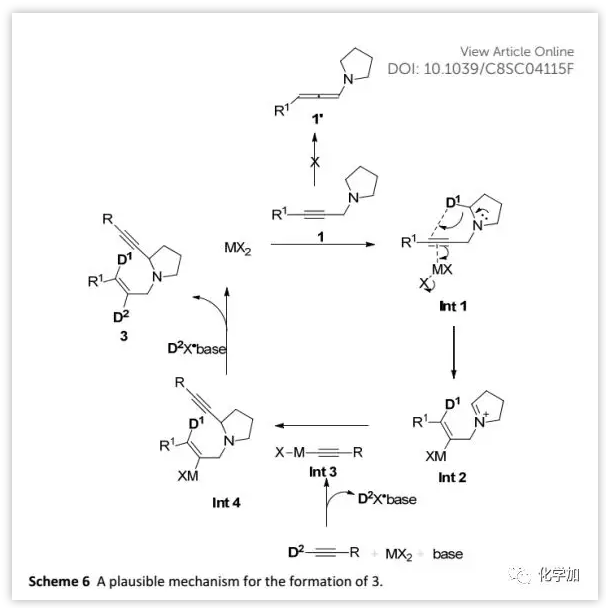
(圖片來源:Chem. Sci.)
合成應用:
作者利用該反應完成了克級規模3ee和3am的制備 (Scheme 7)。此外,作者還證明了這兩種化合物的多樣化合成功能(Scheme 8)。其中,3ee和苯基硼酸進行Suzuki偶聯可以得到5(Scheme 8a);而3am脫除TMS保護基后得到的烯炔6可以與1-三甲基甲硅烷基乙炔基碘反應得到共軛二炔7(Scheme 8b),并且6在Co2(CO)8和DMSO 條件下還可以進行Pauson-Khand反應得到產物8。
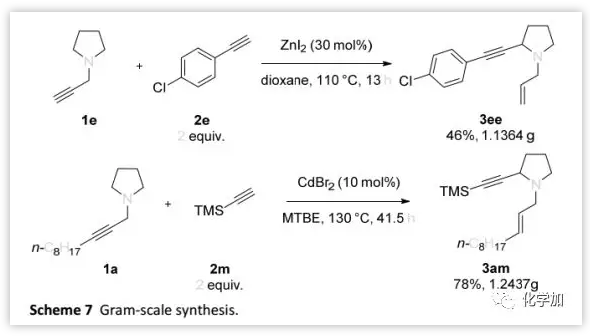
(圖片來源:Chem. Sci.)
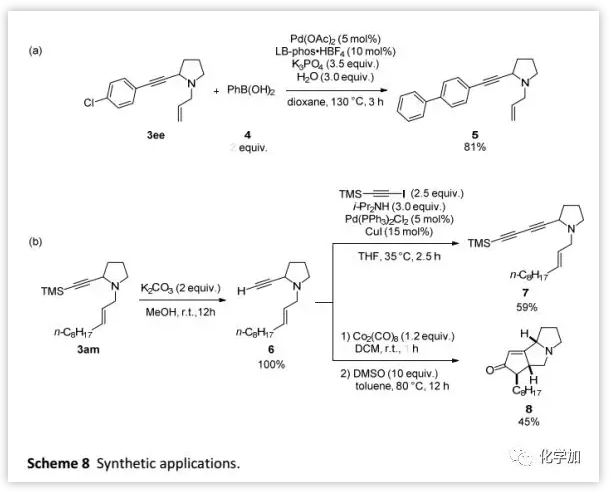
(圖片來源:Chem. Sci.)
小結:麻生明院士課題組開發了一種金屬催化的N-炔丙基環胺的α-炔基化方法,可以高度立體選擇性地得到1-(2(E-烯基)-2-(1-炔基)環胺,該方法在天然產物合成中具有重要的應用。
撰稿:爽爽的朝陽
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn