



由于有機(jī)電化學(xué)是利用電子作為無痕氧化還原試劑,因此這為有機(jī)合成提供了一種綠色可持續(xù)的工具。電化學(xué)可以通過單電子轉(zhuǎn)移實(shí)現(xiàn)極性翻轉(zhuǎn),這導(dǎo)致具有相同極性的兩個(gè)或多個(gè)官能團(tuán)能夠進(jìn)行偶聯(lián)反應(yīng)。目前已有諸多烯烴與兩個(gè)親核試劑進(jìn)行分子間陽極雙官能化的報(bào)道(圖 1a)。然而,大多數(shù)反應(yīng)是向烯烴引入兩個(gè)基于雜原子的官能團(tuán)。
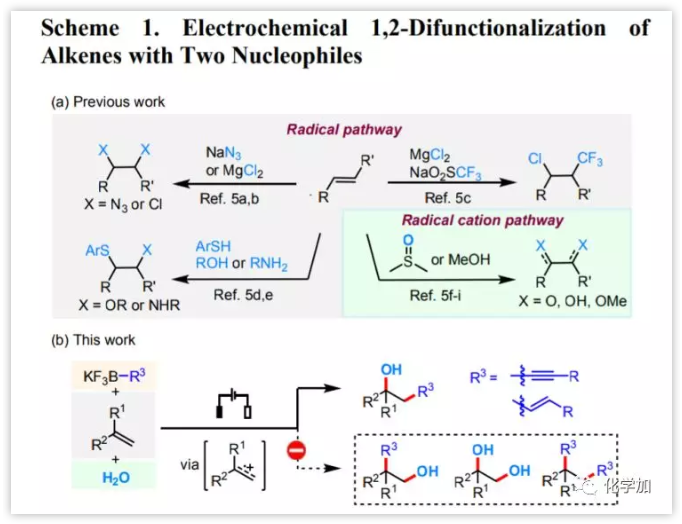
圖1 烯烴的電化學(xué)1,2-雙官能化(圖片來源:J. Am. Chem. Soc.)
炔基三氟硼酸鹽和烯基三氟硼酸鹽因其廉價(jià)易得、穩(wěn)定性好、結(jié)晶性良好而廣泛應(yīng)用于有機(jī)合成。目前,盡管沒有炔基三氟硼酸鹽與自由基物種反應(yīng)的相關(guān)報(bào)道,但烯基三氟硼酸鹽可以與親電自由基和烯胺衍生的自由基陽離子發(fā)生區(qū)域選擇性反應(yīng)。在上述研究的鼓勵(lì)下,近日,廈門大學(xué)徐海超教授課題組經(jīng)烯烴雙鍵連續(xù)與炔基或烯基三氟硼酸鹽和H2O的加成實(shí)現(xiàn)了電化學(xué)促進(jìn)的烯烴區(qū)域和化學(xué)選擇性的羥基炔基化和烯烴化反應(yīng)(圖1b)。
作者首先通過優(yōu)化烯烴1與H2O和炔基三氟硼酸鹽2雙官能化的反應(yīng)條件開始進(jìn)行研究(圖2)。在配備有石墨棒陽極和鉑板陰極的無隔膜電解槽中以含有添加劑KHCO3的MeCN/H2O為混合溶劑,50 ℃恒定電流5 mA下進(jìn)行電解,反應(yīng)效果最佳,以78%的收率獲得單一區(qū)域異構(gòu)體的異丙炔醇產(chǎn)物3。 對照實(shí)驗(yàn)表明,反應(yīng)在室溫(entry 2)或無KHCO3(entry 3)時(shí)效率降低,并且在沒有電流時(shí),反應(yīng)停止(entry 4)。

圖2 條件篩選(圖片來源:J. Am. Chem. Soc.)
然后作者首先通過改變烯烴的取代基來研究反應(yīng)的底物范圍(圖3)。當(dāng)以1,1-二苯基烯烴1為底物時(shí),該反應(yīng)與苯環(huán)上的各種取代基都能相容(4-13)。芳基或烷基取代的烯烴(14-24)也具有良好的耐受性。此外,連有雜芳基取代基的烯烴,如3-吡啶基(25),2-噻唑基(26),2-苯并噻唑基(27)或2-苯并噁唑基(28),均為合適的底物。然而,當(dāng)使用單取代的苯乙烯基烯烴時(shí),產(chǎn)物的收率顯著降低(29,30)。二取代的芳基烯如1-丁烯-1-基苯可以順利得到目標(biāo)產(chǎn)物31,收率55%,盡管其非對映選擇性較低(dr值為1.3:1)。而三取代烯烴1,1-二苯基丙烯的反應(yīng)能以27%和51%的收率得到羥基炔化產(chǎn)物32和鄰二醇33。該烯烴優(yōu)先與H2O反應(yīng),可能是由于空間位阻的需求增加所致。
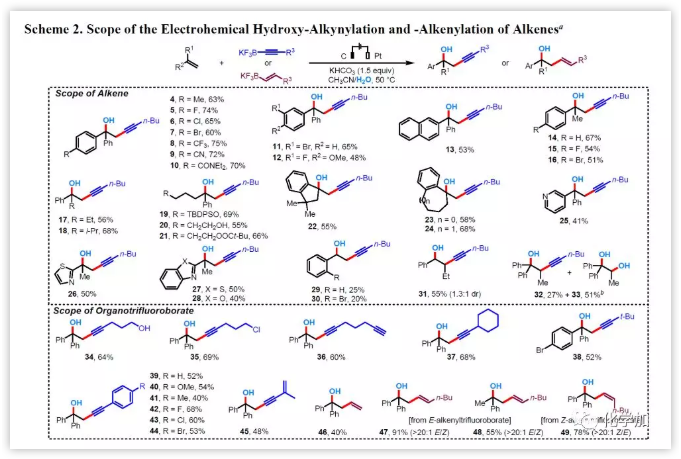
圖3 底物拓展(圖片來源:J. Am. Chem. Soc.)
接下來,作者考察了多種有機(jī)三氟硼酸鉀的適用范圍(圖3)。2中末端丁基部分可由含有羥基(34)、氯(35)或炔基(36)、空間位阻較大的環(huán)己基(37)或叔丁基(38)或?qū)ξ蝗〈?/span>H(39)、甲氧基(40)、甲基 (41)或鹵素(42-44)的苯基環(huán)和烯基(45)代替。令人高興的是,烯基三氟硼酸鹽也適用于該反應(yīng)體系,并以中等至極好產(chǎn)率得到高烯丙醇(46-49)。重要的是,烯基三氟硼酸鹽的立體化學(xué)在反應(yīng)過程中保持一致(47-49)。
進(jìn)一步的研究發(fā)現(xiàn)(圖4),電化學(xué)烯烴二官能化反應(yīng)與其他雜原子親核試劑如甲醇(50)、酰胺羰基(51-67)或羥基(68-69),甚至氟化物(70)相容,并能以良好的收率得到目標(biāo)產(chǎn)物。
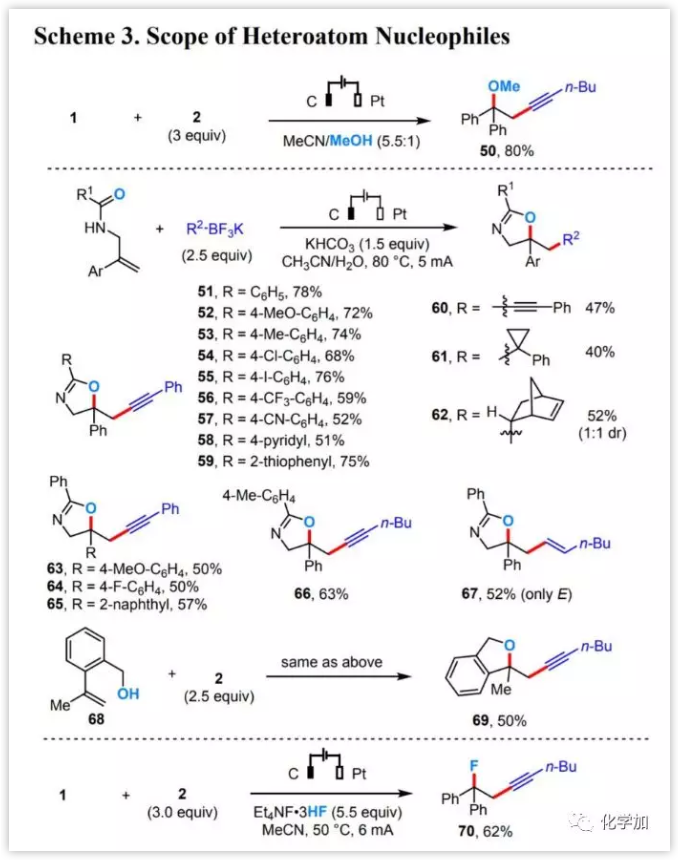
圖4 底物拓展(圖片來源:J. Am. Chem. Soc.)
隨后,作者提出了該電化學(xué)雙官能化反應(yīng)的可能機(jī)理(圖5)。反應(yīng)開始于烯烴A的陽極氧化[Ep/2 (1)=1.57V vs SCE]產(chǎn)生自由基陽離子B,它被有機(jī)三氟硼酸鹽試劑C捕獲[Ep/2 (2)=2.06 V vs SCE],形成碳中心自由基D。D經(jīng)陽極氧化形成碳陽離子E,然后它與H2O反應(yīng)得到最終的醇產(chǎn)物F。在陰極,H2O被還原成H2和HO?。后者被F和添加劑碳酸氫鹽生成的H+所消耗,從而阻止了HO?的累積。
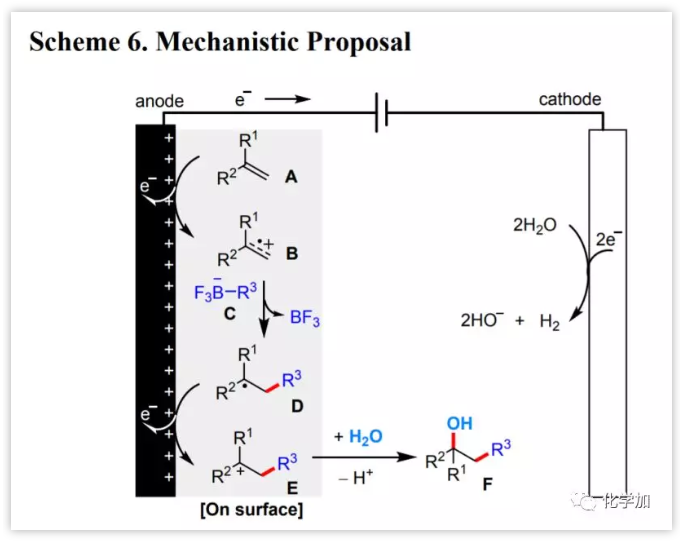
圖5 反應(yīng)機(jī)理(圖片來源:J. Am. Chem. Soc.)
總結(jié):徐海超課題組利用兩個(gè)容易獲得且穩(wěn)定的親核試劑實(shí)現(xiàn)了芳基烯烴的首例區(qū)域和化學(xué)選擇性羥基炔基化和羥基烯基化反應(yīng)。作者利用電化學(xué)促進(jìn)烯烴的1,2-雙官能化,該反應(yīng)不僅無需過渡金屬催化劑和氧化劑,還確保了所得高炔丙醇或高烯丙醇的高區(qū)域和化學(xué)選擇性。
撰稿人:大白菜
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn