



鹵代的手性碳中心廣泛存在天然產(chǎn)物中,雖然天然產(chǎn)物中含氟或碘的手性碳中心很少,但含氯或溴的分子很多。在合成生物活性分子中,含氟的手性碳中心更是常見。其中一些具有顯著的生物活性,如LY-5034304(用于治療帕金森病)。實際上,鹵代以及鹵代碳的立體化學可以顯著改變分子的生物活性。此外,鹵原子通過鹵素鍵合相互作用對化學鍵具有影響。因此,探索鹵代手性碳中心的立體選擇性構(gòu)建方法是一項很重要的研究課題。
烷基鹵化物是有機合成中的常見中間體,可用于烷基化反應、自由基級聯(lián)和烷基交叉偶聯(lián)化學,由于其高反應性和豐富的轉(zhuǎn)化化學而受到合成界的關注。目前,文獻中使用的烯丙基鹵化物主要集中在外消旋化合物上,而沒有手性碳中心的化合物。手性烯丙基鹵代物的制備將為各種親核試劑的不對稱烯丙基化提供新的合成方法。
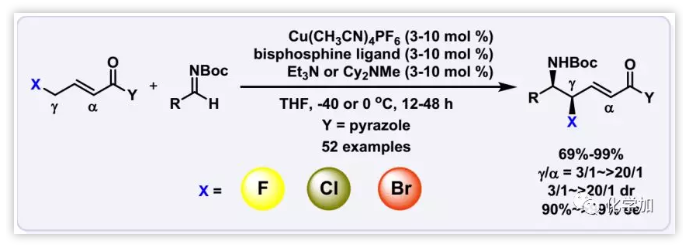
鹵代手性碳中心的催化不對稱構(gòu)建主要有兩個途徑:一種是將鹵素催化不對稱地引入前手性化合物,包括烯烴的親電鹵化和各種親核試劑及親電試劑的鹵化。另一種是鹵代前手性碳的催化不對稱官能化,包括用鹵代烯烴進行對映選擇性轉(zhuǎn)化,用鹵代烯丙基金屬試劑進行的不對稱烯丙基化,α-鹵代烯醇硅醚或烯醇化物的不對稱α-官能化以及三鹵化物的不對稱β-消除等。然而,關于γ-鹵代二烯醇化合物的研究鮮有報道。近日,中國科學院上海有機化學研究所殷亮研究員課題組在J. Am. Chem. Soc.報道了Cu(I)-催化的直接不對稱插烯γ-鹵素(F, Cl或Br)-α,β-不飽和N-酰基吡唑和N-Boc-醛亞胺的Mannich型反應,以構(gòu)建手性鹵代烯丙基碳中心,該反應具有高收率、高區(qū)域性以及高非對映和對映選擇性(Doi: 10.1021/jacs.8b09484)。
之前,作者報道了Cu(I)-催化的β,γ-不飽和N-酰基吡唑和各種醛亞胺的直接催化不對稱插烯Mannich型反應(Scheme 1a),發(fā)現(xiàn)N-酰基-3,5-Ph2-吡唑和龐大的雙膦配體(R)-DTBM-SEGPHOS組合可以控制區(qū)域選擇性。設想弱吸電子鹵素(F,Cl和Br)會酸化γ-質(zhì)子,但不會顯著降低γ-碳的親核性,這將可以在Cu(I)-催化下通過原子經(jīng)濟性插烯Mannich-型反應構(gòu)建鹵代的手性碳中心(Scheme 1b)。
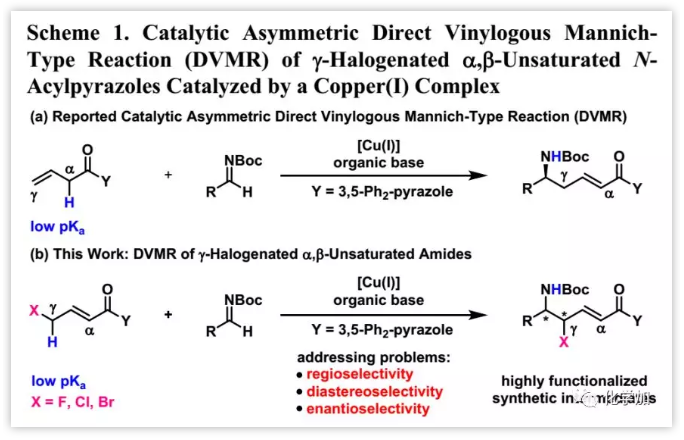
(圖片來源:J. Am. Chem. Soc.)
首先,作者利用γ-F-α,β-不飽和化合物1和N-Boc-醛亞胺2a作為模型底物優(yōu)化反應條件(Table 1)。實驗發(fā)現(xiàn),(R)-BINAP、(R)-TOLBINAP、(R)-SEGPHOS、(R)-QUINAP、(R)-DIFLUORPHOS、(R,R)-QUINOXP*和(R,R)-Ph-BPE均非合適的配體;配體(R,Rp)-TANIAPHOS具有優(yōu)異的區(qū)域選擇性,但非對映選擇性和對映選擇性都不高。大位阻配體(R)-DTBM-SEGPHOS以75%的產(chǎn)率得到乙烯基產(chǎn)物3a,且區(qū)域選擇性>20:1、非對映選擇性>20:1和ee值為98%。將溫度降低至0 ℃產(chǎn)率增加,進一步降低反應溫度導致反應性減弱。對有機堿的研究發(fā)現(xiàn),三乙胺是最好的,并且Cu(I)配合物和有機堿都是該反應必不可少的。
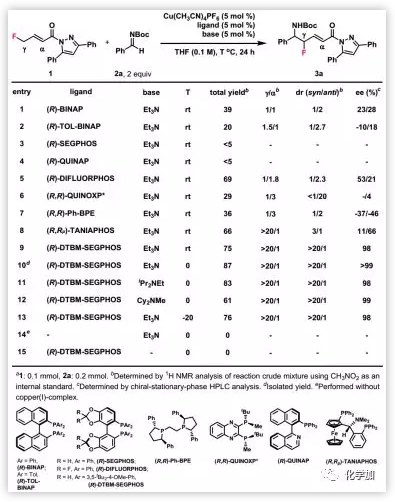
Table 1. 反應條件的優(yōu)化(圖片來源:J. Am. Chem. Soc.)
在優(yōu)化的反應條件下,作者檢測了1和各種NBoc-醛亞胺2的催化不對稱插烯Mannich型反應(Table 2)。芳香族亞胺可與1反應以良好的收率得到乙烯基產(chǎn)物,芳香族亞胺上的給電子和吸電子取代基都具有良好的耐受性,并且取代基在苯環(huán)上的位置對產(chǎn)率和對映選擇性沒有影響;然而,具有空間位阻的鄰位取代的芳族族亞胺產(chǎn)生較差的非對映選擇性。多種官能團如甲氧基、甲基,氟化物、氯化物、溴化物、酯、三氟甲磺酸酯(OTf)和頻哪醇(BPin)等均具有良好的耐受性。需要注意的是,在苯環(huán)上具有Cl、Br、OTf和BPin等官能團的化合物還可以進行過渡金屬催化的交叉偶聯(lián)反應。
醛亞胺2中的苯環(huán)被1-萘基、2-萘基、3-呋喃基和3-噻吩基取代后,均可以高收率、高區(qū)域、高非對映和對映選擇性得到相應的產(chǎn)物。此外,含有酸性α-H且對堿性條件敏感的脂族族亞胺也是該反應的有效底物,然而,會觀察到α-加成物作為副產(chǎn)物。產(chǎn)物中的末端烯烴可以經(jīng)進一步官能團操作得到更復雜的分子。通過3b的X射線晶體學分析,確定產(chǎn)物3的相對構(gòu)型是順式的,其與6a一致。
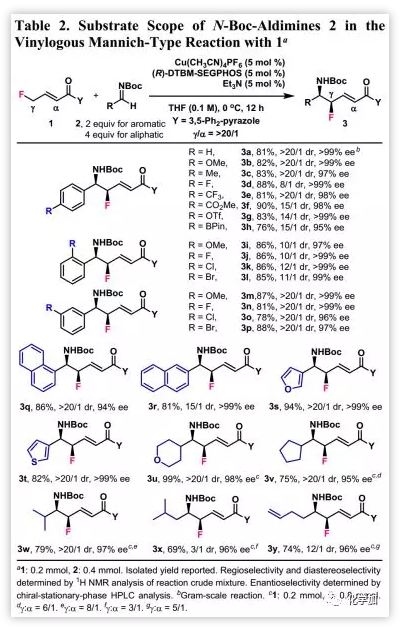
(圖片來源:J. Am. Chem. Soc.)
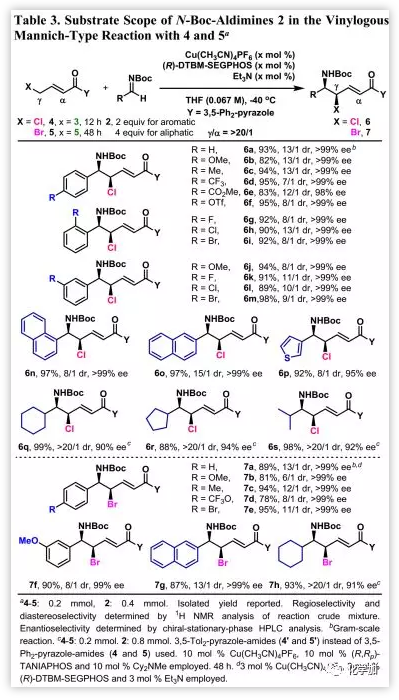
本催化體系也適用于γ-Cl和γ-Br-α,β-不飽和化合物(4和5)(Table 3)。對于氯化物4,3 mol%Cu(I)絡合物和3 mol%Et3N足以催化芳族醛亞胺和雜芳族醛亞胺進行Mannich型反應,并且產(chǎn)率和對映選擇性都很好。然而,在某些情況下,非對映選擇性是適中的。脂族醛亞胺需要10 mol%的Cu(I)絡合物和10 mol%的Cy2NMe才能獲得較好的反應性。此外,由(R,Rp)-TANIAPHOS代替(R)-DTBMSEGPHOS后,在低溫下具有更好的性能。對于溴化物5,其反應趨勢相同。盡管在某些情況下非對映選擇性是中等的,但區(qū)域和對映選擇性均很好。
化合物3a, 6a和7a均可以克級規(guī)模順利進行,表明該方法的穩(wěn)定性,并且經(jīng)X射線衍射分析確定6a中的兩個立體異構(gòu)碳構(gòu)型為R和R,其他乙烯基產(chǎn)物(3, 6b-6p和7a-7g)的構(gòu)型類比確定。由于用于合成6q-6s和7h的配體從(R)-DTBM-SEGPHOS變?yōu)?/span>(R, Rp)-TANIAPHOS,因此其產(chǎn)物的立體化學需要重新確定。經(jīng)X射線晶體學分析確定7h的兩個立體異構(gòu)碳的絕對構(gòu)型為R和R,其他如6q-6s的構(gòu)型類比確定。
(圖片來源:J. Am. Chem. Soc.)
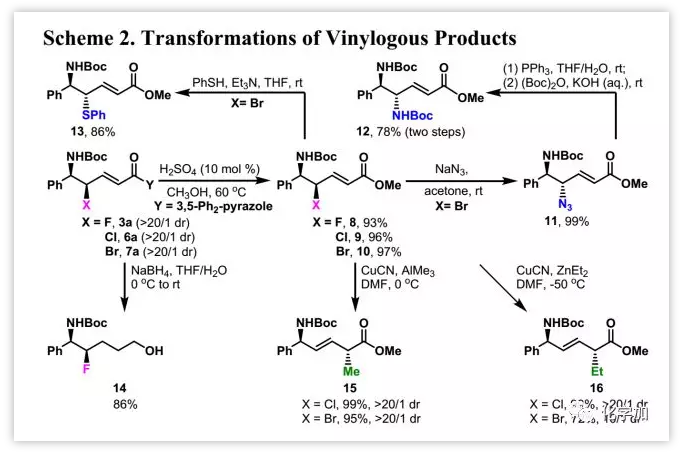
乙烯基產(chǎn)物的轉(zhuǎn)化如下圖所示(Scheme 2):3a, 6a和7a醇解分別得到酯8, 9和10。10與NaN3進行SN2反應產(chǎn)生11,其疊氮基經(jīng)Staudinger還原和(Boc)2O保護產(chǎn)生手性二胺衍生物12,兩步產(chǎn)率為78%;此外,10與PhSH進行SN2反應產(chǎn)生硫醚13,產(chǎn)率為86%。;3a經(jīng)完全還原得到14,產(chǎn)率為86%。文獻報道的烯丙基鹵化物的SN2'取代條件通過加入Cu(I)鹽可略有改變。在CuCN存在下,9和10與AlMe3在0 ℃下的反應得到15且dr>20:1。在-50 ℃下,9與ZnEt2在DMF中反應很好,而10與ZnEt2的反應僅以dr=10:1的比例得到16。其中15中新生成的手性中心通過進一步轉(zhuǎn)化確定為R,16中新生成的手性中心通過類比暫定為R。
(圖片來源:J. Am. Chem. Soc.)
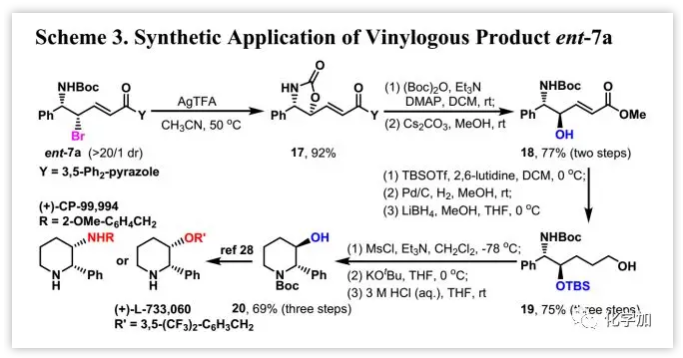
光學富集的插烯產(chǎn)物ent-7a可以進一步轉(zhuǎn)化為具有β-羥基或β-氨基官能團的手性2,3-二取代哌啶(Scheme 3),其常見于天然產(chǎn)物中如選擇性神經(jīng)激肽-1基質(zhì)P受體拮抗劑(+)-L-733,060和(+)-CP-99,994,兩者均可從通用中間體20按照報道的方法合成:ent-7a經(jīng)Ag介導的的分子內(nèi)取代得到中間體17,其酰胺基經(jīng)(Boc)2O保護和噁唑烷-2-酮部分水解得到18,其仲醇用TBS保護,α,β-不飽和部分完全還原得到19,然后經(jīng)環(huán)化、除去TBS得到通用中間體20。
(圖片來源:J. Am. Chem. Soc.)
小結(jié):中國科學院上海有機化學研究所殷亮課題組開發(fā)了一種γ-鹵素(F, Cl或Br)-α,β-不飽和N-酰基吡唑和N-Boc-醛亞胺的催化不對稱插烯Mannich型反應,得到了一系列鹵代烯丙基手性碳中心。該反應具有顯著的優(yōu)點如反應條件溫和,底物范圍廣泛,官能團耐受性良好,并具有良好至優(yōu)異的區(qū)域和立體選擇性。產(chǎn)生的手性烯丙基溴化物在常見的SN2親核取代和與金屬試劑進行銅介導的SN2'烯丙基烷基化反應中是合適的親電試劑。該方法還可以用于不對稱合成兩種手性2,3-二取代哌啶藥物的常見中間體。
撰稿人:爽爽的朝陽
聲明:化學加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn