



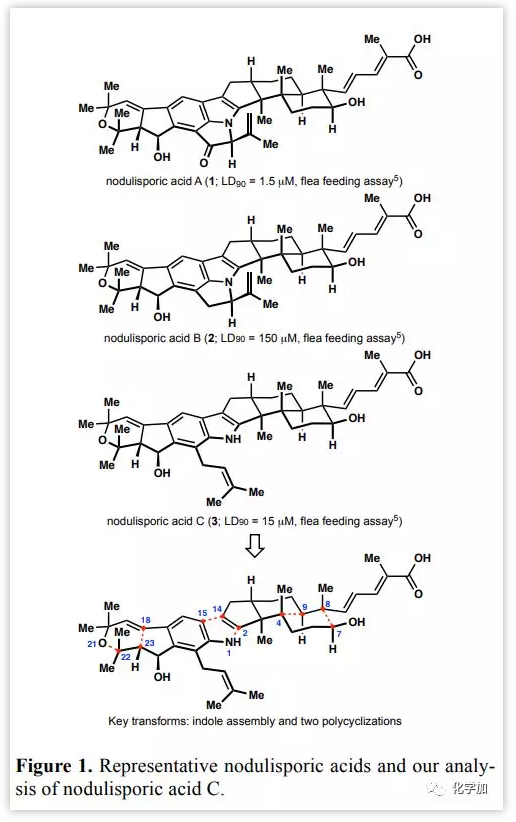
Figure 1:幾種Nodulisporic acid及其逆合成分析(來(lái)源:JACS)
Nodulisporic acid C(3)逆合成分析中關(guān)鍵的轉(zhuǎn)化包括后期吲哚核心的構(gòu)建以形成C14-C15和N1-C2鍵以及兩個(gè)多環(huán)化反應(yīng)以形成萜骨架和茚并吡喃結(jié)構(gòu)。作者設(shè)想通過(guò)由化學(xué)選擇性氫原子轉(zhuǎn)移(HAT)引發(fā)的自由基交叉串聯(lián)反應(yīng)構(gòu)建十氫萘片段中C4-C9和C8-C7鍵以及金催化的環(huán)異構(gòu)化構(gòu)建二氫吡喃片段中C18-C23和O21-C22鍵。
合成路線始于銅催化烷基溴化鎂5與市售環(huán)戊烯酮4的不對(duì)稱共軛加成(Scheme 1)。經(jīng)廣泛的條件篩選發(fā)現(xiàn)JosiPhos衍生物SLJ015-1可作為合適的配體,并以極好的產(chǎn)率和良好的ee值形成烯醇硅醚6。戊炔醇衍生物7與烯醇硅醚6在溴化銦(III)作用下發(fā)生烯基化,經(jīng)酸后處理得到產(chǎn)物8。將環(huán)戊酮8轉(zhuǎn)化為受保護(hù)的氰醇,其經(jīng)歷Sharpless烯丙基氧化和隨后所得二醇的雙重氧化形成二醛9。中間體9在鐵介導(dǎo)的HAT條件下以高度非對(duì)映選擇性的形成反式十氫萘片段,隨后經(jīng)后處理直接獲得目標(biāo)三環(huán)產(chǎn)物11(J. Am. Chem.Soc. 2015, 137, 15410–15413)。值得注意的是, C2位取代基的存在是獲得高非對(duì)映控制的關(guān)鍵。醇11經(jīng)PivOH保護(hù)形成相應(yīng)的新戊酸酯,其與膦酸酯12通過(guò)Horner-Wadsworth-Emmons烯化反應(yīng)得到酮13。
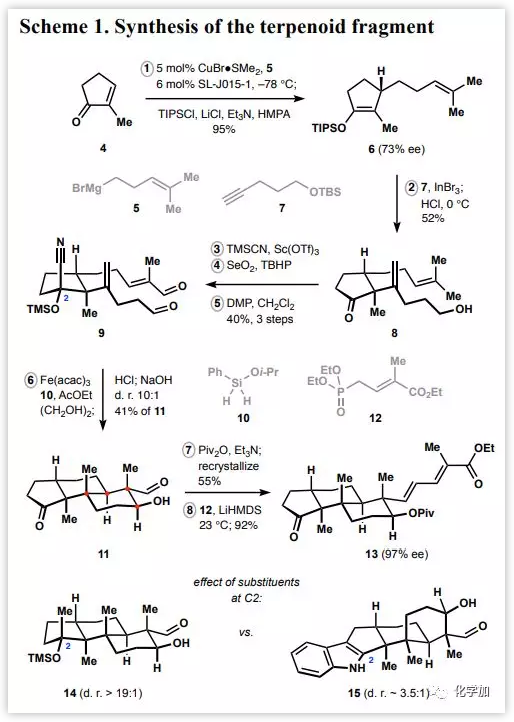
Scheme 1:萜骨架的構(gòu)建(來(lái)源:JACS)
得到nodulisporic acid C中十氫萘片段后,作者接著構(gòu)建目標(biāo)天然產(chǎn)物的茚并吡喃片段(Scheme 2)。合成從三步生成芳烴17開始,其中包括市售苯胺16的碘化,中間體碘化物的甲酰化和所得芳烴的硝化。接著,在催化量的氨基醇19存在下,醛17與二有機(jī)鋅18進(jìn)行加成并高效得到具有高對(duì)映選擇性的芐醇20。二溴20與炔烴21發(fā)生Sonogashira偶聯(lián),中間體二醇經(jīng)保護(hù)得到環(huán)異構(gòu)化前體22。隨后,作者利用催化量的金(I)絡(luò)合物處理烯炔22以高收率和高立體選擇性形成二氫吡喃23。該過(guò)程可能涉及起初異丁烯片段對(duì)炔烴-金絡(luò)合物的親核攻擊,隨后羥基側(cè)鏈捕獲所得的叔碳陽(yáng)離子。作者在反應(yīng)體系中觀察到的聯(lián)烯26,它可能是經(jīng)烯基-金中間體的消除形成,這進(jìn)一步支持了上述推測(cè)。與二氫吡喃28相比,產(chǎn)物23和27為單一的非對(duì)映異構(gòu)體,這也證實(shí)了C26位的取代基對(duì)于在反應(yīng)過(guò)程中獲得高水平的立體控制是至關(guān)重要的。作者推測(cè)芐醚和鄰位取代基之間的烯丙基張力在初始環(huán)化的過(guò)渡狀態(tài)中迫使硅基向反應(yīng)中心旋轉(zhuǎn),這使產(chǎn)物23和27的非立體選擇性顯著增強(qiáng)。隨后,溴化物23與錫烷24經(jīng)Stille偶聯(lián)以良好的收率得到氯代芳烴25。
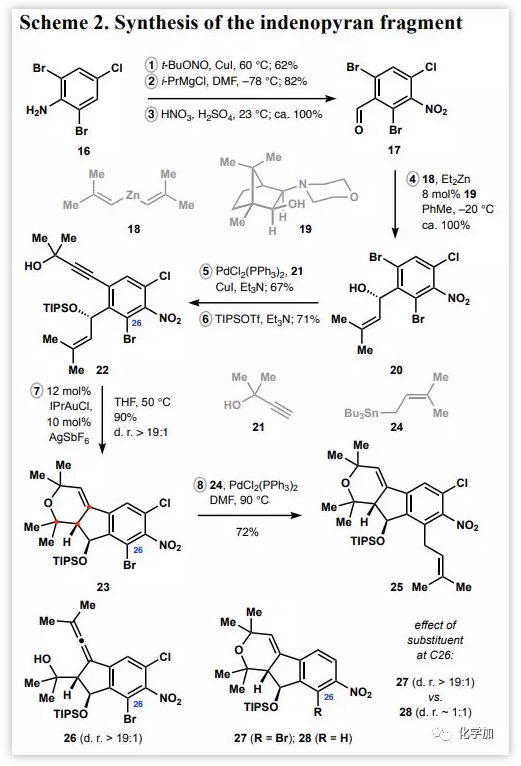
Scheme 2:茚并吡喃片段的合成(來(lái)源:JACS)
經(jīng)過(guò)大量實(shí)驗(yàn),作者發(fā)現(xiàn)酮13的三烷基錫烯醇化物能與氯代芳烴25進(jìn)行鈀催化的芳基化反應(yīng),其中以基于RuPhos的鈀預(yù)催化劑效果最佳,并以非對(duì)映選擇性的方式形成芳酮30(Scheme 3)。接著,在乙酸存在下用鋅處理芳基化產(chǎn)物30高效地構(gòu)建了吲哚核心,最后經(jīng)脫硅基保護(hù)和二酯的水解實(shí)現(xiàn)了nodulisporic acid C的不對(duì)稱全合成。
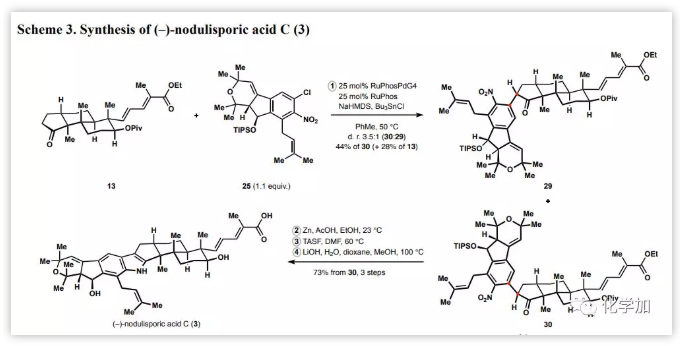
Scheme 3:nodulisporic acid C的不對(duì)稱全合成(來(lái)源:JACS)
總結(jié):Sergey V. Pronin教授課題組以高度匯聚的方式經(jīng)12步實(shí)現(xiàn)了(-)-nodulisporic acid C的對(duì)映選擇性全合成。作者利用兩個(gè)多環(huán)化反應(yīng)快速構(gòu)建十氫萘和茚并吡喃骨架和酮芳基化方法將兩個(gè)復(fù)雜片段聯(lián)合,這使得整個(gè)合成路線十分簡(jiǎn)潔。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn