

過渡金屬催化的烯烴二芳基化反應通過一步操作能同時在雙鍵上引入兩個芳基,從而可有效構建具有手性中心的復雜且有用的化合物,但通過添加兩個芳基親電試劑(ArX)而不需要預先制備的有機金屬試劑的烯烴還原二芳基化反應還未得到開發(圖1A)。另一方面,催化的不對稱烯烴二芳基化反應也僅有少量報道(圖1B)。
本文作者在過渡金屬催化烯烴的不對稱二碳官能團化反應中,最近發現了一種Ni催化的串聯 Heck環化/Suzuki偶聯反應,實現了烯烴的二芳基化,但這一串聯反應的不對稱版本一直沒有嘗試成功。受鎳催化的不對稱Heck環化反應的最新進展啟發,作者決定利用鎳催化劑的易氧化加成和易得到多種氧化態的能力,通過對映選擇性Heck環化/捕獲原位生成的σ-烷基Ni(Ⅱ)物種,來實現鎳催化的烯烴對映選擇性還原二芳基化反應。
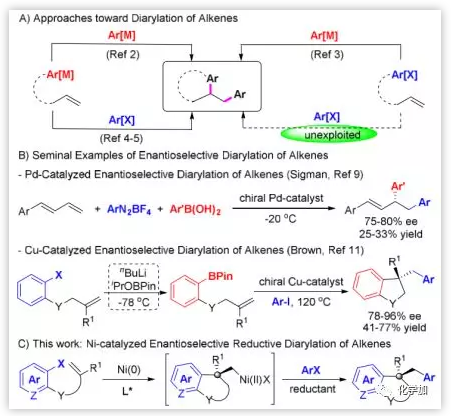
圖1. 過渡金屬催化的烯烴對映選擇性二芳基化反應
(圖片來源:J. Am. Chem. Soc.)
作者以N-(2-溴苯基)N-甲基甲基丙烯酰胺1a和溴苯2a的反應為模板反應,對反應條件進行了探索。在Ni(COD)2(10 mol%)、L1(20 mol%)、B2Pin2(2 Eq.)、ZnO(2 Eq.)、K3PO4(2 Eq.)作堿,DMA為溶劑的條件下,以83%的收率得到目標產物氧化吲哚3aa(圖2,entry 1)。對手性配體L2-L11進行全面考察(entry 7-15),表明PHOX-型配體L11在立體選擇性方面最為有效(91% ee,entry 15),L11的二茂鐵骨架對該反應的選擇性至關重要。碘源可提高交叉親電偶聯反應的活性,KI的加入使3aa的收率提高到63%,而不影響對映選擇性(entry 16)。一系列的控制實驗表明,在沒有Ni0催化劑、Zn0或配體(entry 18-20)的情況下,未形成產物。在不含B2Pin2的條件下,產率也下降至28%,但保留了對映選擇性(entry 21和17)。
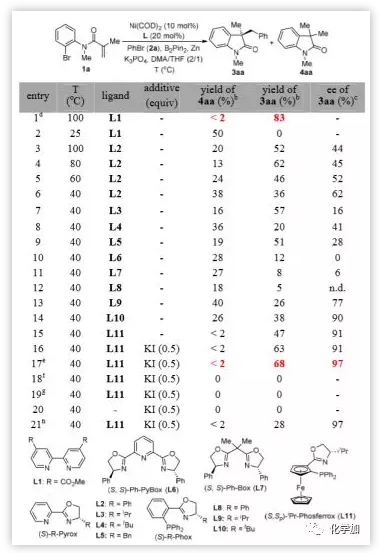
圖2. 反應條件的優化
(圖片來源:J. Am. Chem. Soc.)
有了最佳反應條件,作者考察了芳基溴代物2的適用范圍。令人高興的是,各種芳基溴代物都能經過環化交叉偶聯得到目標產物,且具有優良的對映選擇性(圖3)。烷氧基、氨基、氟和縮酮等官能團具有良好的耐受性(3ab-3aj)。值得注意的是,氰基在以前的方法中是有問題的,能在該反應中兼容 (3ag)。X射線晶體分析確定了3al的絕對構型為3R,并對所有其它產物的絕對構型也進行了相應的確認。硼酸鹽官能團化的芳基溴以60%的收率和90% 的ee順利得到3am,為進一步官能團化提供了機會。為了進一步證明該方法的通用性,作者研究了多個雜環的還原交叉偶聯反應。苯并二氧嘧啶(3an)、吡啶(3bo)、二苯并呋喃(3ap)、二苯并噻吩(3bq)、吲哚(3ar)和苯并呋喃(3bs)等都可以有效地轉化成相應的產物,且具有良好的產率和優秀的對映選擇性。苯丙氨酸衍生物的交叉偶聯提供了所需的產物(3bt),而不影響手性中心。不同取代芳基溴代物的ee值無明顯差異,表明反應的對映選擇性決定步驟是遷移插入。
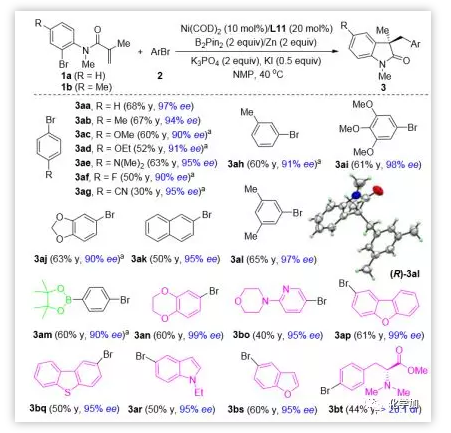
圖3. 芳基溴代物底物的擴展
(圖片來源:J. Am. Chem. Soc.)
接下來作者考察了關于烯烴連接的芳基溴代物1的底物范圍(圖4)。首先研究了苯胺部分的苯環上的取代模式。對-,間-和鄰-甲基和對-氟苯胺底物都能以高對映選擇性轉化成相應產物3ba-3ea。值得注意的是,官能團Cl和OMe也能兼容,可用于進一步的轉化(3fa-3ga)。更重要的是,該反應能成功地應用于氮雜氧化吲哚3ha的合成,產率為50%,ee為94%,這在天然產物和藥物發現種具有重要意義。作者還研究了丙烯酰胺雙鍵的Cα取代基(R3)對反應結果的影響。芐基、正己基、異丙基和甲氧甲基取代基都能兼容,得到相應的氧化吲哚3ib-3kb和3li,產率良好,對映選擇性優良。 N-芐基乙酰苯胺1m的環化交叉偶聯反應也能順利地進行,得到3mi,由于N-芐基易除去,因此它是合成氮上去保護的氧化吲哚的有效途徑。
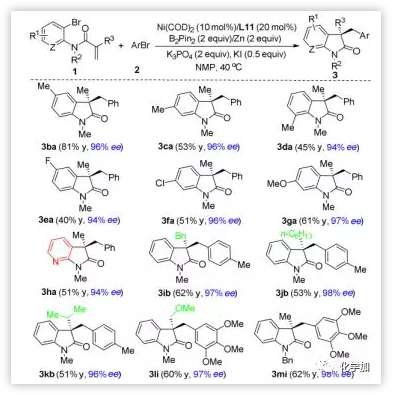
圖4. 烯烴底物的擴展
(圖片來源:J. Am. Chem. Soc.)
雖然對映體富集的二氫吲哚5aa不能通過2-溴-N-甲基-N-(2-甲基烯丙基)苯胺與2a的環化交叉偶聯直接合成,但用LiAlH4還原(R)-3aa能夠有效獲得對映體富集的吲哚啉5aa,并能取得優異的產率,同時保持對映體純度。(R)-3aa的區域選擇性溴化能以94%的收率和90%的ee得到3na,能進一步官能團化(圖5)。
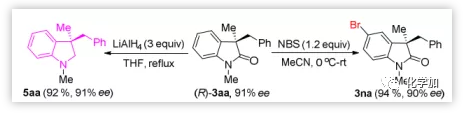
圖5. 合成對映體富集的氧化吲哚
(圖片來源:J. Am. Chem. Soc.)
為了研究反應機理,作者設計了一系列控制實驗。將PhZnBr投入到優化的反應條件中,沒有3aa生成。沒有鎳的條件下(圖2,entry 18)沒有消耗原料,這表明鋅不可能直接插入芳基溴中。使用有機還原劑TDAE(四(二甲基氨基)乙烯)代替Zn0能以顯著的收率得到3aa。在不存在B2Pin2的情況下,也能觀察到3aa,證明催化途徑可以在不存在任何硼中間體的情況下進行。為了進一步理解芳基硼酸鹽在催化循環中的作用,在該交叉偶聯反應中加入PhBPin,未檢測到3aa,表明B2Pin2可能充當了還原劑的角色。
室溫下1a通過氧化加成和隨后的遷移插入能形成σ-烷基-Ni(Ⅱ)配合物6,同時,室溫下反應能以50%的產率得到4aa且未檢出3aa, 這表明環化過程并不是催化循環的決速步。當配合物6以化學計量比的方式使用時,在沒有Ni0催化劑的情況下,產物3aa的收率為35%,4aa的收率為34%(Eq 5),從而支持了σ-烷基-Ni(II) 6作為催化循環關鍵中間體的機理。由于Ni(0)與芳基鹵化物的氧化加成是可逆的,作者認為遷移插入過程(對映選擇性決速步)應該是不可逆的。最后,合成2-甲苯基-Ni(II)絡合物7,并將其投入反應條件(不含Zn0),以20%的產率得到3au。Ni(II)絡合物6與7反應能以25%的產率形成3au,這表明不能排除轉金屬化的機理。
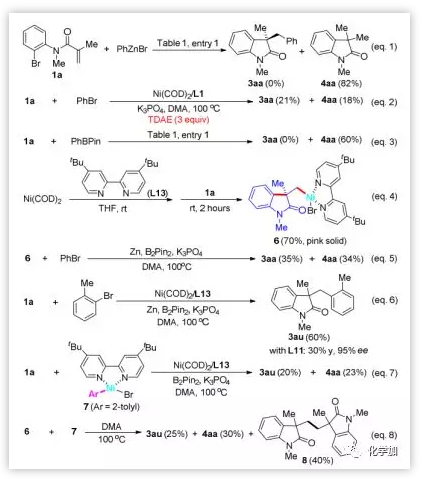
圖6. 機理研究
(圖片來源:J. Am. Chem. Soc.)
基于上述結果和先前對交叉親電偶聯的研究,作者提出了如圖7所示的機理,其中包括了兩個可能反應途徑。芳基溴代物1氧化加成到Ni(0)物質上,然后進行分子內碳鎳化,產生σ-烷基-Ni(II)X物質A,被化學計量的Zn/Pin2B2還原,所得的σ-烷基-Ni(I)中間體B與芳基溴2第二次氧化加成形成σ-烷基-Ni(III)ArX物質C,還原消除再生Ni(0)催化劑的同時得到所需產物3(圖7,途徑A)。另一種合理的Ni(0)/ Ni(II)催化循環,涉及Ni(II)中心A和D之間的金屬轉移,形成σ-烷基-Ni(II)ArX物種E,還原消除得到產物3(圖7,途徑B)。
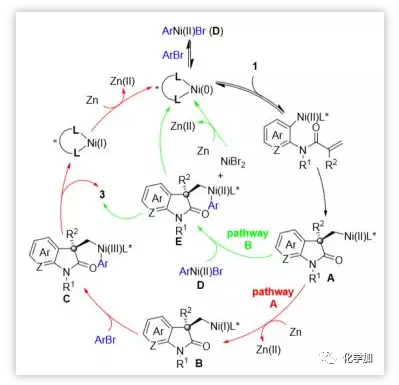
圖7. 可能的反應機理
(圖片來源:J. Am. Chem. Soc.)
小結:孔望清教授課題組發展了一種機理上全新的烯烴二芳基化方法,鎳催化條件下兩個不同的芳基溴通過串聯Heck環化/還原交叉偶聯反應實現了烯烴的對映選擇性二芳基化。該反應條件溫和,具有良好的官能團耐受性,產率良好,且具有優良的對映選擇性,可構建各種含有全碳季碳中心的雙雜環,在活性分子及藥物改造中具有潛在的應用價值。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn