

中環(8-11元)內酰胺廣泛存在于天然產物和生物活性分子中,比如decursivine,lyngbyatoxin,rhazinilam。然而,不利的跨環相互作用以及熵焓原因使這類骨架的合成顯得頗具挑戰性。由于擴環策略摒棄了直接頭尾相連的合環方法而且相對于環加成策略更能靈活地獲得各種大小的環系。因此,幾十年來,擴環方法得到了廣泛的應用并取得了蓬勃的發展。
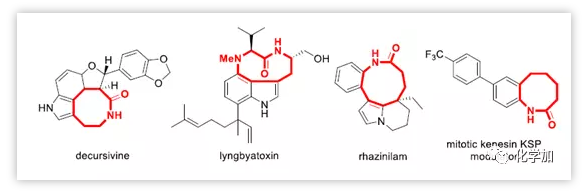
圖1 具有生物活性的中環內酰胺
相比而言,酮是一種非常優異的擴環底物,經典的反應包括Beckmann重排、Schmidt重排、bicyclic oxaziridine重排以及由此衍生的氮插入重排(N+1)。這類反應需要預先合成環酮,因此常被用于7元環或更小的內酰胺骨架的合成。第二類方法可通過N-親核試劑對羰基加成串聯retro-aldol反應來構建N+2,N+3和N+4的內酰胺環(大于9元環)。第三類方法可通過親核加成串聯oxy-2-azonia-Cope重排來實現N+4的擴環。后兩種方法雖然可制備較大以及含有雜原子的中環,但也需要通過多步反應合成底物環酮。另外,對于8元環內酰胺的合成均不具有普適性。
近日,南方科技大學劉心元課題組利用光催化的自由基的(雜)芳基遠程C→N遷移,通過N+3擴環策略發展了由(雜)芳基環酮制備中環(8-11以及11-13元)內酰胺環新方法。
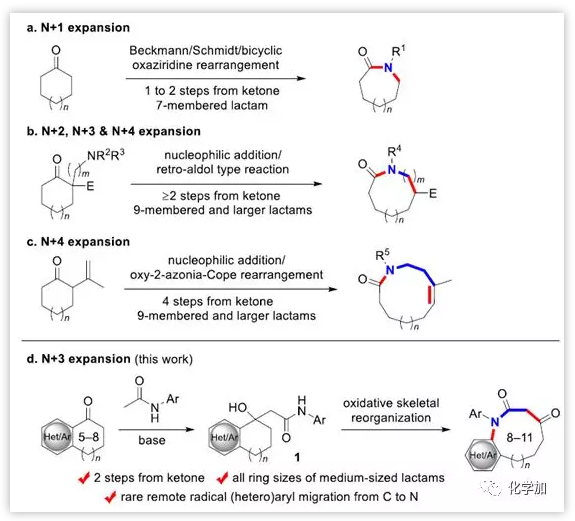
圖2 擴環策略
首先,作者以1A為底物對反應條件進行了篩選。結果顯示以Ru(bpy)3Cl2.6H2O (1.5 mol%)為光催化劑,BI-OAc(1.5 equiv)為氧化劑,DCE為溶劑,藍色LED燈為光源室溫反應5小時可以83%的分離產率獲得目標產物2A。控制實驗表明,光照、BI-OAc以及光催化劑對反應都是必要的。
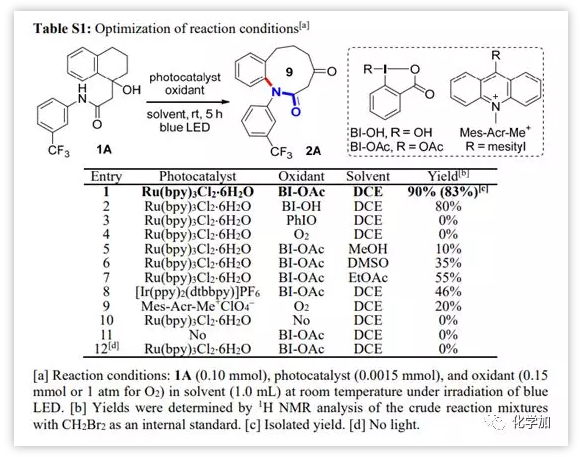
圖3 反應條件優化
緊接著,作者對反應的底物適用性進行了考察。5-8元環底物可通過N+3擴環得到8-11元環的內酰胺。R2及R1為吸電子或給電子基的5元環底物,可以順利反應得到8元環內酰胺。然而,R2為強給電子基的OCH3時,由于氧化降解并不能得到目標產物。由于甲基與大環之間的空間位阻的原因,含有雙甲基的底物1O反應速率變慢。另外,含有額外稠和芳環的1Sa、1Sb、1T也可以分別反應得到8元環的6a、6b以及10元環的7。
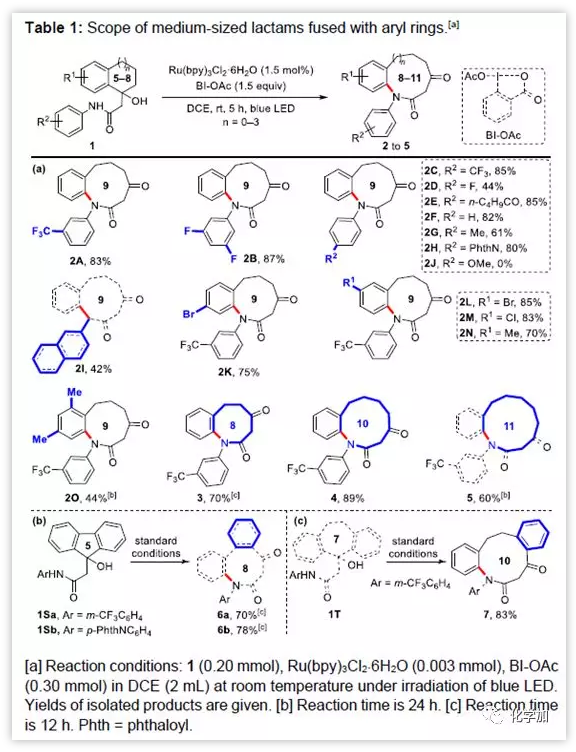
圖4 底物擴展
進一步,作者嘗試了雜環酮的擴環反應。結果顯示,含有吡啶、喹啉、噻吩等雜環的6-8元環底物也可以通過擴環反應得到9-11元環的內酰胺。作者通過X-射線單晶衍射確證了化合物12的結構。
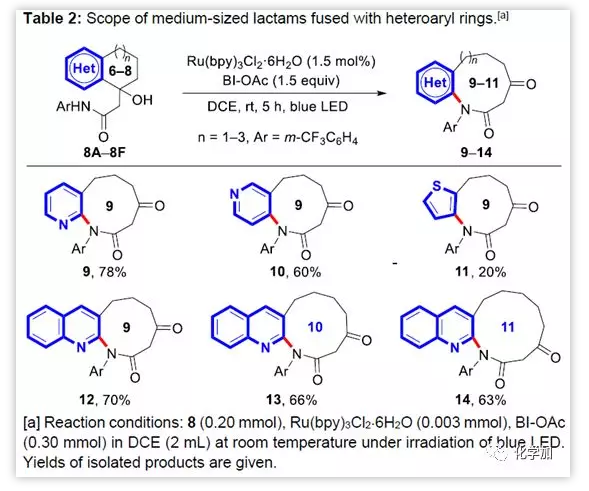
圖5 稠合雜環底物的擴環反應
為了驗證該反應的實際應用價值,作者對部分底物進行了衍生化。6b中N-芳基可以通過兩步反應脫去得到產物15。2F可以經兩步反應衍生得到被吡唑稠合的產物16。另外,作者發現9-11元環的β-羰基內酰胺可以與3-溴丙胺反應得到13-15元環的內酰胺17-19。
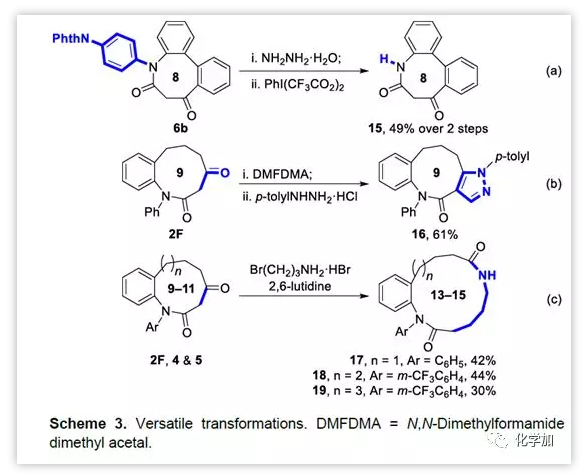
圖6 衍生化反應
作者接下來對該反應的機理進行了研究。首先,作者發現自由基抑制劑TEMPO可以有效抑制1A的反應,說明該反應可能經歷了自由基的反應歷程。其次,作者發現1U可以在標準條件下在CHCl3或CDCl3為溶劑中反應得到氫胺化的產物2U和d-2U(通過自由基攫氫),說明反應中可能涉及胺基自由基。進一步的電子效應比較實驗證實了該設想。另外,作者通過發光淬滅實驗證實了BI-OAc是淬滅激發態Ru(II)的物種,而不是底物。循環伏安法實驗顯示,BI·自由基和羧酸共同氧化底物形成胺基自由基。
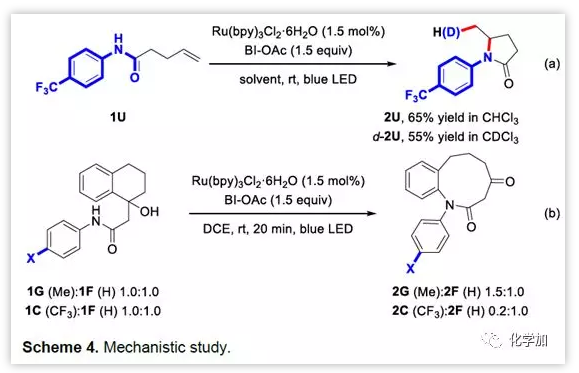
圖7 機理的研究
最后,作者提出了該反應可能的機理:激發態的Ru(bpy)32+*被BIOAc氧化得到Ru(bpy)33+ 和BI·;底物1被BI·和羧酸氧化得到胺基自由基中間體I;胺基自自由基進攻芳環得到中間體II,并發生C-C鍵斷裂得到中間體III;Ru(bpy)33+與中間體III發生單電子轉移得到目標物2。
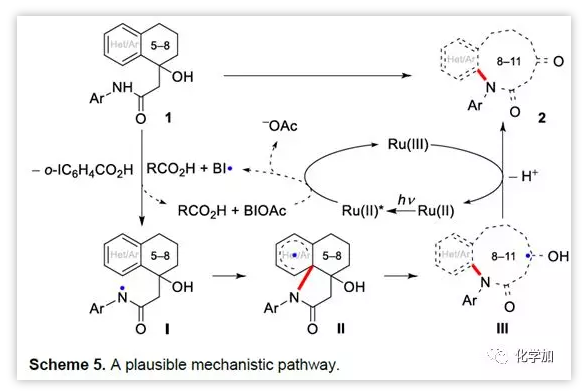
圖8 可能的反應機理
結語:南方科技大學劉心元課題組利用光催化的自由基的(雜)芳基遠程C→N遷移,通過N+3擴環策略發展了由(雜)芳基環酮制備中環(8-11以及11-13元)內酰胺的新方法,反應具有寬的底物范圍,良好的官能團容忍性,高產率以及溫和的反應條件。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn