



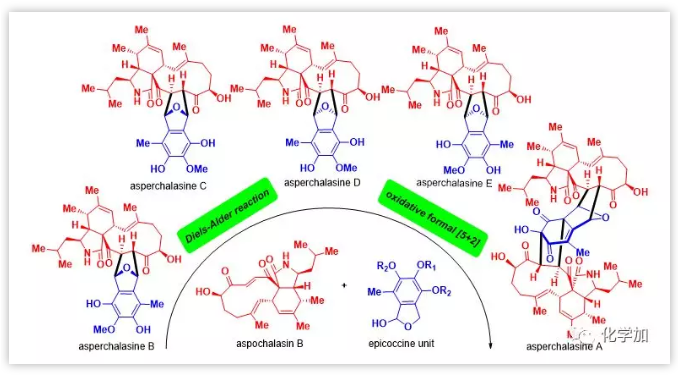
最近,華中科技大學(xué)張勇慧教授及其同事從Aspergillusflavipes發(fā)酵液中發(fā)現(xiàn)了一系列真菌次級代謝產(chǎn)物,統(tǒng)稱為merocytochalasans。在結(jié)構(gòu)上,該類分子均由兩種亞結(jié)構(gòu)單元組成,即三環(huán)cytochalasan和雙環(huán)epicoccine,如代表性分子1-13所示(Figure 1)。其中,asperchalasinesB-H(1-7)包含由一個(gè)cytochalasan單元和一個(gè)epicoccine單元組成的T形六環(huán)骨架,而asperchalasine A(8)含有更復(fù)雜的夾心十二環(huán)骨架,由一個(gè)epicoccine單元和兩個(gè)cytochalasan單元組成。其它典型的三聚體還包括asperflavipine B(9),epicochalasines A(10),B(11)以及aspergilasine A(12),這些分子都包括一個(gè)cytochalasan單元和兩個(gè)籠狀epicoccine單元。AsperflavipineA(13)是該家族中目前發(fā)現(xiàn)的唯一的四聚體,具有極其復(fù)雜的啞鈴形十四環(huán)骨架。從合成的角度來看,這類化合物表現(xiàn)出的多環(huán)系、多手心中心和多官能團(tuán)的特點(diǎn)給合成化學(xué)家?guī)砹司薮蟮奶魬?zhàn)。
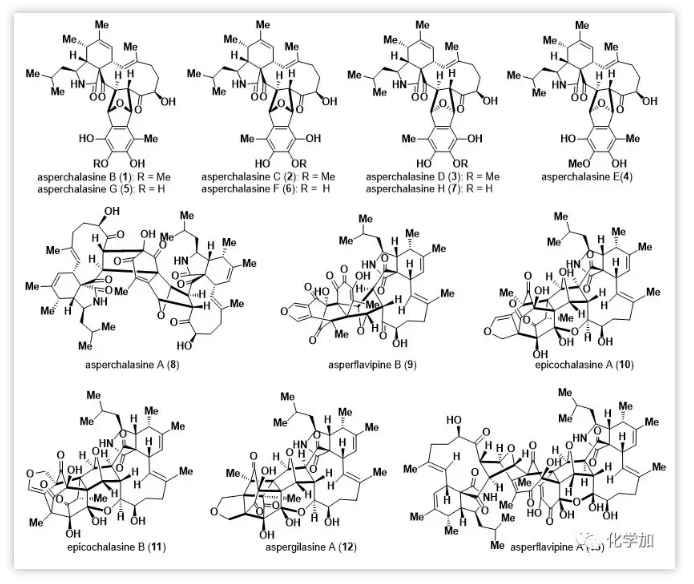
Figure 1.Representative merocytochalasans.
Merocytochalasans家族化合物表現(xiàn)出突出的生物學(xué)活性:asperchalasine A(8)可以通過選擇性抑制癌細(xì)胞中的細(xì)胞周期蛋白A,CDK2和CDK6來誘導(dǎo)G1期細(xì)胞周期的停滯,而對正常細(xì)胞沒有明顯影響,這凸顯了其作為針對癌細(xì)胞的選擇性細(xì)胞周期調(diào)節(jié)劑的潛力;epicochalasines A(10)和B(11)均可通過caspase-3激活和PARP降解誘導(dǎo)白血病細(xì)胞中G2/M期細(xì)胞周期停滯和凋亡。
上述分子發(fā)現(xiàn)大大豐富了細(xì)胞松弛素家族天然產(chǎn)物的化學(xué)結(jié)構(gòu)和生物活性多樣性,也是近年來天然產(chǎn)物領(lǐng)域的亮點(diǎn)之一。然而,到目前為止,化學(xué)家們?nèi)晕磳?shí)現(xiàn)merocytochalasans家族化合物的全合成。出于對該類化合物的挑戰(zhàn)以及對cytochalasans家族持續(xù)的研究興趣,清華大學(xué)唐葉峰、劉剛教授課題組在Angew. Chem. Int. Ed.上報(bào)道了Asperchalasines A-E以及相關(guān)同源物的首次全合成(DOI:10.1002/anie.201808249)。
基于生源途徑的asperchalasines合成策略(Figure 2):
所有目標(biāo)產(chǎn)物均源于兩種常見的前體aspochalasin B(14)和epicoccine(15),可通過各類異二聚化或-三聚化得到。Epicoccine(15)經(jīng)氧化產(chǎn)生的鄰醌類化合物16a和16b進(jìn)一步異構(gòu)化為異苯并呋喃16c,與aspochalasinB(14)進(jìn)行分子間Diels-Alder反應(yīng)。由于潛在的內(nèi)/外型選擇性和區(qū)域選擇性,Diels-Alder反應(yīng)可以產(chǎn)生四個(gè)異二聚體即asperchalasinesF-H(5-7)和17。接下來,5-7和17通過選擇性甲基化得到asperchalasines B-E(1-4)。同時(shí),17也可以經(jīng)氧化得到鄰醌類化合物18,然后與14通過串聯(lián)邁克爾加成/羥醛反應(yīng)(即形式[5+2]環(huán)加成)最終產(chǎn)生異三聚體asperchalasineA(8)。
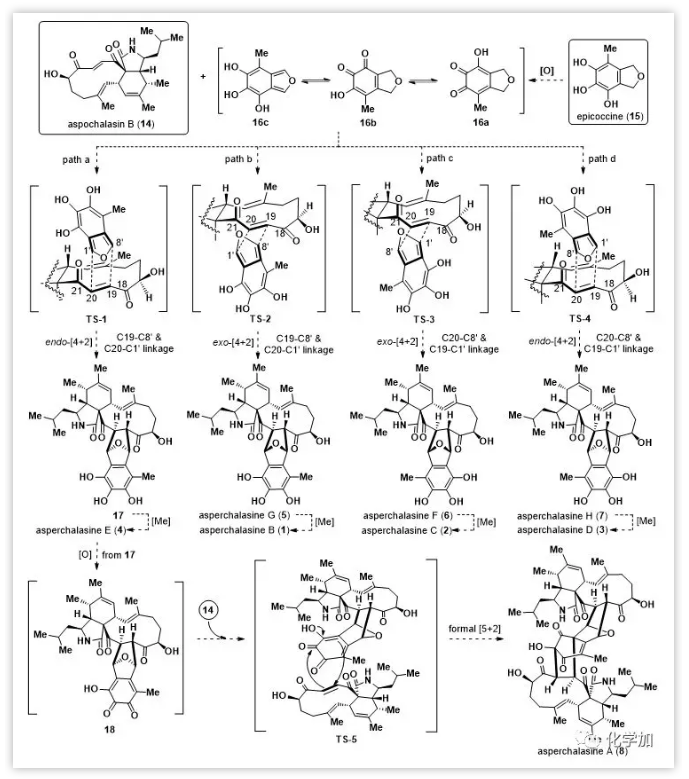
Figure 2.The plausible biosynthetic origin of asperchalasines.
Cytochalasan和epicoccine前體的制備:
Epicoccine及其衍生物可以通過Trauner課題組開發(fā)的方法制備。對于[11]-cytochalasans,Trost課題組曾報(bào)道了aspochalasin B(14)全合成;此外,其它幾個(gè)同源物也由Thomas和Vedejs課題組合成。盡管如此,仍需一種更簡潔,可擴(kuò)展和通用的合成路線得到aspochalasin B(14)。作者認(rèn)為,從共同的三環(huán)中間體19出發(fā),經(jīng)過后期官能團(tuán)轉(zhuǎn)化可以得到包括14在內(nèi)的大多數(shù)具有11元環(huán)的細(xì)胞松弛素單體(Figure 3)。而19可以通過兩個(gè)環(huán)構(gòu)建反應(yīng)(分子間Diels-Alder反應(yīng)構(gòu)建異吲哚酮雙環(huán)母核和關(guān)環(huán)復(fù)分解反應(yīng)構(gòu)建11-元大環(huán))由片段21和22組裝起來。
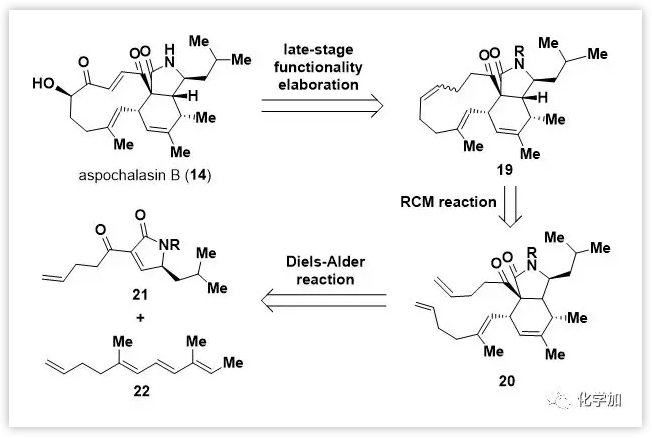
Figure 3.Retrosynthetic analysis of aspochalasin B.
片段21的制備(Scheme 1):
內(nèi)酰胺23經(jīng)4-戊烯酰氯(25)酰化、硒化,然后氧化消除得到3-吡咯啉-2-酮21。由于其不穩(wěn)定,必須在隨后的Diels-Alder反應(yīng)中立即使用。二烯22則由已知的醛28通過Julia烯化一步制備。起初,作者嘗試了在熱條件下(無溶劑,50 ℃,10 h)進(jìn)行Diels-Alder反應(yīng),并以60%的組合產(chǎn)率得到內(nèi)型產(chǎn)物20和其外型異構(gòu)體的混合物(內(nèi)/外=2/1)。為了優(yōu)化Diels-Alder反應(yīng),作者進(jìn)行了系統(tǒng)的條件篩選,發(fā)現(xiàn)一些路易斯酸可以提高內(nèi)/外型選擇性,其中(CuOTf)2?PhMe效果最好,以63%的產(chǎn)率得到單一加成產(chǎn)物20。
在得到關(guān)鍵雙環(huán)中間體20后,作者嘗試通過關(guān)環(huán)復(fù)分解(RCM)反應(yīng)構(gòu)建11-元大環(huán)骨架。在Grubb-II催化劑催化下以85%的產(chǎn)率得到三環(huán)中間體19,作為單一(E)-異構(gòu)體。隨后經(jīng)C17=C18的雙羥化和水解N-苯甲酰基得到反式二醇31。再經(jīng)選擇性保護(hù)17-OH,氧化18-OH和脫保護(hù)將31轉(zhuǎn)化為α-羥基酮aspochalasin P(33)。最后,通過硒化和氧化消除引入C19=C20雙鍵得到aspochalasinB(14)。同時(shí),利用Trauner課題組開發(fā)的方法制備了epicoccine(15)。在得到兩個(gè)關(guān)鍵前體后,作者開始嘗試仿生Diels-Alder反應(yīng)。最初,在aspochalasinB(14)存在下用K3Fe(CN)6處理epicoccine(15),假設(shè)原位產(chǎn)生的異苯并呋喃16c可以通過Diels-Alder反應(yīng)被14捕獲。然而,實(shí)驗(yàn)中并未檢測到異二聚體,反而得到epicoccine的同型二聚體作為主要產(chǎn)物,后續(xù)嘗試通過使用過量的14來改善反應(yīng)未能如愿。
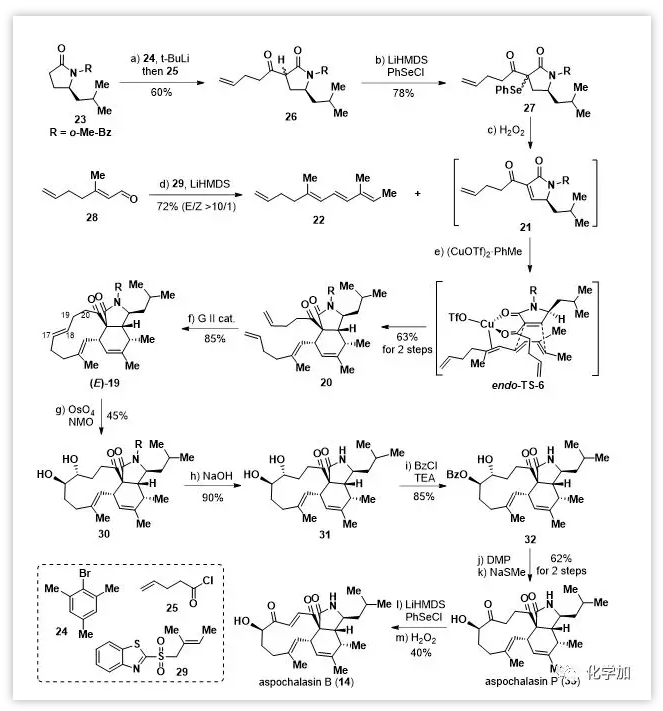
Scheme 1. Total synthesis of aspochalasin B.Reagents and conditions
Asperchalasine B-E及spicarinB的全合成(Scheme 2):
作者嘗試另一種策略來實(shí)現(xiàn)Diels-Alder反應(yīng),設(shè)想16c可以由半縮醛前體如34通過脫水產(chǎn)生。隨即合成得到34后,在80 ℃甲苯中用CSA處理14和34,結(jié)果Diels-Alder反應(yīng)順利進(jìn)行,得到兩個(gè)異二聚體asperchalasines G(5)和H(7)。由于其不穩(wěn)定,直接用Ac2O/Et3N乙酰化得到35和36(5:1)。隨后,利用單甲基化半縮醛37與14制備得到四種異構(gòu)二聚體asperchalasinesB-E (1-4) (80%,1:4:2:3=10:2:1:1)。當(dāng)用全保護(hù)的半縮醛38時(shí),僅得到兩種內(nèi)型產(chǎn)物,脫芐基后證實(shí)為asperchalasines E (4)和D (3)(57%, 4:3=3:2)。用全保護(hù)的39也得到類似結(jié)果,產(chǎn)生兩種內(nèi)型產(chǎn)物40和41(80%, 40:41=3:2)。
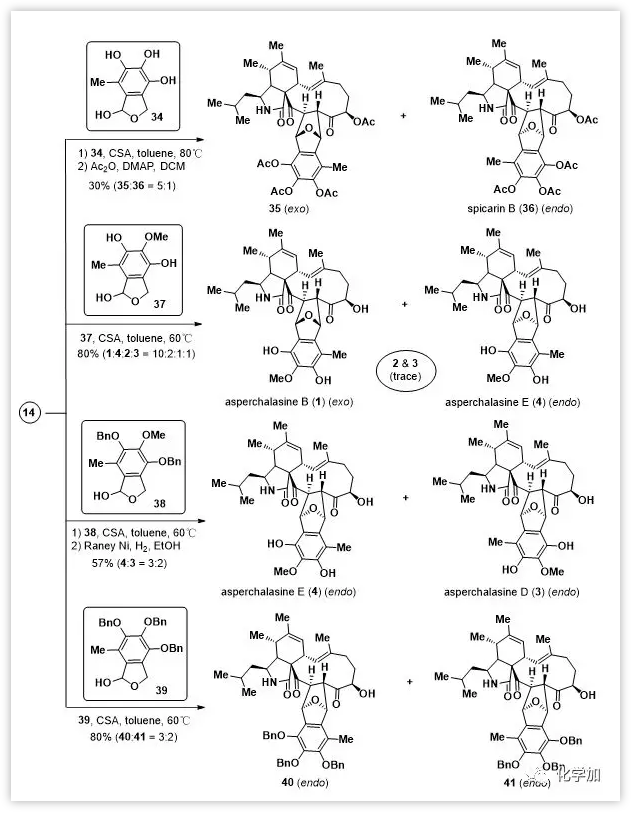
Scheme 2. Total synthesis of asperchalasines B-E andspicarin B.
Asperchalasine A(8)的全合成(Scheme 3):
上述結(jié)果表明,異苯并呋喃前體的空間效應(yīng)在控制Diels-Alder反應(yīng)的內(nèi)/外型選擇性中起關(guān)鍵作用。游離或部分保護(hù)的前體(如34和37)主要得到外型產(chǎn)物,而全保護(hù)的前體(如38和39)有利于形成內(nèi)型產(chǎn)物。作者用Raney-Ni/H2對40進(jìn)行脫芐基得到17,不經(jīng)純化直接與14混合暴露于空氣中仿生氧化進(jìn)行[5+2]-環(huán)加成得到asperchalasine A(8),其核磁譜數(shù)據(jù)與報(bào)道的天然樣品的數(shù)據(jù)完全一致。
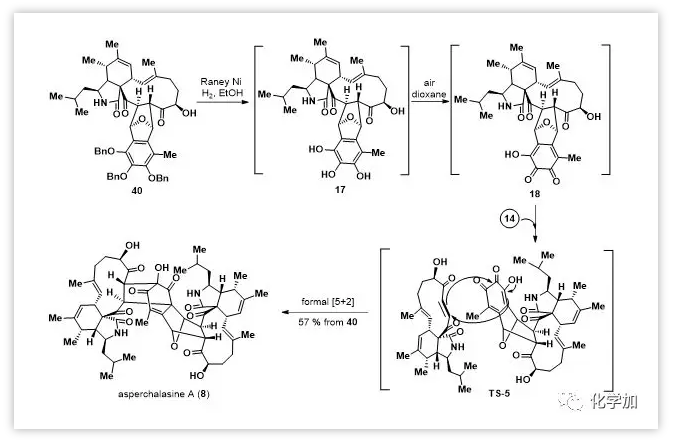
Scheme 3. Total synthesis of asperchalasine A.
小結(jié):清華大學(xué)唐葉峰、劉剛教授課題組完成了asperchalasines A-E的首次全合成,所有目標(biāo)產(chǎn)物都可以從已知片段出發(fā),在最長13步線性步驟內(nèi)獲得。首先通過基于Diels-Alder反應(yīng)和RCM反應(yīng)的通用方法完成關(guān)鍵的三環(huán)cytochalasan單體aspochalasinB合成,然后系統(tǒng)地探索了cytochalasan與各種epicoccine前體的異二聚化,不僅有助于揭示該類化合物的生源合成途徑,還為merocytochalasan家族中其它更具挑戰(zhàn)性的同源物的合成鋪平了道路。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn