

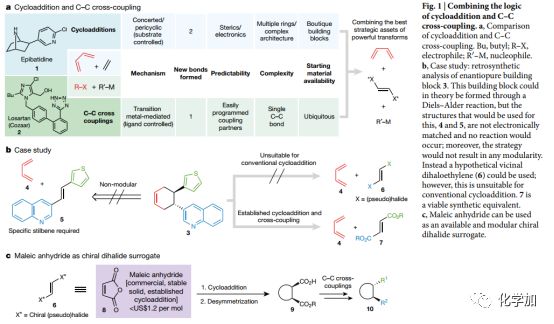
Fig.1將環加成和碳碳鍵偶聯結合a.對比環加成和偶聯b.逆合成分析c.馬來酸酐作為手性二鹵替代品
與一次形成一個鍵(多為sp2碳)的偶聯反應相比,一次形成多個碳碳鍵的環加成反應有著天然的優勢(Fig.1a)。但是,偶聯反應的優勢在于比環加成反應更具多樣性及模塊化。生物堿地棘蛙素(1)和市售降壓藥物科素亞(2)的合成就足以闡明這兩種反應的特點。由于地棘蛙素有效的鎮痛效果,化學家們已經對其進行了六十多次全合成,其中有31次使用了環加成作為關鍵步驟構建其吡咯烷核心骨架,并經過多步轉化后引入吡啶環。科素亞暢銷于全球,骨架結構中不含任何立體中心和拓撲結構,其發明和最終的工業化生產都使用了碳碳鍵偶聯反應。偶聯反應的匯聚式組裝和模塊化構建使得多種類似物得以簡單合成。
化合物3的結構往往讓人想起狄爾斯-阿爾德反應(Fig. 1b),但由于片段4和5的電性不匹配,反應并不能如愿發生。但即使可以發生,此類反應也缺乏模塊化構建的特點。為了解決該問題,作者設計了可代替5的延胡索酸酯類型親烯體(7),將狄爾斯-阿爾德反應和自由基偶聯反應(RCC)結合起來,實現多個立體中心及模塊化構建。
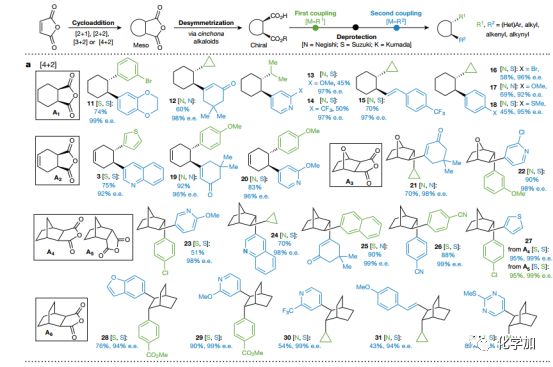
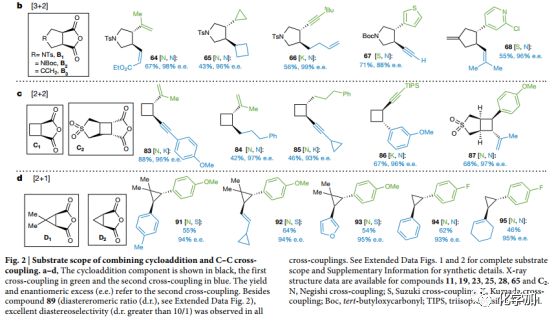
Fig.2 結合環加成和碳碳鍵雜交偶聯的底物適用范圍
選擇商業可得的廉價化合物馬來酸酐代替帶有手性輔基化合物6參與多種環加成反應([2+1]、[2+2]、[3+2]、[4+2]),然后用手性堿催化去不對稱醇解,得到具有連續手性中心的環加成產物。然后自由基偶聯、水解、二次自由基偶聯后便得到目標化合物。由于自由基偶聯反應底物的廣泛性,可以實現多種結構的構建,作者在文中展示了包括天然產物以及工業化生產實例在內的80多個例子。
首先從狄爾斯-阿爾德反應開始(Fig. 2a)。狄爾斯-阿爾德反應構建的A1-A6在鄧組開發的去不對稱條件下(以奎寧或奎尼丁為路易斯堿)催化不對稱醇解,得到高對應選擇性的單酸單酯底物,而后連續進行Negishi和Suzuki類型的RCC反應。通過此過程,可將簡單廉價的狄爾斯-阿爾德反應產物A1轉化為具有高對應選擇性以及高附加值的產品(11到63,涵蓋了芳香基、雜芳香基、烯烴、具有張力的環丙基、環丁基以及簡單片段甲基和異丙基)。大多情況下狄爾斯-阿爾德反應往往需要缺電的烯烴和富電的雙烯,使得反應的多樣性大大受限,但文中的方法可以構建常規狄爾斯-阿爾德反應不能得到的產物(不論消旋還是手性)。此外,在傳統狄爾斯-阿爾德反應中,當雙烯片段里有多個烯烴存在時,無法有效地控制反應。但作者通過模塊化構建解決了此類問題(12、15、19、21、25 和31)。有趣的是外型和內型異構體A4、A5,在調整反應次序后均可得到相同的產物27。
此方法可應用于多種環加成反應中,如[3+2]、[2+2]和[2+1](Fig. 2b-d),且偶聯片段與前文所述的狄爾斯-阿爾德反應砌塊一樣多種多樣。比如含吡咯烷的體系更可直接應用到藥物合成中,大約有四十多種藥物含有此結構。通過Pd催化可以較為容易地得到的環戊烯B3結構,很難通過其他方法合成。通過[2+2]環加成構建的C1 和C2,其對電子要求嚴苛,難以滿足產物多樣化的需求,且光催化生成的1,2-二取代環丁烷結構會產生難以分離的消旋化物質(83-86,源于C1)。有極高的應用價值的四取代手性環丁烷,多個二聚和偽二聚環丁烷天然產物含有此類結構,比如87。從D1和D2 骨架開始的手性環丙烷類化合物構建也有極高的難度。這些難以通過傳統手段獲得的多種環結構,均可以通過文中開發的方法獲得。
作者還使用此方法合成了六個天然產物和藥物前期或后期重要中間體(Fig. 3a-f)。
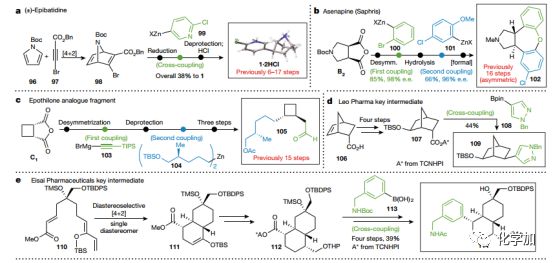
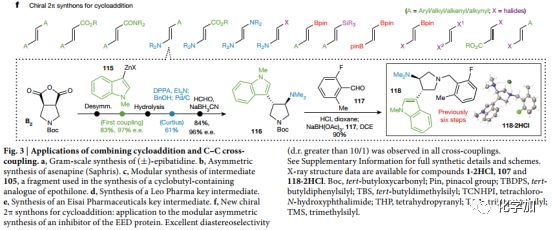
Fig.3 結合環加成和碳碳鍵雜交偶聯反應的應用a.克級合成(±)-epibatidine. b.不對稱合成asenapine (Saphris). c.模塊化合成中間體 105d.合成Leo Pharma的關鍵中間體 e.合成Eisai Pharmaceuticals的關鍵中間體f.新手性2π 合成子應用于環加成
比如前文所說的生物堿1,只需要5步便可得到,關鍵步偶聯反應產率極高,且總產率高達36%(Fig. 3a)。
被FDA列為抗精神病藥物的Saphris (阿塞那平,102;Fig. 3b)是一個苯環上氯原子導致的手性化合物,目前其最短的不對稱合成路線為16步,而此方法可以將其不對稱合成路線簡化為6步,且兩個偶聯關鍵步的產率分別是85%和66%。
Epothilone是一種具有細胞微管穩定活性的天然產物,為FDA批準抗腫瘤藥物Ixabepilone的重要中間體,因此是合成研究熱點。中間體105(Fig. 3c)從報道的15步被作者簡化到8步合成。
藥物化學中降冰片烯被認為是苯基的生物電子等排,由于缺乏有效的模塊化構建不同取代基的方式,其應用一直被限制。在和Leo Pharma的合作中作者用此方法合成了一個正在進行項目的重要中間體(109;Fig. 3d)關鍵步偶聯產率44%,且反應中首次使用硼酸酯作為RCC反應的底物,通過酸根型配合物(Ate complex)實現。
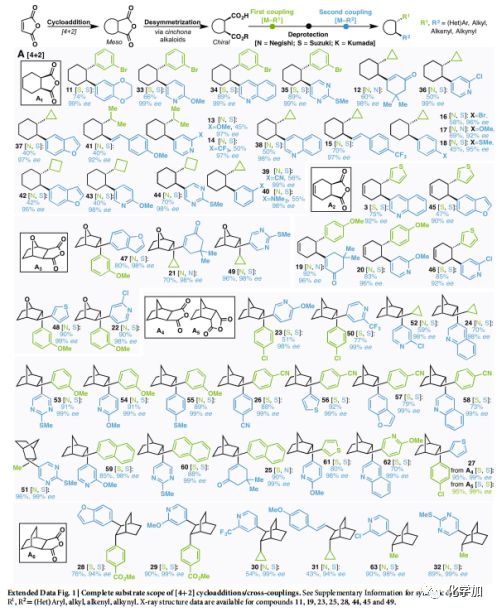
擴展數據Fig.1完整[4+2]環加成/雜交偶聯底物范圍
Eisai Pharmaceuticals一個正在進行的項目中,中間體114的關鍵結構的芳基部分通過文中方法引入。用Corey的噁唑硼烷催化劑催化構建十氫化萘結構111,然后在酯基部分引入芳基得到114。
文中開發的方法不僅僅局限于碳碳鍵的形成,通過與親核官能團化和脫羧官能團化結合,可以實現多種多樣性結構的合成(Fig. 3f)。例如可以通過2π烯胺合成子合成118(以前以消旋[3+2]手段得到,總產率1.9%)。使用文中的方法,以B2為原料,通過偶聯反應以及Curtis重排得到單一手性的目標產物,總產率為13%。
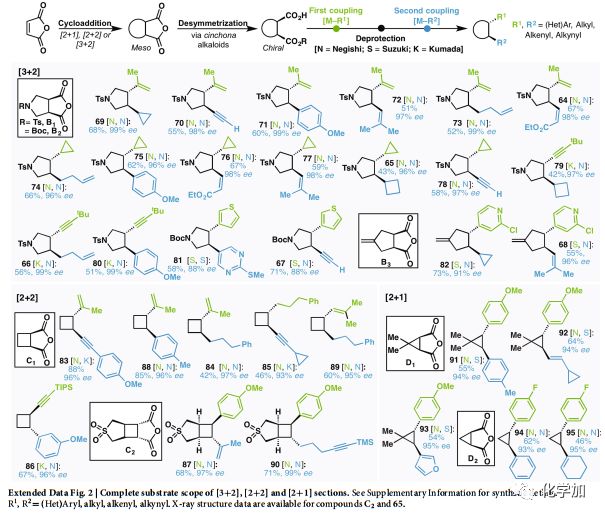
擴展Fig.2完整[3+2],[2+2],[2+1]類型底物范圍
小結:正如各種武功都有自己的弱點一樣,文中方也存在局限性。首先其局限性分別是環加成和偶聯反應各自的局限性。其次順式-1,2-二取代產物目前無法通過此方法得到,除非通過異構化反應逐個嘗試,或許通過配體控制的RCC反應可以解決此問題。本文將經典的環加成反應和新發展的RCC偶聯反應結合,可以得到傳統手段很難得到的很多結構,對天然產物和藥物合成有重大的意義。
原文:Building C(sp3)-rich complexity by combiningcycloaddition and C–C cross-coupling reactionshttps://doi.org/10.1038/s41586-018-0391-9
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn