

含氮雜環廣泛存在于藥物分子中。因此,尋求高效構建含氮雜環的方法,一直以來都是化學家的追求。自1971年Minisci教授報道第一例Minisci反應后,該反應引起了人們的廣泛關注。Minisci反應是指親核自由基對質子化的含氮雜環進攻的過程。目前產生親核自由基的方法有許多,其中,光催化手段在研究中大放異彩,很多前體如醇、酯、羧酸、氧化還原活化酯等都可以用來產生親核自由基。然而,不對稱Minisci反應卻一直以來充滿著挑戰。
在過去報道的不對稱Minisci反應的研究中,一般采用引入手性輔基而后親核加成,或者不對稱氫化而后串聯多步反應的策略構建手性的α-含氮雜環胺類化合物(Scheme 1A)。然而,這些策略均需要對底物進行預官能團化,因此往往需要較多的步驟。在此,Phipps教授將光催化與手性磷酸催化結合起來,從含氮雜環類底物直接出發,與親核自由基作用,實現了不對稱的Minisci反應(Scheme 1B)。
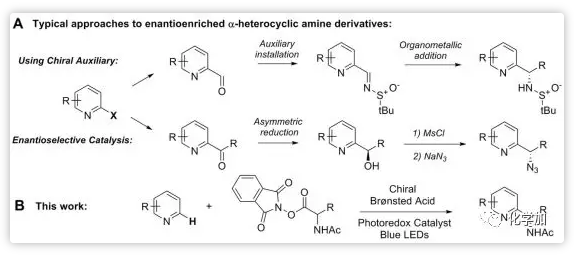
Scheme 1. 構建手性α-含氮雜環胺類化合物的方法。圖片來源:Science
Phipps教授的設計如下:酯1在Ir(II)的作用下產生烷基自由基,該自由基與含氮雜環、手性磷酸經氫鍵作用形成中間體I。隨后自由基加成、去質子化產生中間體III。中間體III在*Ir(III)的作用下經氧化芳構化生成最終產物。過程中經歷了光催化和質子酸催化的雙循環(Scheme 2A)。研究發現,當采用blue LEDs照射并使用2 mol%光催化劑[Ir(dF(CF3)ppy)2(dtbpy)]PF6和5 mol%手性磷酸催化劑時,4-甲基喹啉2a和酯1a能以94%的產率和94%的ee值反應得到目標產物,得最優條件(Science 2B)。
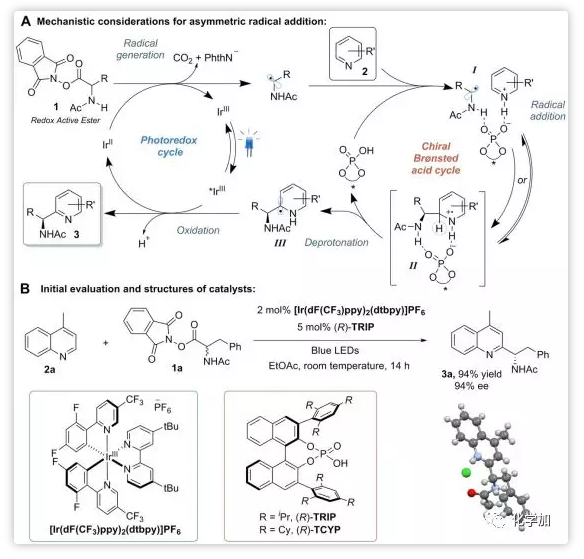
Scheme 2. 反應設計。圖片來源:Science
在該最優條件下,Phipps教授對酯和含氮雜環的適用范圍進行了考察(Scheme 3)。研究發現,不同結構取代的酯類化合物均能溫和地產生烷基自由基,反應取得較為不錯的反應性(Scheme 3A)。喹啉結構和復雜的吡啶結構均能高效地與親核自由基作用(Scheme 3B&C)。值得一提的是,該方法學還可以應用到藥物分子的后期不對稱官能團化反應中,并能取得非常好的產率和ee值(Scheme 3D)。官能團如醚、酯基、氟、溴、羰基、氰基等都能得到很好的兼容。反應條件溫和,產率高,對映選擇性好。
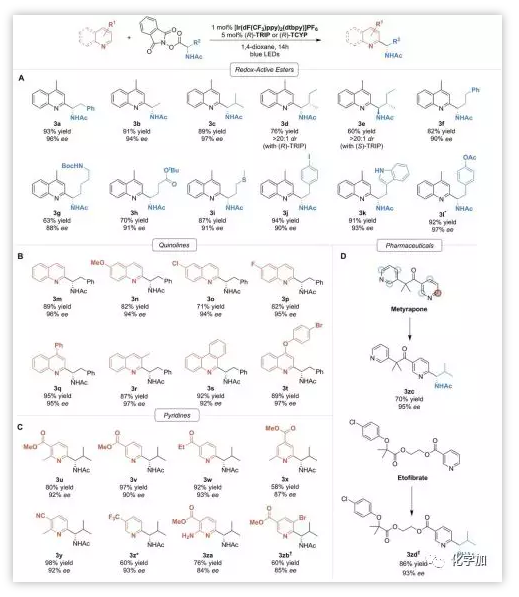
Scheme 3. 底物拓展。圖片來源:Science
最后,Phipps教授還做了一系列的實驗探究該反應的機理(Scheme 4)。L-脯氨酸衍生的酯可以與4-甲基喹啉反應,反應產率很高,但ee值很低(Scheme 4A)。這說明了磷酸鹽與親核自由基或反應中間體如II之間的非共價作用對反應的對映選擇性是非常重要的。而分子間KIE值為3.6則表明了自由基加成的可逆性和中間體II的非對映體的相對能量差以及去質子化的壁壘是導致較好對映選擇性的原因(Scheme 4B)。
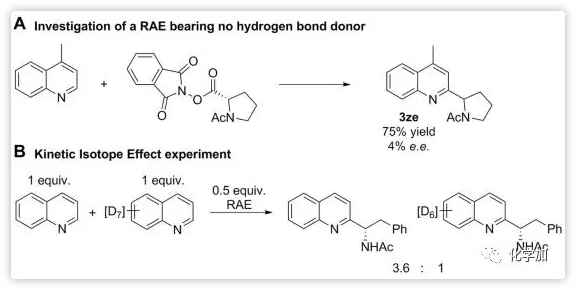
Scheme 4. 機理研究。圖片來源:Science
總結:在該工作中,Phipps教授將光催化與手性磷酸催化結合起來,從含氮雜環類底物直接出發,與親核自由基作用,實現了不對稱Minisci反應。反應產率較高,對映選擇性好。此外,Phipps教授還通過復雜底物包括藥物分子的后期官能團化實驗證實了方法學的實用性。
原文鏈接:http://science.sciencemag.org/content/early/2018/04/04/science.aar6376
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn