

Doyle?Kirmse反應是基于硫葉立德的[2,3]-σ重排反應。從烯丙基或炔丙基硫代物出發,與重氮試劑反應,是構建新型C-C鍵和C(sp3)?S鍵的重要方法。多年來,對該反應的不對稱研究一直備受關注。然而,它也面臨著如下挑戰:
1)硫的孤對電子與過渡金屬催化劑作用較強;
2)金屬配位的硫葉立德與自由的硫葉立德是一個平衡,且后者更易發生重排;
3)無法保證硫葉立德過渡態翻轉的速率是否大于σ重排的速率。
因此,盡管該領域有少量的突破,發展高效、高選擇性的不對稱Doyle?Kirmse反應仍然是極具挑戰,也充滿意義的。
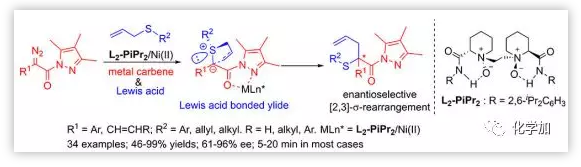
Scheme 1. Ni催化不對稱Doyle?Kirmse反應。圖片來源:JACS
在使用NiCl2作催化,AgNTf2作銀鹽,L2-PiPr2做配體,二氯甲烷作溶劑,溫度40 oC條件下,作者對底物的適用范圍進行了考察。作者研究了不同結構的α-重氮羰基化合物和烯丙基硫代物的反應性(Scheme 2&3)。研究發現,官能團如氟、氯、溴 、三氟甲基等都能得到很好的兼容。反應條件溫和,時間短,反應產率較高,對映選擇性好。

Scheme 2. 重氮底物拓展。圖片來源:JACS
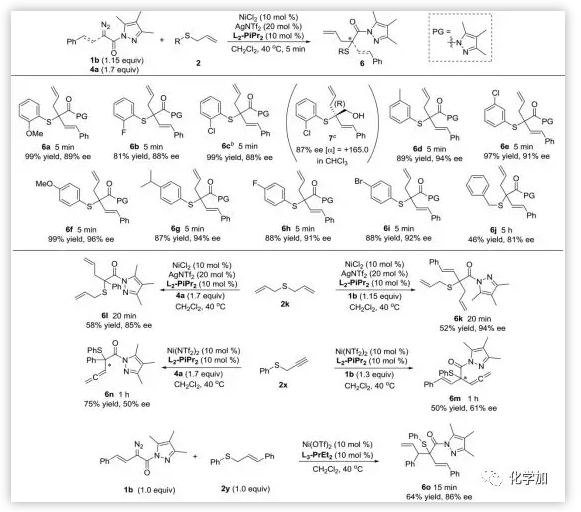
Scheme 3. 烯丙基硫代物底物擴展。圖片來源:JACS
為了證明該方法學的實用性,作者還做了如下實驗的研究(Scheme 4)。1b與2a放大到克級規模反應時,反應仍能保持很好的收率和對映選擇性性。同時,作者還對產物3b進行了多種轉化,可以經還原、酯化、酰胺化可以得到8、9、10,過程中ee值得到了很好的保持。

Scheme 4. 克級規模實驗和產物3b的轉化。圖片來源:JACS
為了對反應的機理有一定的認識,作者還做了如下的控制實驗(Scheme 5)。從11或13代替1b與2a反應時,反應得到的產率一般,ee值較差。這說明了吡唑取代基對于重氮的反應性是必要的。吡唑酰胺比酯基或吡咯酰胺取代具有更強的吸電子效應,決定了重氮1更好的親電性。
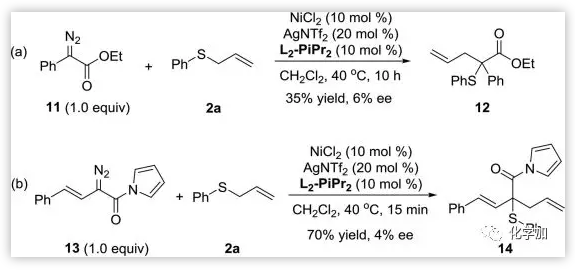
Scheme 5. 控制實驗。圖片來源:JACS
基于如上的結果以及其他實驗的研究,作者還該反應的作用機制提出如下的可能(Scheme 6):X-ray晶體結構證實了Ni(II)與L2-PiPr2之間可發生作用。開始時,NiCl2與AgNTf2反應生成Ni(NTf)2,后者與L2-PiPr2生成具有催化活性的Ni(II)催化劑。Ni(II)催化劑與1b作用,生成中間體A,A與烯丙基硫代物作用形成硫葉麗德B。Ni(II)作為路易斯酸,能與葉立德B作用使其轉化為路易斯酸配位的葉立德C。由于五元環硫葉立德與酰胺基團的位阻效應,葉立德C’的形成是不利的。隨后,葉麗德C經[2,3]-σ重排反應形成產物R-6c。
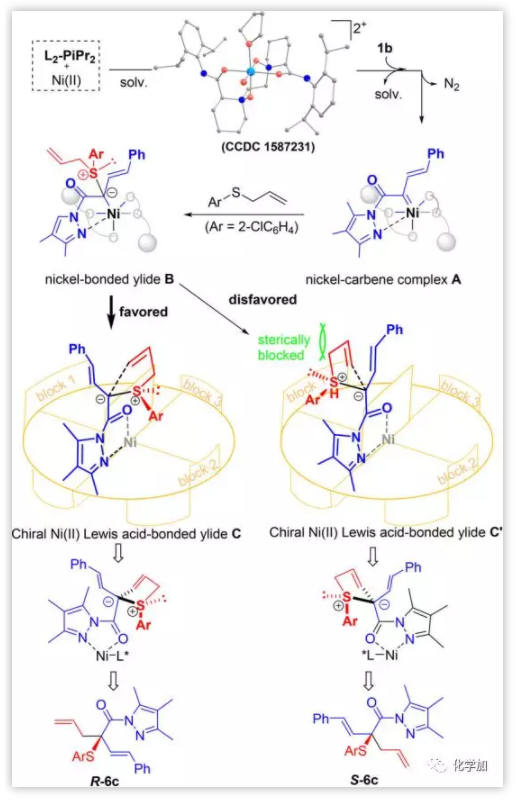
Scheme 6. 反應可能的作用機制。圖片來源:JACS
總結:在該工作中,馮小明課題組利用具有雙重作用的Ni催化劑,實現了貧電子的α-重氮羰基化合物與烯丙基硫化物的不對稱Doyle?Kirmse反應。反應條件溫和,時間大多數5-20 min,產率和ee值均非常好。此外,作者還通過克級規模試驗和多種轉化,證實了方法學的實用性。控制實驗則說明了貧電子的吡唑基團酰胺基團對于重氮的反應性是必要的。關于該催化體系的拓展還在進一步研究當中。
原文鏈接:https://pubs.acs.org/doi/10.1021/jacs.7b12486
作者:Xiaobin Lin, Yu Tang, Wei Yang, Fei Tan, Lili Lin, Xiaohua Liu, and Xiaoming Feng
課題組主頁:http://chem.scu.edu.cn/chem-asl/Index.asp
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn