




謝衛(wèi)青博士2002年畢業(yè)于蘭州大學(xué),獲理學(xué)學(xué)士學(xué)位。2007年于上海有機(jī)所獲得博士學(xué)位,導(dǎo)師馬大為研究員。畢業(yè)之后留在上海有機(jī)所,任助理研究員。2009年赴美國西南醫(yī)學(xué)中心開展博士后研究工作。2011年重新回到上海有機(jī)所任副研究員。2015年作為青年英才引入西北農(nóng)林科技大學(xué),任教授、博士生導(dǎo)師。主要研究方向?yàn)橛袡C(jī)小分子催化的不對稱反應(yīng)及其在天然產(chǎn)物全合成中的應(yīng)用、具有重要生理活性天然產(chǎn)物合成、基于天然產(chǎn)物的化學(xué)生物學(xué)研究等。
眾所周知,在化學(xué)分子中,結(jié)構(gòu)決定著性質(zhì),性質(zhì)決定著用途。許多具有重要生理活性的天然產(chǎn)物分子就是依賴于它們獨(dú)特的三維化學(xué)結(jié)構(gòu),尤其是當(dāng)分子中有季碳存在的時(shí)候,季碳會(huì)對分子結(jié)構(gòu)有重要的影響。有時(shí)候,有的系列天然產(chǎn)物都會(huì)具有季碳或者連續(xù)的季碳如天然產(chǎn)物communesin F,perophoramidine, tochuinyl acetate和herbertenolide中都具有連續(xù)的手性季碳(圖1)。
圖 1 具有連續(xù)季碳手性中心的天然產(chǎn)物
而對于手性季碳的構(gòu)建一直都是有機(jī)合成化學(xué)中的難點(diǎn),也面臨著諸多挑戰(zhàn)。
傳統(tǒng)的構(gòu)建季碳的方法包括周環(huán)反應(yīng)、烷基化反應(yīng)、過渡金屬催化的反應(yīng)以及自由基反應(yīng)等,但這大多數(shù)方法構(gòu)建一個(gè)季碳比較有效,要是構(gòu)建不同連續(xù)的季碳,仍然需要開發(fā)新的方法。
近期,有人報(bào)道了通過光解脫羧構(gòu)建連續(xù)季碳的方法(圖 2a),但底物比較受限。本文作者則是希望在他們課題組氧化去甲酰化反應(yīng)的基礎(chǔ)上,鄰位帶有甲酰基的酮化合物3在雙氧水氧化作用下,脫去甲酸并分子內(nèi)重排,發(fā)生縮環(huán)反應(yīng)從而構(gòu)建了連續(xù)的兩個(gè)季碳,得到化合物5,可能的副反應(yīng)則是另一種重排方式得到開鏈的二酸化合物6(圖 2b)。
圖 2 作者構(gòu)建連續(xù)季碳的設(shè)想
首先,作者以一系列α-位帶有甲酰基的環(huán)己酮為底物,在乙酸乙酯作溶劑,加入雙氧水并室溫反應(yīng)的條件下,對該氧化縮環(huán)反應(yīng)的底物中取代基進(jìn)行了研究,發(fā)現(xiàn)α-位不帶有取代基時(shí)反應(yīng)不能發(fā)生,一側(cè)α-位帶有取代基且為季碳時(shí)縮環(huán)反應(yīng)發(fā)生,得到帶有一個(gè)季碳中心的五元環(huán),但同時(shí)生成大量開鏈的副產(chǎn)物。只有當(dāng)羰基兩側(cè)α-位都帶有取代基,且都為季碳時(shí),才能以良好的收率得到縮環(huán)產(chǎn)物。
圖 3 底物中取代基的影響
接著,作者對該反應(yīng)的底物進(jìn)行了擴(kuò)展,可以看出,當(dāng)?shù)孜餅閹в新莪h(huán)結(jié)構(gòu)的環(huán)己酮時(shí)(3e-3l),能以非常優(yōu)秀的產(chǎn)率和區(qū)域選擇性得到帶有連續(xù)兩個(gè)季碳手性中心的五元環(huán)化合物。而對于非環(huán)狀的羰基兩側(cè)α-位帶有取代基且為季碳的底物(3d,3m,3n,3o)時(shí)產(chǎn)率良好,但選擇性明顯下降。值得一提的時(shí),橋環(huán)底物3p能以優(yōu)秀的產(chǎn)率和選擇性得到非常有用的帶有連續(xù)兩個(gè)手性中心的5-6并環(huán)產(chǎn)物,且產(chǎn)物中的羧基和雙鍵都可以進(jìn)一步衍生化。而對于羰基一側(cè)α-位帶有叔碳或者不是手性中心的底物(3c,3q,3r,3s-v)也能以中等到優(yōu)良的產(chǎn)率得到相應(yīng)的縮環(huán)產(chǎn)物。
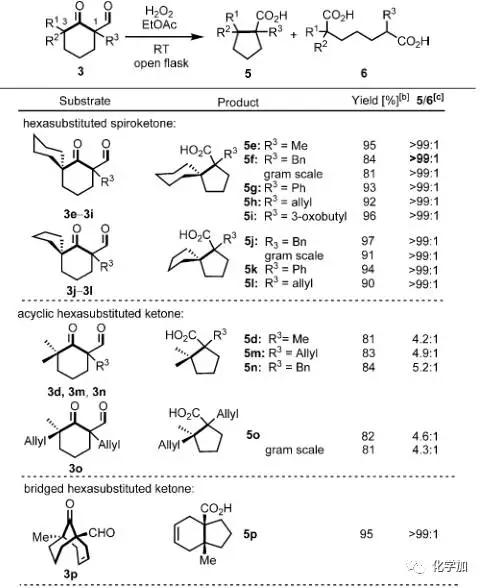
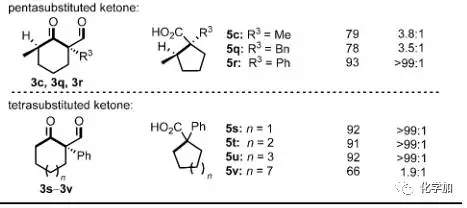
圖 4 底物的擴(kuò)展
另外,作者還研究了該反應(yīng)的手性保持情況,從手性純的底物3出發(fā),在標(biāo)準(zhǔn)氧化縮環(huán)條件下,產(chǎn)物都能以良好到優(yōu)秀的ee值使手性保持(圖 5)。
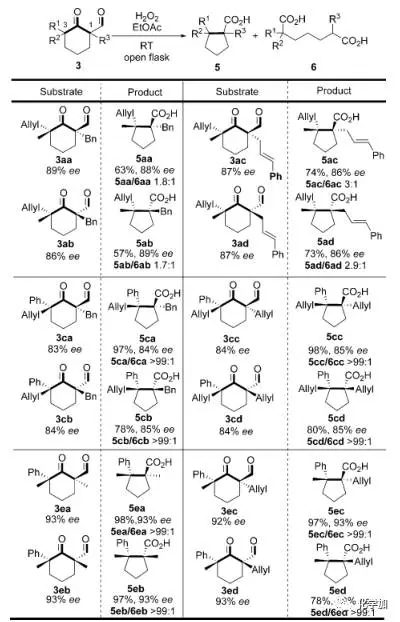
圖 5 反應(yīng)的手性保持研究
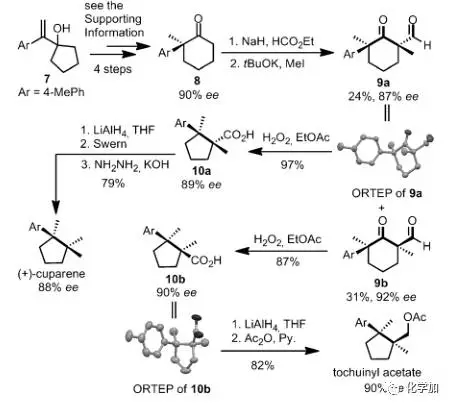
圖 6 氧化縮環(huán)反應(yīng)的應(yīng)用
為了研究該反應(yīng)的實(shí)用性,作者從已知原料7出發(fā),合成了手性酮化合物8,在羰基的另一側(cè)α-位裝上甲酰基和甲基得到9a和其差向異構(gòu)體9b,再分別在雙氧水、乙酸乙酯條件下以優(yōu)秀的產(chǎn)率得到縮環(huán)產(chǎn)物10a和10b, 再分別經(jīng)過三步和兩步簡單的轉(zhuǎn)化就可以合成兩個(gè)帶有連續(xù)季碳手性中心的天然產(chǎn)物(圖 6)。
總結(jié)
謝衛(wèi)青教授課題組報(bào)道了他們通過雙氧水條件下的氧化縮環(huán)反應(yīng),構(gòu)建了連續(xù)的手性季碳,該反應(yīng)條件溫和,產(chǎn)率優(yōu)良,在連續(xù)季碳中心的構(gòu)建以及天然產(chǎn)物的合成中具有重要應(yīng)用價(jià)值。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn