



喜樹堿(Camptothecin CPT, 1)是1966年從喜樹的樹皮和莖中分離得到的生物堿,可以通過和拓?fù)洚悩?gòu)酶I結(jié)合來有效地抑制腫瘤生長,阻止DNA的重新連接,由此產(chǎn)生的DNA損傷導(dǎo)致了細(xì)胞的凋亡。因此,學(xué)術(shù)界和藥學(xué)工業(yè)界也針對(duì)喜樹堿的合成和生物活性研究投入了許多努力,但由于喜樹堿的溶解性不好以及不可預(yù)知的毒性導(dǎo)致了初步的藥物研發(fā)失敗。后續(xù)的關(guān)于喜樹堿的結(jié)構(gòu)修飾使得CPT有了市售的抗癌藥物如拓?fù)涮婵担}酸拓?fù)涮婵担?/span>3),貝洛替康(4),和伊立替康(Camptosar,5)以及一些抗癌候選藥物。
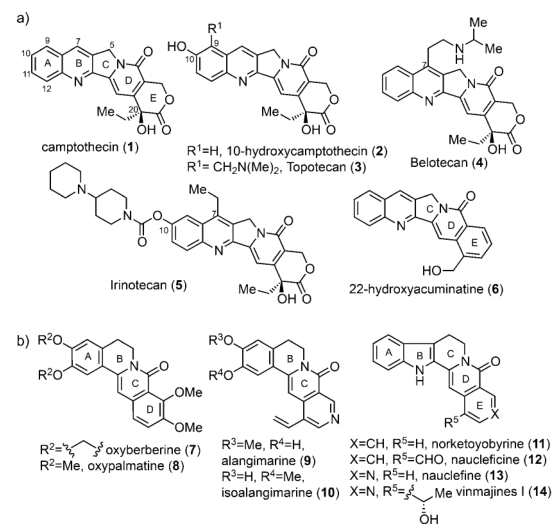
圖 1 喜樹堿及相關(guān)天然產(chǎn)物
在本篇Angew中,高栓虎課題組設(shè)計(jì)了一條高效的靈活的策略,完成了CPT的全合成以及相關(guān)的天然產(chǎn)物22-hydroxyacuminatine (6), oxypalmatine (8), norketoyobyrine (11), naucleficine (12) 和nauclefine (13)的全合成。這條策略的關(guān)鍵就是基于串聯(lián)環(huán)化反應(yīng)一步構(gòu)建了indolizinone 或 quinolizinone 骨架 (B/C 或者 C/D 環(huán)系)。

圖 2 基于串聯(lián)環(huán)化反應(yīng)的合成策略
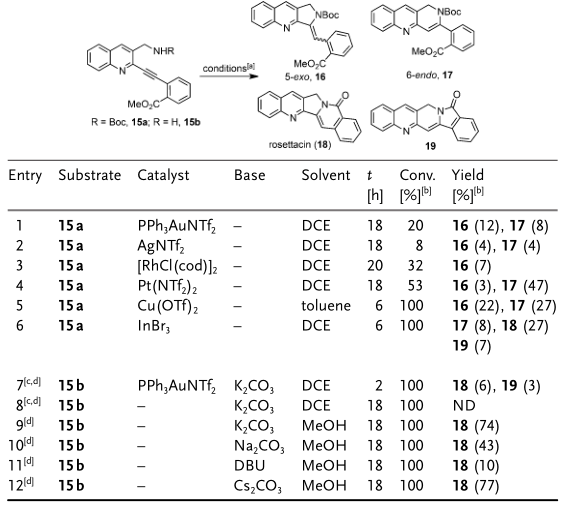
圖 3 串聯(lián)環(huán)化反應(yīng)條件的篩選
首先,作者對(duì)于這一關(guān)鍵的串聯(lián)環(huán)化反應(yīng)進(jìn)行了條件篩選,N-Boc保護(hù)的底物15a或者未保護(hù)的底物15b在過渡金屬或者堿性條件下,先對(duì)三鍵進(jìn)行活化,胺基進(jìn)攻活化的三鍵進(jìn)而5-exo或者6-endo關(guān)環(huán),接著形成內(nèi)酰胺得到5-6并環(huán)或者6-5并環(huán)。作者發(fā)現(xiàn),利用碳酸銫作堿可以取得較好的結(jié)果,以77%的收率得到5-6并環(huán)產(chǎn)物,這可能是由于碳酸銫在甲醇中具有較好的溶解性(entry 12)。
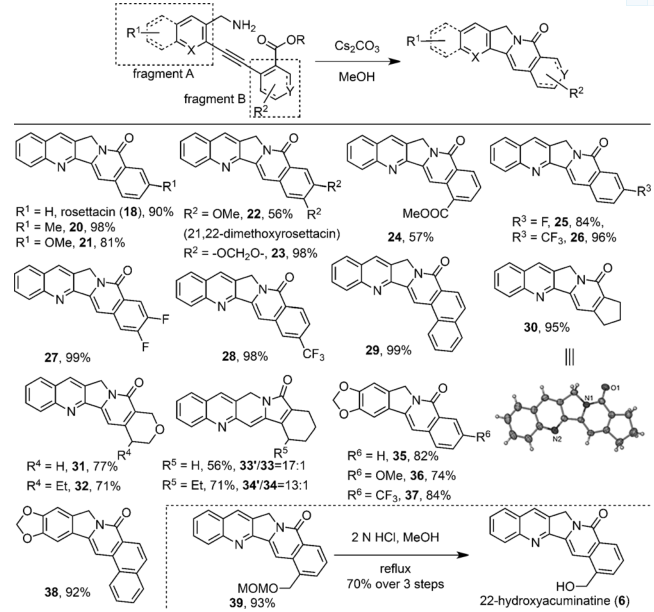
圖 4 底物的擴(kuò)展
有了最佳反應(yīng)條件,作者也對(duì)反應(yīng)底物進(jìn)行了擴(kuò)展,尤其是對(duì)于片段A和片段B中的取代基進(jìn)行了篩選,可以看出,烷基、烷氧基、酯基、鹵素、縮醛等都可以兼容,也都能以良好到優(yōu)秀的產(chǎn)率得到串聯(lián)環(huán)化產(chǎn)物,其中化合物30還有單晶確定了其結(jié)構(gòu)。值得一提的是,選取合適的底物,一步串聯(lián)環(huán)化反應(yīng)可以直接得到相關(guān)的天然產(chǎn)物如rosettacin (18),或者環(huán)化產(chǎn)物39一步脫保護(hù)得到相關(guān)天然產(chǎn)物22-hydroxyacuminatine (6)。
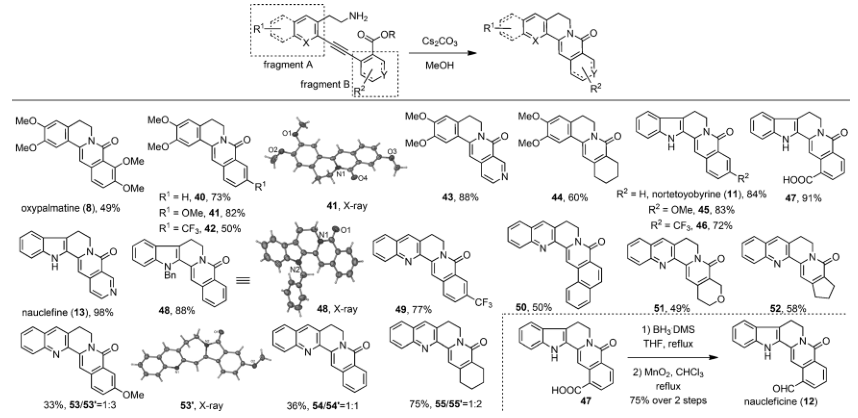
圖 5 改變胺基側(cè)鏈后的底物擴(kuò)展
作者還通過改變片段A中胺基側(cè)鏈的長度,在同樣條件下也可以發(fā)生串聯(lián)環(huán)化反應(yīng)得到6-6并環(huán)體系quinolizinone 骨架。十幾個(gè)底物也都得到了中等到良好的產(chǎn)率,有些底物也是通過串聯(lián)環(huán)化反應(yīng)一步得到了相關(guān)天然產(chǎn)物如oxypalmatine (8) ,norketoyobyrine (11)和nauclefine (13),或者產(chǎn)物41經(jīng)過簡(jiǎn)單的還原氧化反應(yīng),以兩步75%的收率得到naucleficine (12)。
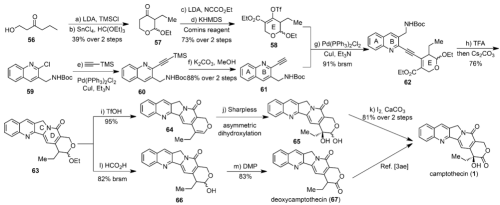
圖 6 喜樹堿的合成
最后,作者還將這一方法用于了喜樹堿的全合成中,具體合成路線如下:從簡(jiǎn)單化合物56出發(fā),經(jīng)兩步轉(zhuǎn)化得到半縮酮化合物57,和Mander試劑反應(yīng)在酮羰基α-位引入甲酸酯接著羰基OTf化得到化合物58。另一方面,從化合物59出發(fā),Sonogashira偶聯(lián)反應(yīng)得到化合物60,脫去TMS保護(hù)得到化合物61,58和61再發(fā)生Sonogashira反應(yīng)得到化合物62,TFA脫去N-Boc保護(hù)基并在碳酸銫條件下發(fā)生串聯(lián)環(huán)化反應(yīng)得到五環(huán)結(jié)構(gòu)化合物63,從63出發(fā),TfOH條件下消除EtOH得到化合物64,接著發(fā)生Sharpless不對(duì)稱雙羥化得到化合物65,I2/CaCO3條件下氧化半縮醛到內(nèi)酯就完成了喜樹堿的全合成。從63出發(fā),先在甲酸條件下處理,得到半縮醛66,DMP氧化得到deoxycamptothecin (67),后者也可以按照文獻(xiàn)報(bào)道的方法完成喜樹堿的形式全合成。
總結(jié)
高栓虎課題組發(fā)展了一條基于碳酸銫催化的串聯(lián)環(huán)化反應(yīng)的高效的靈活的合成策略,可以用于喜樹堿及相關(guān)天然產(chǎn)物的全合成,這對(duì)喜樹堿系列天然產(chǎn)物的生物活性研究和進(jìn)一步的藥物研發(fā)具有重要意義。作者也將把這一策略用于更復(fù)雜的天然產(chǎn)物全合成,我們也期待該課題組發(fā)表更精彩的合成文章。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn