



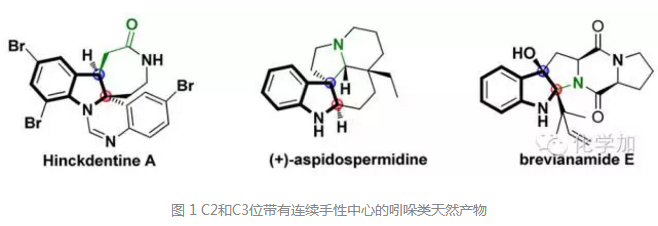
去芳香化反應(yīng)是一大類很重要的轉(zhuǎn)化,在有機合成和藥物合成中具有重要用途。特別是含有雜原子的芳香化合物,例如吲哚的去芳化就可以構(gòu)建許多重要的化合物骨架。如圖1所示,幾個重要的活性天然產(chǎn)物都有可能通過吲哚的去芳化反應(yīng)來構(gòu)建,尤其是C2和C3位的連續(xù)手性中心,如果能通過去芳化反應(yīng)一步立體選擇性地構(gòu)建,無疑是非常高效的。但這方面的研究報道目前還較少。
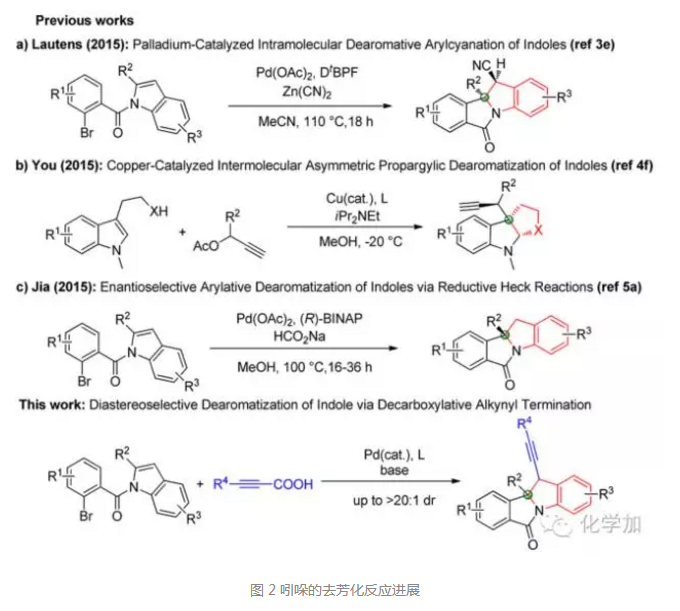
如圖2所示,前期的幾個吲哚去芳化的經(jīng)典案例分別是:多倫多大學(xué) Mark Lautens教授的鈀催化吲哚分子內(nèi)去芳化氰基化反應(yīng);上海有機所游書力研究員的銅催化氮保護的色胺或色醇分子間炔丙基化并去芳化反應(yīng);浙江工業(yè)大學(xué)賈義霞教授利用鈀催化劑和BINAP配體,通過還原Heck反應(yīng)實現(xiàn)了吲哚的不對稱去芳化。
金屬催化的脫羧偶聯(lián)反應(yīng)也是一類非常重要的碳碳鍵或者碳雜原子鍵形成反應(yīng),由于其操作簡便,原料來源廣泛且避免了使用有機金屬試劑,底物適用范圍廣,因此備受有機化學(xué)家的重視。在這篇文章中,梁永民團隊則是希望在鈀催化劑的作用下,先發(fā)生吲哚分子內(nèi)去芳化反應(yīng),接著和炔丙酸底物發(fā)生脫羧偶聯(lián)反應(yīng),一步構(gòu)建兩個手性中心。
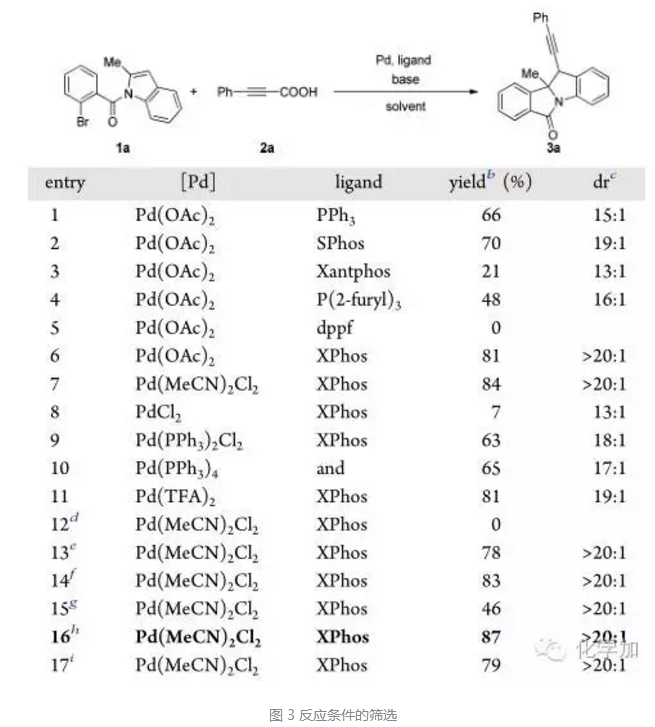
首先,作者以氮保護的吲哚底物1a和3-苯基丙炔酸為底物,進行反應(yīng)條件的篩選,可以看出,當(dāng)選用催化劑Pd(MeCN)2Cl2時,產(chǎn)率和dr選擇性都比較高(84% ,>20:1 dr, entry 7)。 當(dāng)選用其它鈀催化劑如 PdCl2 , Pd(PPh3)2Cl2 , Pd(PPh3)4 ,和Pd(TFA)2 , 產(chǎn)率和dr值都有所下降(entries 8?11)。配體方面,XPhos給出了最佳結(jié)果。得到的最優(yōu)條件是:吲哚底物1 (0.2 mmol), 丙炔酸底物2 (0.3mmol), 鈀催化劑Pd(MeCN)2Cl2 (5 mol %), 配體XPhos (10 mol %), Cs2CO3 (2.0 equiv)作堿, 甲苯 (2.0 mL)中100 °C反應(yīng) 2 h。
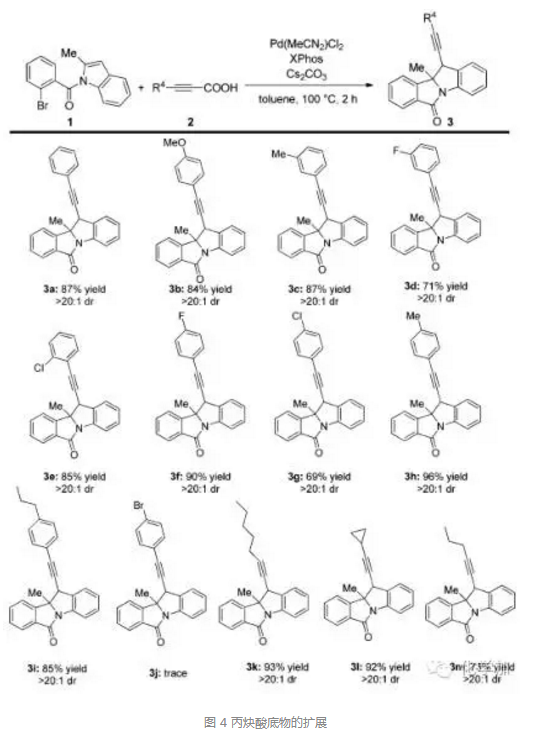
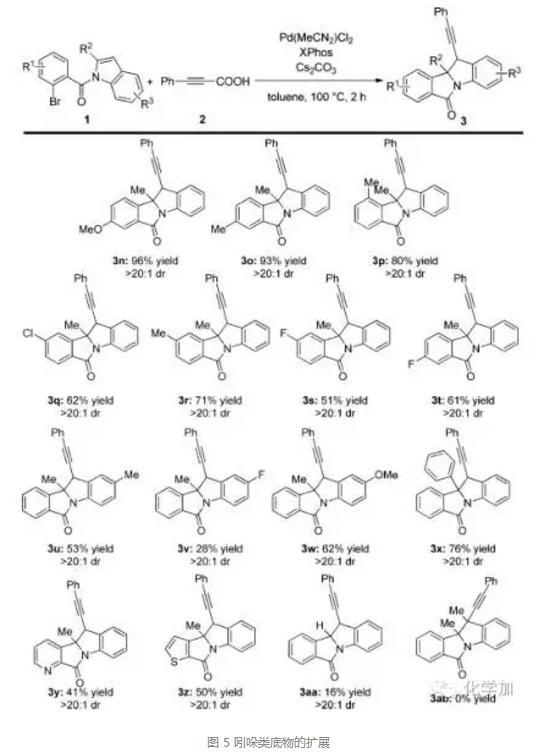
有了最佳反應(yīng)條件,作者又對底物進行了擴展,先是對丙炔酸底物的擴展,如圖4所示,芳基丙炔酸以及烷基丙炔酸衍生物都能較好地發(fā)生反應(yīng),當(dāng)3-芳基丙炔酸中苯環(huán)上帶有給電子基時,取得了良好到優(yōu)秀的產(chǎn)率和dr值, (如圖中 3b, 3c, 3h, 和3i). 而當(dāng)苯環(huán)上帶有吸電子基時,產(chǎn)率和dr值略有下降 (如圖中3e, 3f, 3g),但當(dāng)芳環(huán)上取代基為溴時,反應(yīng)幾乎不能發(fā)生(如圖中3j)。
接著,作者也對吲哚類底物進行了擴展,可以看出,當(dāng)吲哚中苯環(huán)上帶有給電子基時,產(chǎn)率和dr值都優(yōu)于缺電子芳環(huán),除了吲哚外,當(dāng)苯環(huán)換為吡啶或者噻吩等芳環(huán)時,反應(yīng)也能以中等產(chǎn)率和優(yōu)秀的dr選擇性順利發(fā)生。而當(dāng)吲哚環(huán)上無取代基或者2,3-位都有甲基取代時,反應(yīng)產(chǎn)率極低甚至不能反應(yīng)。(如圖中3aa和3ab)
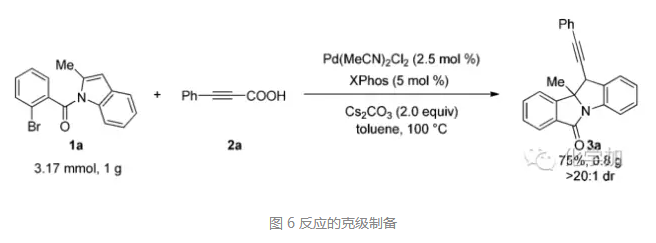
對于該鈀催化的分子內(nèi)去芳化炔基化反應(yīng),作者也嘗試了大量制備,如圖所示,對于1a和2a的模型反應(yīng),當(dāng)克級制備時,也能以良好的收率和大于20:1的選擇性順利得到產(chǎn)物。
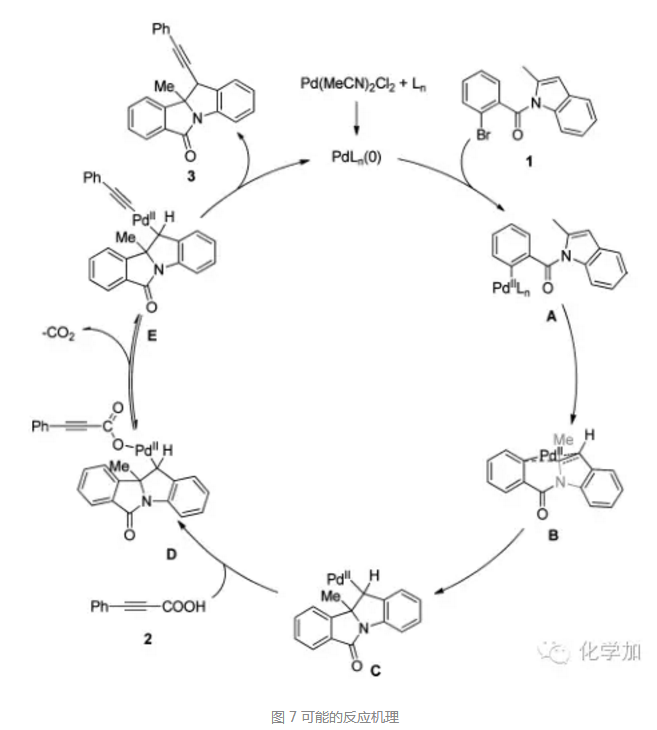
基于以上實驗結(jié)果,作者也給出了可能的反應(yīng)機理:二價鈀催化劑原位形成零價鈀催化劑,和氮保護吲哚底物1發(fā)生氧化加成,形成中間體A,接著對吲哚的2,3-位雙鍵插入,形成中間體C,接著和3-苯基丙炔酸發(fā)生配體交換形成中間體D,脫去二氧化碳形成中間體E,最后還原消除生成產(chǎn)物3,鈀催化劑再生進入新的循環(huán)。
總結(jié):梁永民教授和景歡旺教授報道了他們在鈀催化吲哚分子內(nèi)去芳香化方面取得的新進展,作者通過鈀催化吲哚分子內(nèi)去芳化,接著和炔基羧酸實現(xiàn)了脫羧偶聯(lián)反應(yīng),一步構(gòu)建了連續(xù)的兩個手性中心,產(chǎn)率和選擇性優(yōu)良,底物適用性廣泛,操作簡便,可以實現(xiàn)克級制備,將在有機合成中具有重要應(yīng)用。我們也期望作者能發(fā)展出不對稱版本,并將該方法用于活性分子的合成中。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn