

正文
在過去十年中,自由基交叉偶聯在逆合成分析中的應用經歷了復興。這是由于具有挑戰性的C-C鍵的簡單、收斂斷開導致鹵化物、酸、胺、醇和烯烴等官能團廣泛存在(圖1A)。在實踐中,所有這些廣泛使用的自由基前體都需要某種外源氧化還原活化模式。無論選擇氧化或還原活化,通常都需要化學計量的化學添加劑、促進光誘導電子轉移的催化劑或電化學。自20世紀30年代末以來,人們就開始使用烷基二氮烯,但主要局限于2e–-去官能化方法,如經典的Wolff-Kishner還原和相關反應(圖1B)。1993年,Taber報道了使用磺酰肼原位衍生二氮烯,實現了酮1到八氫茚滿2的自由基環化。基于這一先例,Phil S. Baran教授設想從這些中間體中衍生的未經氧化還原引發的自由基是否可以用于金屬催化的交叉偶聯事件。本文報道了一種非常通用的平臺,用于由原位衍生的烷基二氮烯驅動的氧化還原中性自由基交叉偶聯,以形成各種 C-C鍵。 歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
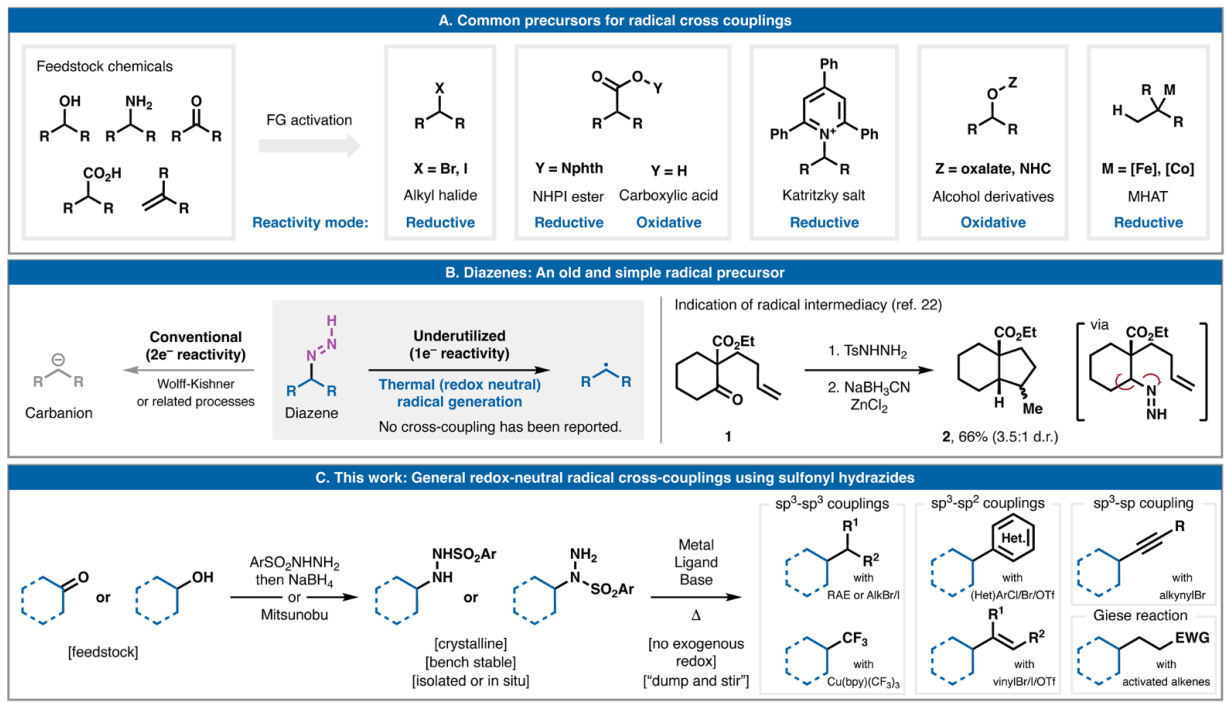
圖1. 研究背景及反應發展
(圖片來源:Science)
圖2說明了磺酰肼作為氧化還原中性偶聯物在七種有價值的C-C鍵形成事件中的多功能性。首先展示了最簡單的自由基偶聯,即Giese型不飽和物質加成(圖2A)。對于此反應,dtbbpy 與Ni(dme)Cl2以及Et3N(3.0當量)協同使用,以28-65%的產率提供五種代表性加合物(3-7)。在沒有Ni/L系統的情況下,該反應的產率顯著降低。在Ni(dme)Cl2、2,6-雙(吡唑-1-基)吡啶(bpp)和Et3N (3.0當量)存在下,在60 °C的DMF中使用接近化學計量比的偶聯劑(1.5當量磺酰肼和1.0當量烷基鹵化物或RAE),以良好的產率生成一系列二級-二級(10-12、15和16)和二級-一級加合物(9、13和14)。從操作角度來看,該反應可能是形成飽和C-C鍵(尤其是具有挑戰性的2°-2°鍵)的最簡單、最便宜的方法。這種偶聯方法的一個顯著特點是,不需要外源氧化還原化學反應。
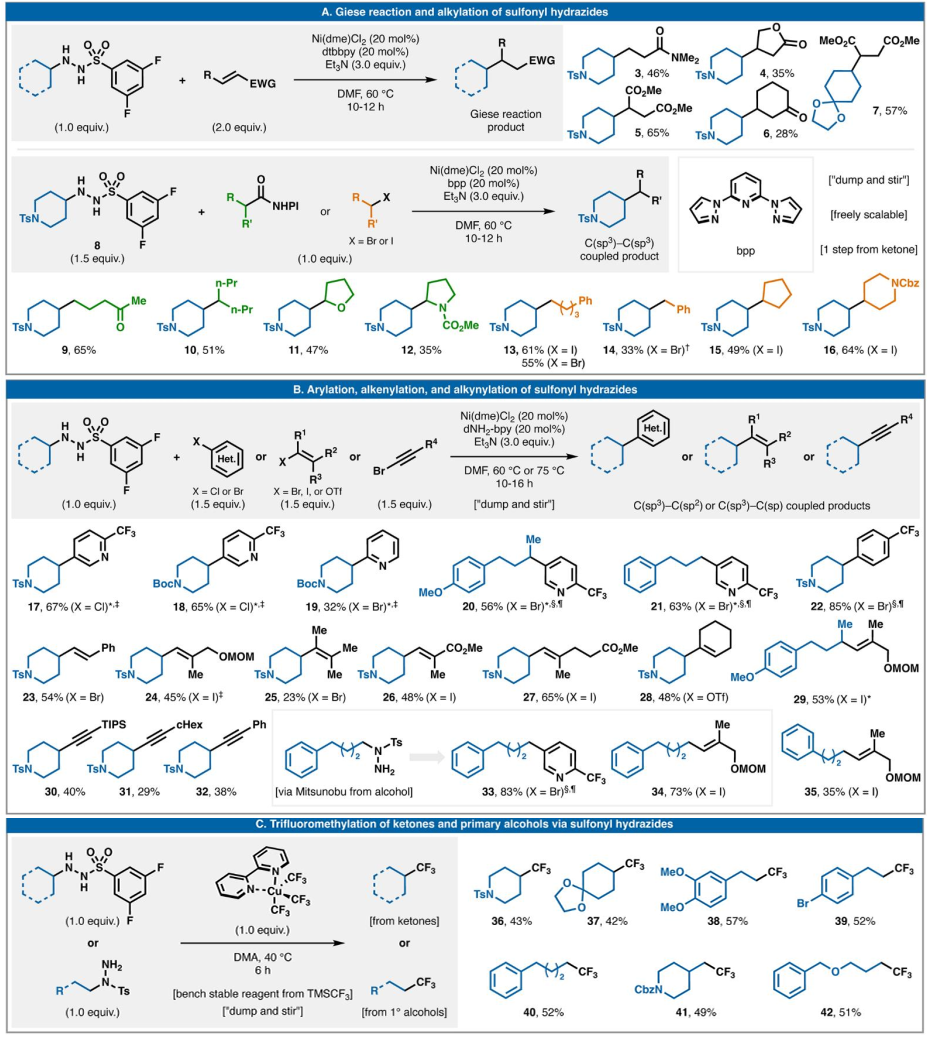
圖2. 磺酰肼的七種氧化還原中性反應
(圖片來源:Science)
轉向C(sp3)-C(sp2)和C(sp3)-C(sp)鍵,已確定一系列可行的偶聯配體(圖2B)。烯基供體(溴化物、碘化物和三氟甲磺酸酯)、芳基鹵化物(氯化物和溴化物)和炔基溴化物均能輕松與磺酰肼偶聯(分別為23-29 和34;17-22和33;30-32和35),使用與上述類似的條件,dNH2-bpy配體通常可產生更高的產率。與實現此類轉化的大多數還原模式不同,C(sp2)-鹵化物底物的質子脫鹵化和/或同二聚化受到極大抑制,從而簡化了產物分離。C(sp2)-氯化物和三氟甲磺酸酯的使用,以及不使用自燃試劑(Negishi和Kumada 型)、鈀或氧化還原聚焦反應裝置(光電化學)降低了這些自由基交叉偶聯廣泛應用的實際障礙。
上述反應都依賴于Ni-催化來促進有效的C-C鍵形成。然而,磺酰肼的使用并不局限于Ni,如圖2C所示,使用Grushin的商業Cu基試劑Cu(bpy)(CF3)3對這些物種(36-42)可進行直接三氟甲基化。與使用相同試劑對烷基鹵化物或醇進行相關的三氟甲基化不同,不需要外源氧化還原活化。
一般而言,3,5-二氟苯磺酰肼對二級環狀自由基表現出最佳反應性,但在許多情況下,如一級衍生自由基,可以使用簡單的對甲苯磺酰取代的酰肼(33-35和38-42)。在芳基化的情況下,簡單的對甲苯磺酰肼表現良好(17-22)。一般而言,酰肼產生的副產物在水相處理后很容易去除。這些反應非常適合并行篩選工作流程,因為它們是均相的,并且可以在非常小的規模上進行。由于它們的均相性,它們也可以輕松擴大規模。迄今為止的探索表明,大多數2°-環狀磺酰肼是實驗室穩定的物質,尤其是對甲苯磺酰肼。
從操作角度來看,可能希望直接從腙開始獲得偶聯產物,而無需分離相應的磺酰肼,類似于廣泛使用的Barluenga偶聯。在該反應中,磺酰腙簡單地與C(sp2)-硼酸結合,通過重氮中間體提供有用的C(sp2)-C(sp3)鍵。可以將簡單的硅烷(PhSiMe2H)原位添加到標準反應條件中,從而使用更方便的(雜)芳基鹵化物實現與還原性Barluenga偶聯等效的反應,如圖3所示。就實驗方案而言,操作上很簡單,因為磺酰腙的形成是定量的,并且分離是可選的。如果使用未經純化的腙,蒸發后存在的殘留量MeOH不會對隨后的偶聯產生重大影響。準備好腙(分離或蒸發甲醇后使用)后,添加剩余物料(ArX、Ni(dme)Cl2、dNH2-bpy),然后在N2或Ar下添加DMF(預攪拌直至均勻),然后添加堿和硅烷。將反應加熱至75 °C過夜(16-18小時),然后進行標準水性后處理。就芳基親電試劑范圍而言,趨勢與已知的Ni氧化加成速率所預期的趨勢一致。使用電子富集度高的配體(dNH2-bpy)和高溫有助于進一步擴大這一范圍。因此,富電子的芳基溴化物是可行的,但缺電子的芳基溴化物效果更好。缺電子的芳基氯化物是合適的偶聯劑,芳基三氟甲磺酸酯(18)也是如此。該類化合物可兼容多種功能團,包括對進一步功能化有價值的手柄:Bpin、多鹵代芳烴、游離戊二酰亞胺NH、游離氨基吡啶、芳基氟化物、SMe、四唑、芐基CHF2基團、腈、酯、酰胺、鄰位取代基以及具有挑戰性的雜環化合物,如嘧啶、吡嗪、吲唑和氮雜吲哚。環大小從4到6的環酮很容易反應。相鄰雜原子是可以容忍的,并且對于帶有預先存在的立體中心的酮(68和69),觀察到良好至高的非對映體比(d.r.)。復雜的橋接酮也能以高非對映選擇性提供有用數量的產品。最后,醛(77–79)也可以用于反應。
與圖2B中所示的磺酰肼直接芳基化不同,使用腙進行原位還原時觀察到的副產物更多,這些副產物源于質子脫鹵化和與還原亞磺酸鹽反應產生的產物。因此,圖3中的芳基化方法更適合于藥物化學中的快速篩選活動,因為在這種活動中分離產率不太重要。
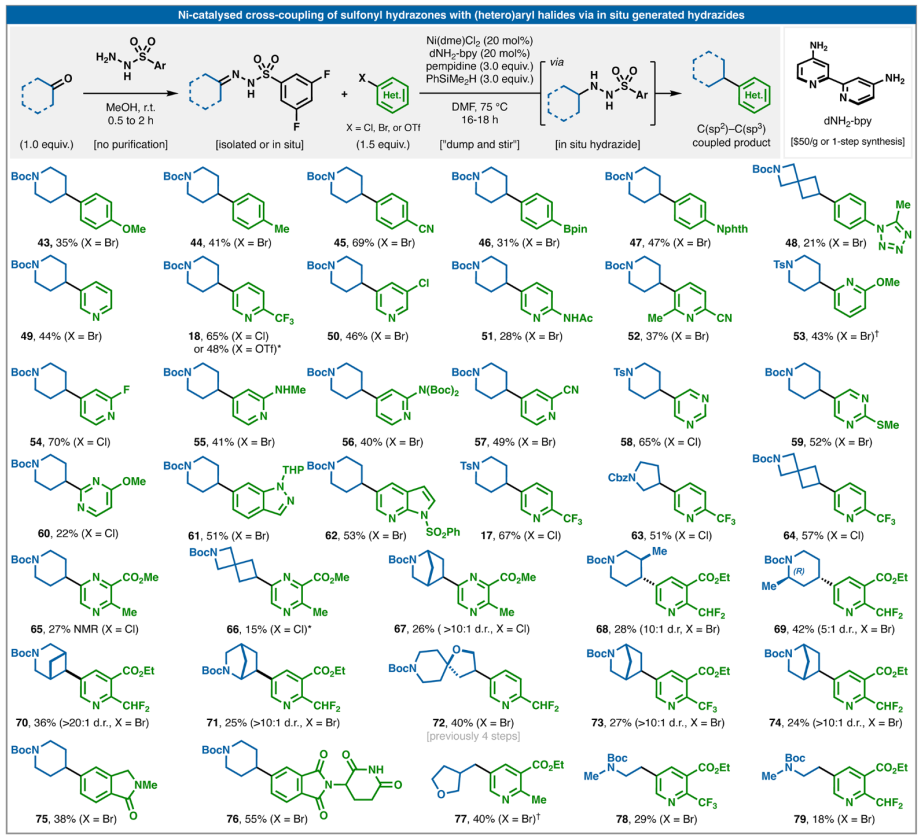
圖3. 磺酰肼和芳基鹵的一鍋法偶聯
(圖片來源:Science)
烷基磺酰肼的氧化還原中性自由基交叉偶聯可以大大簡化獲取多種有用結構單元的流程。如,羥乙基化吡啶80(圖4A)是市售的,但價格過高。逆合成方面,可以設想多種選擇,使用各種羥乙基替代物,如環氧乙烷、β-羥基酸/RAE、Katritzky鹽、硼酸供體、錫烷和氯乙醇。這些結構單元中的大多數要么不合適,要么不穩定,要么難以獲取,要么使用不方便。與之形成鮮明對比的是,商業肼88(0.2美元/克)和氯吡啶81(4-5美元/克)可采用單步工藝在室溫下攪拌30分鐘,然后加熱至75 °C并持續6小時合成,產率為68%。自由基交叉偶聯通常具有較高的化學選擇性,可進一步用于溫和的后期修飾,如替格瑞洛的直接官能化(圖 4B)。無需任何保護基化學反應,89可與TsNHNH2進行Mitsunobu反應以形成磺酰肼,然后立即(在水處理后)進行自由基交叉偶聯,以33%的產率經兩步得到芳基化加合物90。很難想象有更直接、更簡單的方法來實現這種轉化。
通過分別用芳基溴93和RAE 91處理磺酰肼8以良好的產率進行了克級底物17和92的制備。在自由基交叉偶聯中消除外源性氧化還原的明顯優勢不僅在于反應簡單,還在于有利于擴大規模,如圖 4C所示,1,4-反式取代的環己烷96和100可以分別使用磺酰肼供體94a與芳烴 95和99輕松通過“傾倒-攪拌”均相反應獲得。
盡管本文報道的Ni催化劑負載通常為20 mol%,但低至1 mol%的催化劑負載是可行的。在8和93的克級偶聯中,采用了10 mol%的負載(以80%的產率生成17),這進一步表明降低 Ni 負載是可能的。
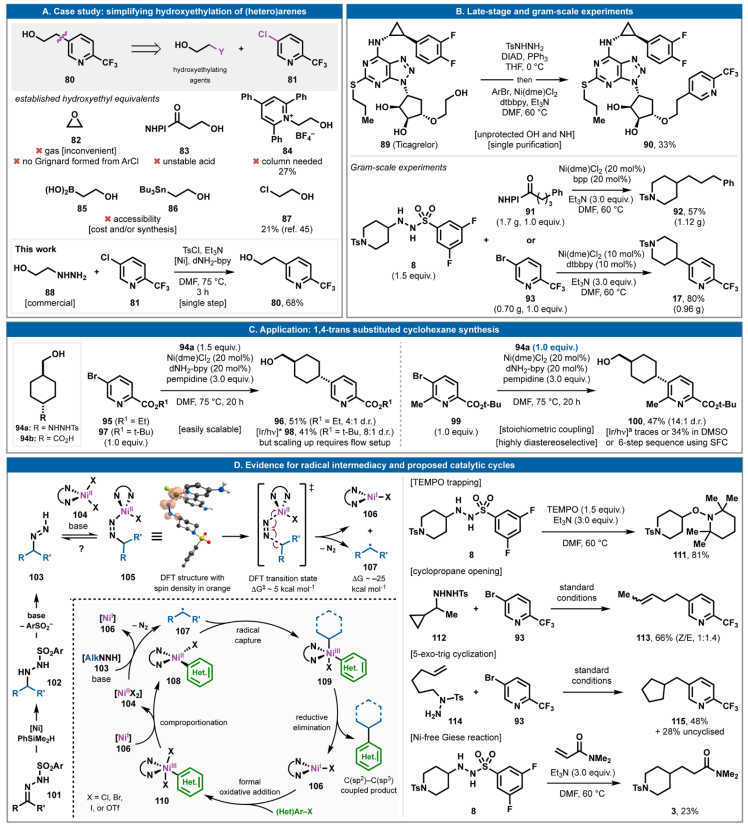
圖4. 后期應用及機理研究
(圖片來源:Science)
本文報道的七種反應類別可以單獨研究,以發掘其機制(圖4D)。溫和的堿會從起始酰肼102中釋放出二嗪物種103,隨后,由Ni-介導的碳自由基從102生成。該假設得到了DFT分析的支持,揭示了二嗪以Z構型與高自旋Ni(II) 復合物104結合的途徑。堿對質子的提取幾乎是熱中性的,得到中間體105。DFT分析發現,釋放二氮并形成還原Ni(I)物種106和烷基自由基107僅需要適中的勢壘(ΔG? ~5 kcal mol?1),并且熱力學下降約25 kcal mol?1。隨后,通過將低價Ni(I)形式氧化加成到(Het)Ar-X鍵(從106到110)并進行配位反應,在文獻中已充分證實了方平面Ni(II)復合物108的形成。研究表明,108捕獲自由基會產生高價 Ni復合物,如109。109的還原消除會產生C(sp2)-C(sp3)偶聯產物,并返回低價物種106,進而重新開始循環。TEMPO 即使在沒有Ni催化劑的情況下也能捕獲由酰肼產生的自由基(8到111),表明存在自由基背景途徑。可以看到一種有效的自由基途徑,其中環丙烷開環/112與 93偶聯以提供線性加合物113,5-exo-trig環化/114與93偶聯以提供環戊基底物 115。
總結
磺酰肼不僅可以作為多功能的自由基前體,還可以作為它們自己的電子供體,在排出N2的驅動下,促進金屬介導的催化循環,從而消除對外部氧化還原刺激的需求。磺酰肼通常是穩定的結晶物質,不需要通過色譜法純化,可以以粗品形式使用。這些基團的極性不是很強,在硅膠上表現良好。催化作用是用Ni來演示的,但可能適用于許多其他有機金屬體系。由于易于制備的磺酰肼將氧化還原化學與自由基交叉偶聯分開,因此反應設置大大簡化。這些C-C鍵形成反應很可能會在幾乎所有化學合成分支中得到應用。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn