



正文
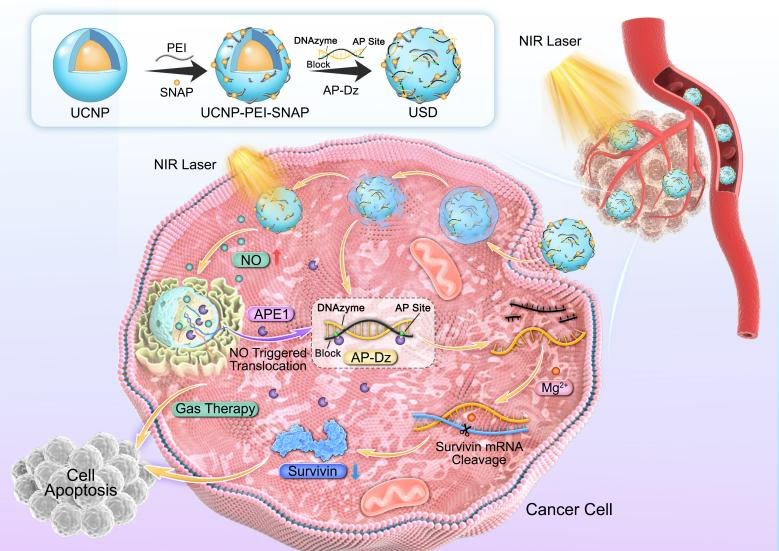
圖1. USD納米系統(tǒng)的合成過程及其在時(shí)空控制基因沉默和氣體協(xié)同癌癥治療中的應(yīng)用示意圖。
本工作開發(fā)了最終一種智能納米平臺(tái)(USD),它結(jié)合了NIR光觸發(fā)的NO釋放和APE1誘導(dǎo)的治療性DNAzymes激活,實(shí)現(xiàn)了時(shí)空特異性的氣體-基因協(xié)同治療(圖1)。該納米平臺(tái)由三個(gè)不同的部分組成:1)UCNPs作為光傳感器;2)S-亞硝基-乙酰青霉胺(SNAP)作為NO供體;3)基于DNAzymes的AP-Dz作為APE1激活的基因沉默單元。具體來說,AP-Dz是通過DNAzymes與AP鏈雜交建立的,其中DNAzymes可以靶向并切割靶標(biāo)生存蛋白(survivin mRNA),而AP鏈(包含兩個(gè)apurinic/apyrimidinic(AP)位點(diǎn))通過與DNAzymes雜交抑制其基因治療活性。當(dāng)納米系統(tǒng)在腫瘤部位積累后,NIR光照射使能量從UCNPs轉(zhuǎn)移到SNAP而產(chǎn)生NO,導(dǎo)致DNA損傷實(shí)現(xiàn)NO氣體治療。此外,在腫瘤細(xì)胞質(zhì)中過表達(dá)的APE1可以誘導(dǎo)AP-Dz在AP位點(diǎn)的裂解,恢復(fù)DNAzymes的基因治療活性。值得注意的是,NO介導(dǎo)APE1從細(xì)胞核到細(xì)胞質(zhì)的易位提高了DNAzymes的激活效率,從而提高基因沉默效果。總之,NIR觸發(fā)的級(jí)聯(lián)效應(yīng)納米系統(tǒng)提高了基因沉默的準(zhǔn)確性和治療效率,顯示了基因-氣體協(xié)同治療的潛力。
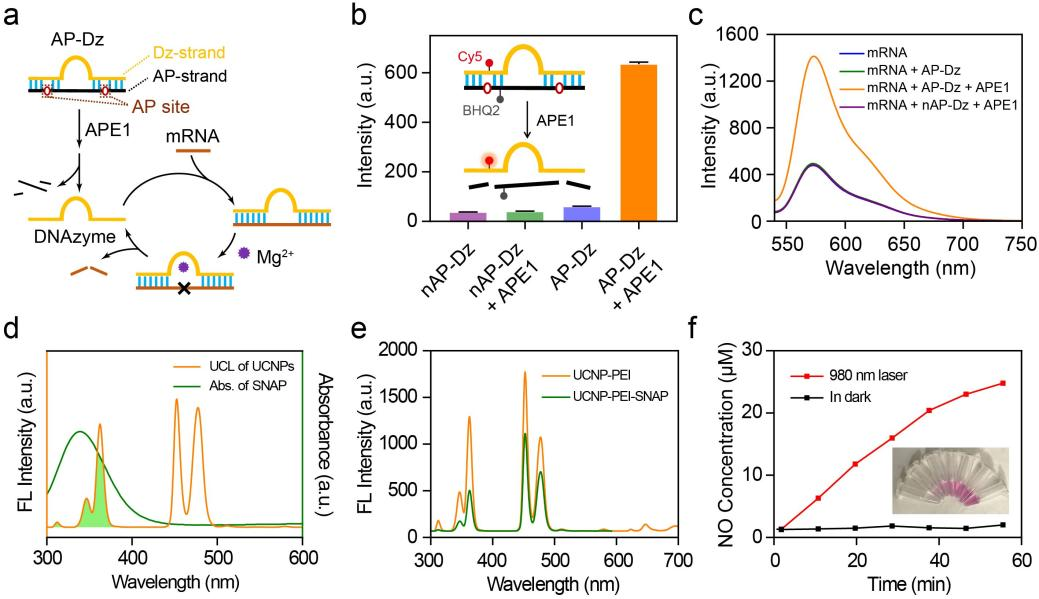
圖2 溶液相實(shí)驗(yàn).
作者首先對(duì)USD響應(yīng)相關(guān)性能進(jìn)行了驗(yàn)證(圖2)。溶液相熒光實(shí)驗(yàn)證明,AP-Dz對(duì)APE1酶具有良好的響應(yīng)性能,且當(dāng)將靶標(biāo)mRNA,AP-Dz和APE1酶共孵育時(shí),DNAzymes表現(xiàn)出高效的mRNA切割能力。由于該納米平臺(tái)中UCNPs在NIR照射下的發(fā)射光譜與NO供體的吸收光譜存在明顯重疊,作者探究了NIR照射下該納米平臺(tái)的NO釋放能力。實(shí)驗(yàn)結(jié)果顯示,隨著NIR照射時(shí)間的延長(zhǎng),溶液中NO濃度不斷提高,顯示出該納米平臺(tái)產(chǎn)生NO的能力。
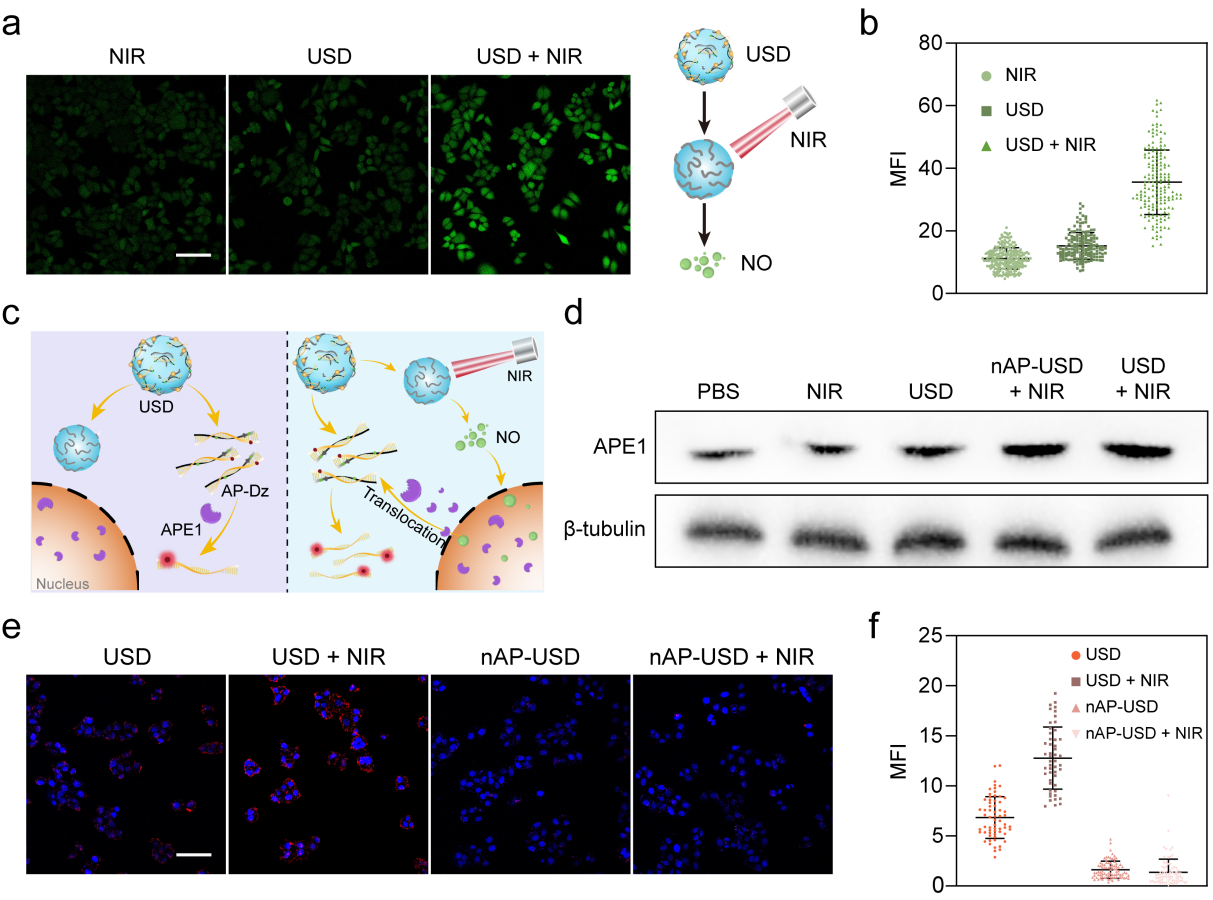
圖3 細(xì)胞內(nèi)NO產(chǎn)生與APE1響應(yīng)驗(yàn)證.
隨后作者在細(xì)胞水平考察了該納米系統(tǒng)的NO產(chǎn)生能力(圖3),共聚焦實(shí)驗(yàn)證明USD在NIR照射下有效產(chǎn)生NO,而黑暗條件下NO產(chǎn)生水平幾乎可以忽略。通過蛋白免疫印記(WB)實(shí)驗(yàn),作者驗(yàn)證了該納米系統(tǒng)在NIR照射下引起了HeLa細(xì)胞細(xì)胞質(zhì)中APE1表達(dá)水平的上調(diào),并通過共聚焦實(shí)驗(yàn)驗(yàn)證了AP-Dz在細(xì)胞中對(duì)APE1的響應(yīng)能力。共聚焦圖片顯示,相對(duì)于nAP-USD和nAP-USD+NIR組,USD處理組的HeLa細(xì)胞顯示出增強(qiáng)的紅色熒光信號(hào),證明了AP-Dz響應(yīng)于腫瘤細(xì)胞質(zhì)中高表達(dá)的APE1酶后釋放DNAzymes。特別強(qiáng)調(diào)的是,USD+NIR處理組的HeLa細(xì)胞顯示出更強(qiáng)的的熒光信號(hào),這是由于NIR激發(fā)USD產(chǎn)生NO,NO引起細(xì)胞質(zhì)中APE1水平的升高,增強(qiáng)了AP-Dz的激活效果。
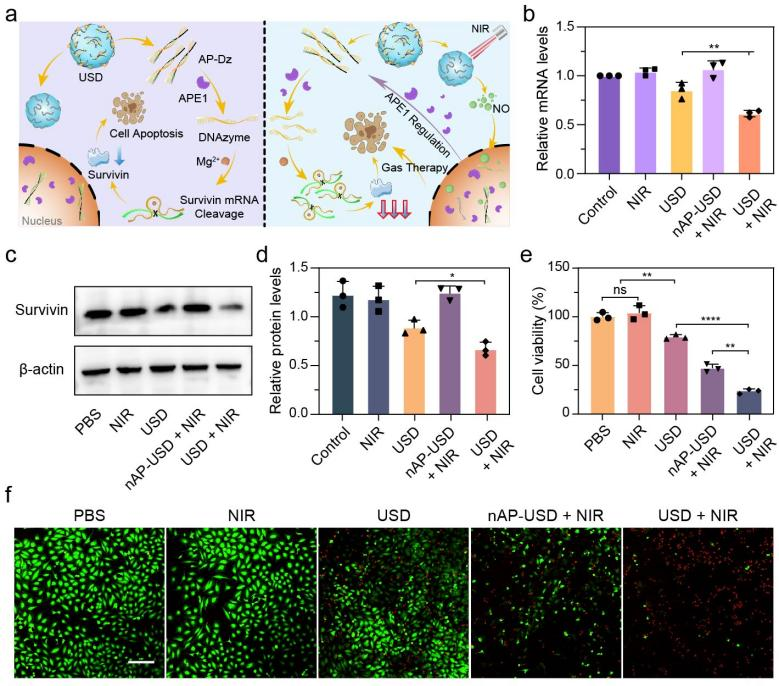
進(jìn)一步對(duì)USD的基因沉默和NIR光控NO釋放在細(xì)胞內(nèi)治療效果進(jìn)行了探究(圖4)。實(shí)時(shí)熒光定量PCR(qRT-PCR)和蛋白免疫印記(WB)實(shí)驗(yàn)證實(shí),NIR激發(fā)的級(jí)聯(lián)效應(yīng)將有效提高靶標(biāo)蛋白的沉默效果。另外,細(xì)胞毒性與活死染色實(shí)驗(yàn)證明,NO也將直接參與腫瘤殺傷,最終實(shí)現(xiàn)基因-氣體協(xié)同抗腫瘤效果。
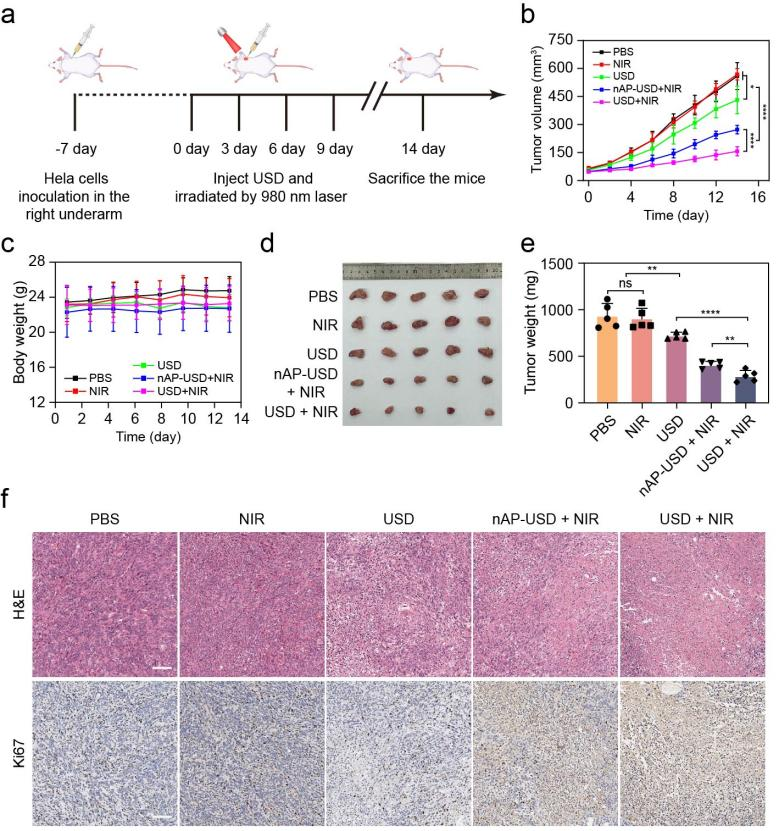
除此之外,小鼠宮頸癌腫瘤模型實(shí)驗(yàn)證實(shí),該納米系統(tǒng)在NIR激發(fā)下展現(xiàn)出良好的協(xié)同抗腫瘤能力(圖5),突顯了該納米平臺(tái)在精準(zhǔn)、高效抗腫瘤中的應(yīng)用潛力,也為DNAzymes在疾病精準(zhǔn)治療中的應(yīng)用提供了參考范例。
總結(jié)
本工作開發(fā)了一種NIR觸發(fā)的級(jí)聯(lián)效應(yīng)納米系統(tǒng),用于時(shí)空精確可控的基因沉默和氣體-基因協(xié)同癌癥治療。在這個(gè)納米系統(tǒng)中,UCNPs作為光轉(zhuǎn)換器,在NIR光下產(chǎn)生NO來介導(dǎo)氣體治療。同時(shí),產(chǎn)生的NO誘導(dǎo)了APE1的亞細(xì)胞重定位,從而提高了DNAzymes的激活效率。這種NIR觸發(fā)的級(jí)聯(lián)效應(yīng)允許時(shí)空控制的基因沉默和基因-氣體協(xié)同治療,在體外和體內(nèi)實(shí)現(xiàn)增強(qiáng)的抗癌效果。
論文第一作者為深圳大學(xué)博士后程亞如,通訊作者為深圳大學(xué)醫(yī)學(xué)部生物醫(yī)學(xué)工程學(xué)院董海峰教授。本工作得到了國(guó)家重大研究計(jì)劃項(xiàng)目,國(guó)家自然科學(xué)基金,深圳市醫(yī)學(xué)研究專項(xiàng)資金項(xiàng)目,廣東省珠江團(tuán)隊(duì)項(xiàng)目和中國(guó)博士后科學(xué)基等項(xiàng)目的資助。
作者簡(jiǎn)介
董海峰,國(guó)家優(yōu)青,深圳大學(xué)特聘教授/博導(dǎo),深圳大學(xué)發(fā)展規(guī)劃部副主任兼學(xué)科建設(shè)辦公室主任,校學(xué)術(shù)委員會(huì)委員,深圳市納米生物傳感技術(shù)重點(diǎn)實(shí)驗(yàn)室副主任。主要從事生物分子傳感及納米藥物分析研究。2010年以來,在Chem. Rev., Nat. Commun., Angew. Chem., Adv. Mater.等雜志發(fā)表SCI論文167篇,論文被引用12000余次。出版中英文專著2本,主編英文專著1本。2020-2023年科睿唯安全球高被引科學(xué)家,入選斯坦福大學(xué)“2020-2022全球前2頂尖科學(xué)家”名單及終生榜單。主要研究方向:生物傳感、microRNA分析檢測(cè)、納米診療。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn