



四氫-b-咔啉 (Tetrahydro-b-carboline, THbC) 是一類重要的含氮化合物,廣泛存在于天然產(chǎn)物和活性分子中。該類結(jié)構(gòu)具有顯著的生理活性,其中一些化合物被作為藥物使用,如利血平 (Reserpine)、育亨賓 (Yohimbine)和他達拉非(Tadalafil)等 (圖1)。THβC獨特的結(jié)構(gòu)和顯著的活性已經(jīng)吸引了眾多研究者的目光,特別是在不對稱催化合成領(lǐng)域。目前在不對稱催化合成THbC衍生物方面存在一些挑戰(zhàn),首先是如何構(gòu)建具有連續(xù)手性中心的THbC衍生物,特別是與C1直接相連的手性中心,目前主要通過分步反應(yīng)合成,存在非對映選擇性差的問題。其次是如何合成含有C1季碳手性中心的1,1-二取代的THbC衍生物。含有C1季碳手性中心的1,1-二取代THbC衍生物的不對稱合成主要依賴于Pictet-Spengler反應(yīng),但目前發(fā)展的Pictet-Spengler反應(yīng)局限于從醛出發(fā)構(gòu)建C1位非季碳手性中心THβC骨架,或者具有活化羰基的酮參與反應(yīng),導致THbC骨架C1位取代基必須連有羰基,限制了產(chǎn)物的進一步合成轉(zhuǎn)化。如何高立體選擇性地實現(xiàn)C1季碳THbC結(jié)構(gòu)的構(gòu)筑具有很大挑戰(zhàn)。最后是如何將發(fā)展的方法學應(yīng)用到THbC類天然產(chǎn)物的集群式合成中。該類天然產(chǎn)物數(shù)量眾多,如果能夠發(fā)展多樣性導向的合成方法并且實現(xiàn)該類天然產(chǎn)物的集群式合成,那將為其活性研究奠定堅實基礎(chǔ)。為了解決上述挑戰(zhàn),發(fā)展新的合成子和新的不對稱催化反應(yīng)合成THbC骨架是很有必要的。
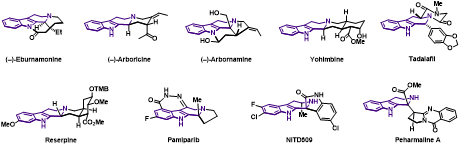
圖1. 含四氫-β-咔啉結(jié)構(gòu)的天然產(chǎn)物和藥物分子
中國海洋大學王楊副教授團隊致力于含氮雜環(huán)的新型不對稱催化合成方法研究及其導向的藥物化學和天然產(chǎn)物合成。近日,該團隊在Nature Communications(Nat. Commun. 2024, 15, 6429)發(fā)表論文,以3,4-二氫-β-咔啉氧化物作為原料,發(fā)展了在手性磷酸催化下與烯醚的不對稱1,3-偶極環(huán)加成反應(yīng),以優(yōu)異的產(chǎn)率和立體選擇性得到了三類THβC并異噁唑衍生物(含有兩個手性中心、含有連續(xù)三個手性中心和含有季碳手性中心)。產(chǎn)物中N?O鍵便于進行衍生化,作者發(fā)展了兩種N?O鍵切斷方法,包括鹵代烷/DABCO條件切斷N?O鍵合成β-氨基酯和SmI2/MeOH條件切斷N?O鍵得到β-氨基醇。以兩種N?O鍵切斷方法作為關(guān)鍵反應(yīng),完成了40個THβC吲哚生物堿的集群式不對稱合成(圖2. b)。該研究成果近期發(fā)表在Nature Communications上,本文的第一完成單位是中國海洋大學醫(yī)藥學院。王楊副教授為通訊作者。文章的共同第一作者是中國海洋大學博士研究生田曉晨、宣騰飛及浙江工業(yè)大學高井昆。浙江工業(yè)大學楊云芳教授作為共同通訊作者進行了DFT計算的研究。
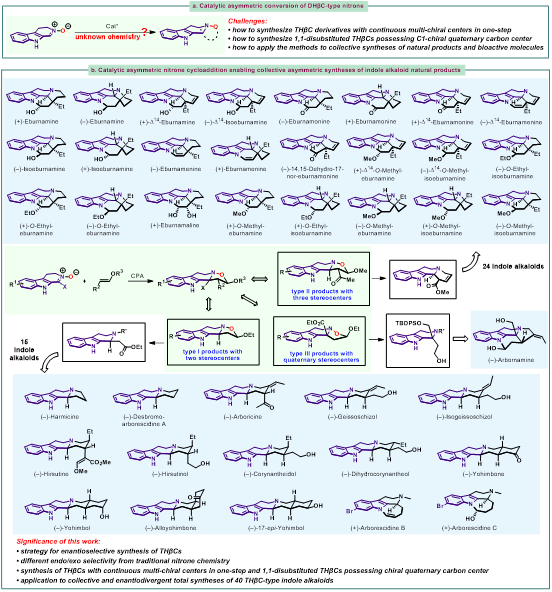
圖2. 3,4-二氫-β-咔啉氧化物參與的不對稱催化反應(yīng)
在確定最佳反應(yīng)條件后,作者對于3,4-二氫-β-咔啉氧化物與烯醚環(huán)化反應(yīng)的底物范圍進行了考察 (圖3)。結(jié)果顯示,當?shù)孜?/span>1與乙烯基乙醚2a反應(yīng)時,在底物吲哚的4位、5位、6位、7位引入不同電子效應(yīng)的取代基,均能以中等至優(yōu)異的產(chǎn)率和對映選擇性得到目標產(chǎn)物,同時產(chǎn)物的Dr值大于19>1。當使用二取代的烯醚2b參與反應(yīng),相應(yīng)的目標產(chǎn)物含有連續(xù)三個手性中心,并具有優(yōu)異的產(chǎn)率和立體選擇性。使用酯基取代的底物6作為底物,得到的產(chǎn)物具有季碳手性中心。重新優(yōu)化了反應(yīng)條件,能夠以中等至優(yōu)異的產(chǎn)率和對映選擇性得到相應(yīng)的目標產(chǎn)物7。
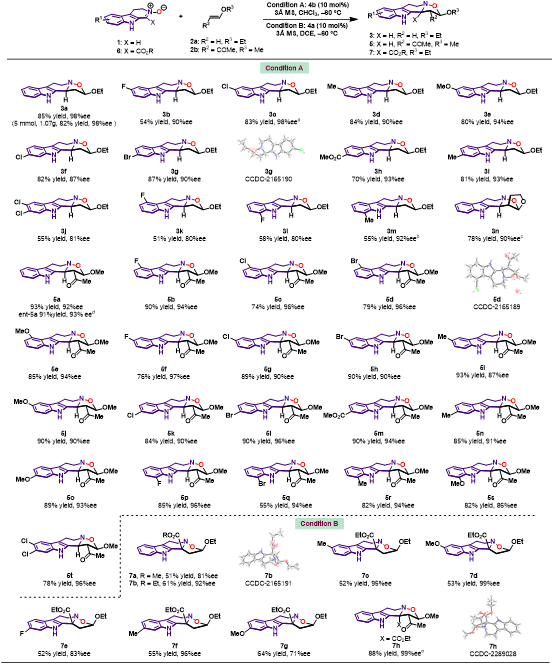
圖3. 底物范圍
為了深入了解反應(yīng)機理,作者與楊云芳教授團隊合作進行了密度泛函理論(DFT)計算 (圖4)。對于產(chǎn)物3a、7b和7h的形成,DFT計算揭示了手性磷酸與硝酮的氧原子具有氫鍵相互作用,底物以協(xié)同的方式加成得到目標產(chǎn)物。而1a和2b的加成反應(yīng),手性磷酸則作為雙功能催化劑同時活化兩個底物,并且通過分步路徑進行。在反應(yīng)過程中,首先形成C?O鍵,隨后形成C?C鍵,C?C的形成是決速步。根據(jù)前線分子軌道(FMO)分析,主要的FMO相互作用發(fā)生在2a的HOMO和1a的LUMO之間。因此,手性磷酸與偶極子1a相互作用以降低其LUMO軌道能量。6b與2a和2b的反應(yīng)中,也觀察到了該相互作用。然而,對于1a和2b的加成反應(yīng),主要的FMO相互作用發(fā)生在1a的HOMO軌道和2b的LUMO軌道之間,與前述情況不同。在該反應(yīng)中,手性磷酸傾向于通過與2b的乙酰基形成氫鍵相互作用來活化2b。
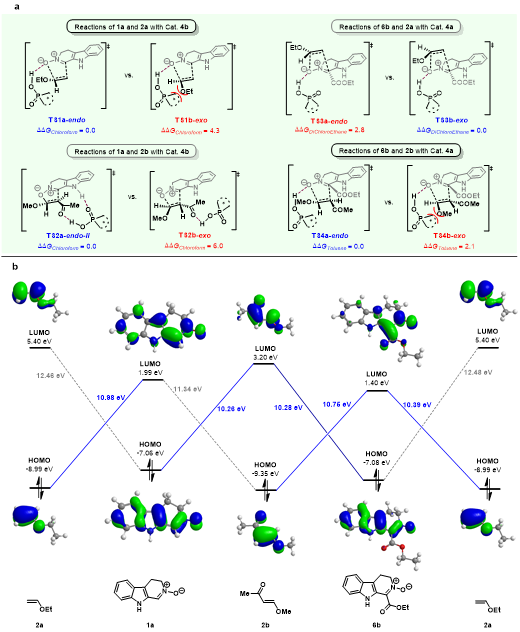
圖4. DFT計算
為了進一步得到多樣性和多官能團化的THbC衍生物,作者對N?O鍵的切斷進行了研究 (圖5)。產(chǎn)物中的異噁唑結(jié)構(gòu)與鹵代烷反應(yīng)能夠形成季銨鹽,隨后在DABCO作用下開環(huán),得到不同N-烷基取代的b-氨基酯。在SmI2/MeOH條件下,N?O鍵可以被還原,將氨基用Boc基團保護,得到b-氨基醇。
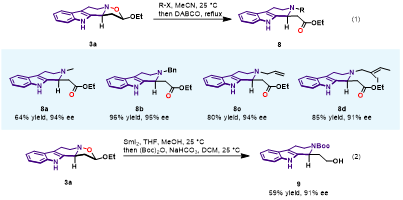
圖5. N?O鍵切斷
在建立了3,4-二氫-β-咔啉氧化物與烯醚的環(huán)化反應(yīng)方法學以及N?O切斷方法以后,作者對于方法學產(chǎn)物在天然產(chǎn)物合成中的應(yīng)用進行了探索。合成思路是用不同的鹵代烷參與N?O切斷反應(yīng),得到N-烷基-b-氨基酯,通過官能團轉(zhuǎn)化和結(jié)構(gòu)修飾,實現(xiàn)了Arborescidine家族、Harmicine、Corynanthe家族、Yohimbine家族等15個天然產(chǎn)物的全合成 (圖6)。
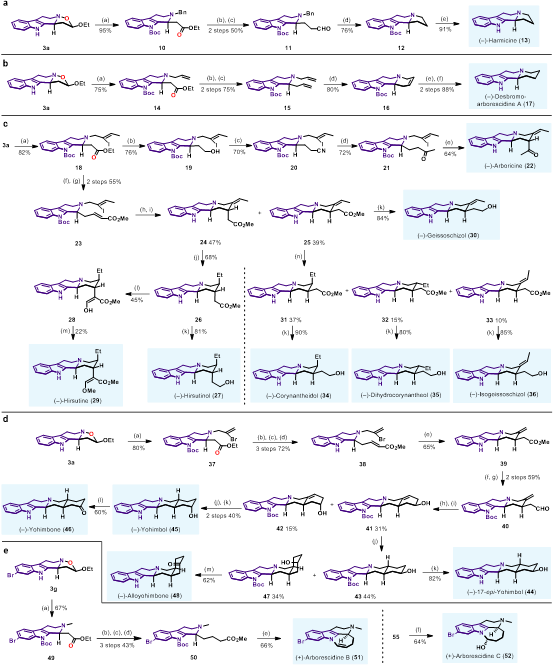
圖6. Type I型產(chǎn)物在全合成中的應(yīng)用
從夾竹桃科植物中分離得到的Eburnane家族生物堿具有多種生物活性,對于該類天然產(chǎn)物的全合成研究吸引了很多關(guān)注。目前,在Eburnane家族生物堿的全合成研究中,C20、C21位的立體化學控制一直是合成的難點。目前常用的方法是通過C20位的手性中心來誘導C21位手性中心的形成,如底物控制的Pictet-Spengler反應(yīng)、Bischler-Napieralski反應(yīng)與亞胺還原的串聯(lián)反應(yīng),但是反應(yīng)的非對映選擇性通常較差,僅有個別底物能實現(xiàn)優(yōu)異的立體選擇性控制。在該工作中,作者以具有連續(xù)三個手性中心的Type II型產(chǎn)物5a作為原料,利用其產(chǎn)物結(jié)構(gòu)中連續(xù)的手性中心,實現(xiàn)了24個Eburnane家族生物堿的全合成,通過雙負離子中間體的排斥作用,實現(xiàn)了C20、C21位手性中心的立體選擇性控制(圖7)。另外,作者以具有季碳手性中心的Type III型產(chǎn)物7b作為原料,實現(xiàn)了1,1-二取代THβC天然產(chǎn)物Arbornamine的全合成(圖7. c)。
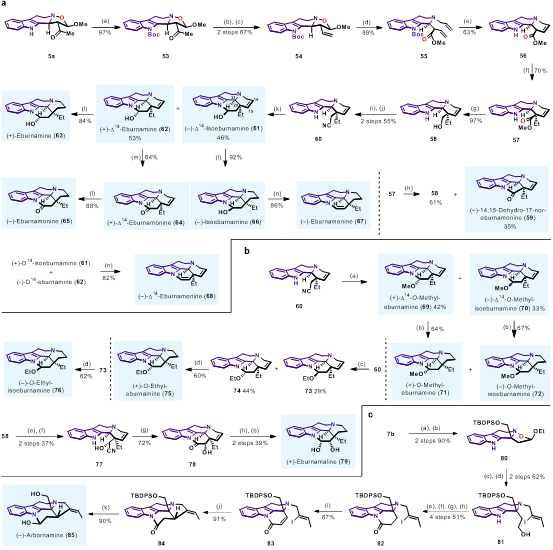
圖7. Type II型產(chǎn)物和Type III型產(chǎn)物在全合成中的應(yīng)用
Eburnane家族生物堿廣泛分布于夾竹桃科的植物體內(nèi),在分離過程中經(jīng)常發(fā)現(xiàn)該家族天然產(chǎn)物具有生源合成的對映發(fā)散性,即兩種對映異構(gòu)體均存在于植物體中。作者以ent-5a為起始原料,完成了該家族生物堿的對映發(fā)散性合成 (圖8)。
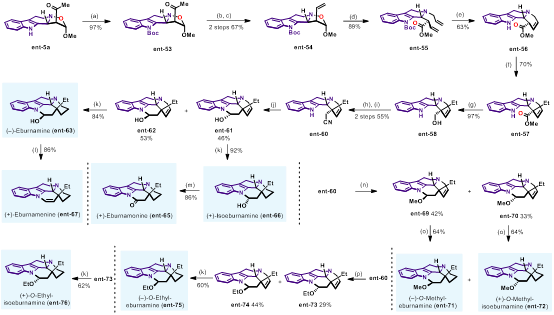
圖8. Eburnane家族生物堿的對映發(fā)散性合成
小結(jié)
王楊課題組發(fā)展了首例3,4-二氫-β-咔啉氧化物參與的不對稱催化反應(yīng)。在手性磷酸催化下,該底物與烯醚的發(fā)生環(huán)加成反應(yīng),構(gòu)建了一系列高選擇性的THβC衍生物,具有優(yōu)異的產(chǎn)率和立體選擇性,并且完成了40個THβC吲哚生物堿的集群式不對稱合成。該研究展示了3,4-二氫-β-咔啉氧化物在合成手性THβC骨架方面的巨大潛力。
通訊作者簡介

王楊 副教授
王楊,中國海洋大學副教授,博士生導師。2019年加入中國海洋大學醫(yī)藥學院獨立開展研究工作,入選中國海洋大學“青年英才”工程第二層次。2020年入選山東省泰山學者青年專家。近年來在Science, Chem. Soc. Rev., Nat. Commun., J. Am. Chem. Soc., Angew. Chem. Int. Ed., ACS Catal., Chem. Sci., Green Chem., Green Synth. Catal., Org. Lett., J. Org. Chem., Chem. Eur. J., Asian J. Org. Chem., Synthesis等期刊發(fā)表SCI收錄論文三十余篇,獲得授權(quán)專利4項。主要研究領(lǐng)域為含氮雜環(huán)的新型不對稱催化合成方法研究及其導向的藥物化學和天然產(chǎn)物合成。
聲明:化學加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn