

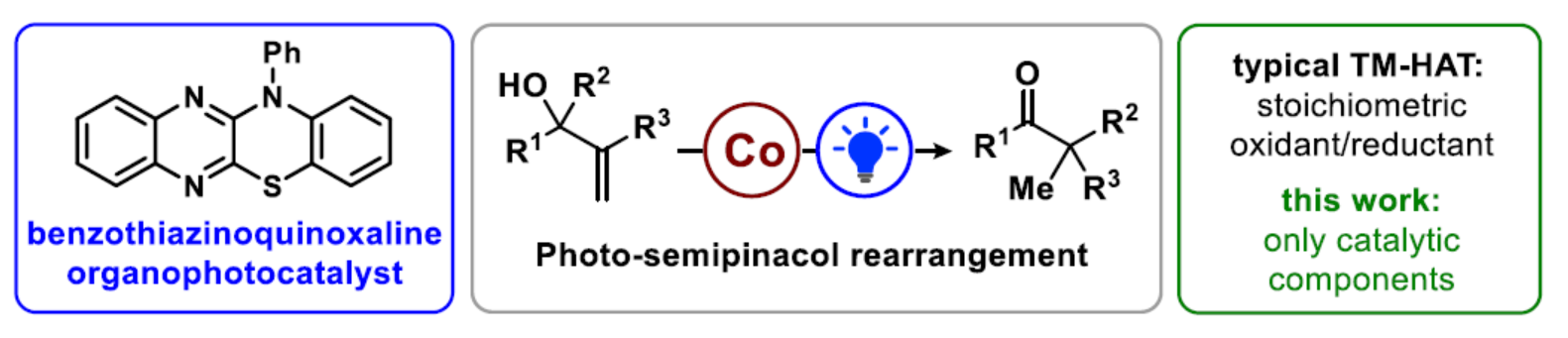
正文
碳陽離子是有機合成中有價值的反應物種。它們是反應中的關鍵中間體,如SN1取代、Wagner-Meerwein遷移、Friedel-Crafts烷基化和多烯環化等。在溫和條件下精確控制陽離子反應性有利于開發新的反應,特別是對映和非對映選擇性的控制。例如,基于squaramides、硫脲以及手性磷酸和羧酸的催化劑的設計。最近,光氧化還原催化已成為一種生成自由基并影響其氧化為具有相應反應性陽離子的簡便方法。近日,Erick M. Carreira課題組開發了一種光與鈷催化非活化烯丙醇的半頻哪醇重排反應(Figure 1)。其中,該反應以苯并噻嗪并喹喔啉作為光催化劑、Co-salen作為金屬催化劑和Lut-HOTf作為堿,并與使用Br?nsted酸的體系具有互補的反應性。同時,該反應無需使用化學計量的還原劑或氧化劑,具有高度的原子經濟性。化學加——科學家創業合伙人,歡迎下載化學加APP關注。
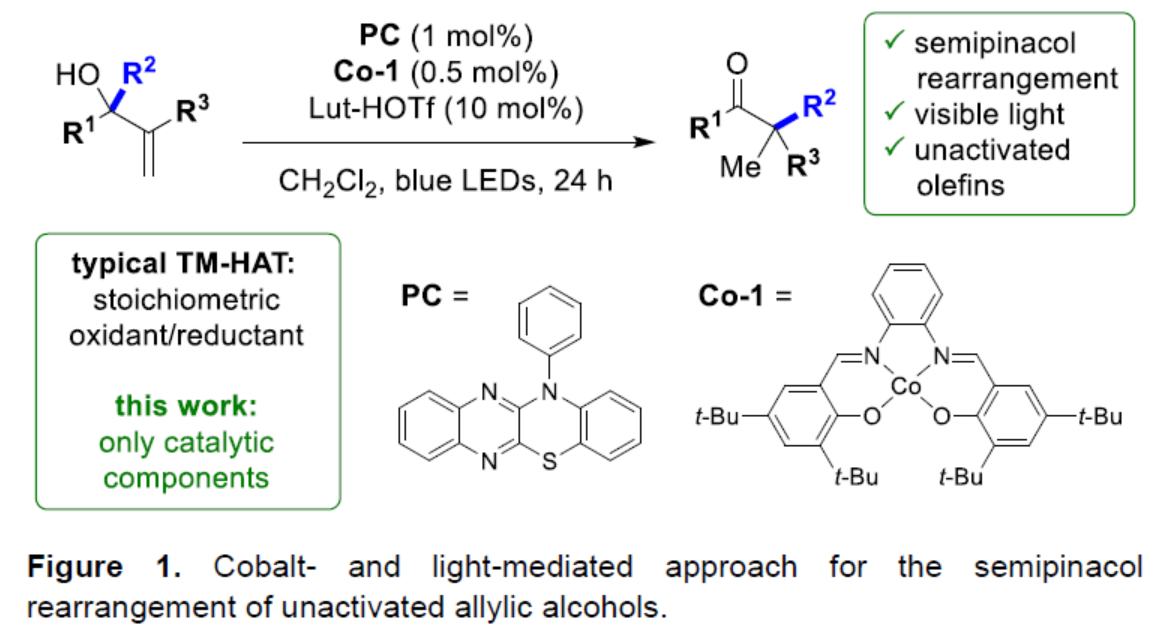
(圖片來源:Angew. Chem. Int. Ed.)
傳統上,陽離子半頻哪醇重排常使用Br?nsted或Lewis酸。1980年,Wasserman課題組(J. Org. Chem. 1980, 45, 2874.)開發了一種烯丙醇在HBr、H2SO4或HClO4條件下合成環丁酮的方法(Figure 2)。2023年,Jacobsen課題組(J. Am. Chem. Soc. 2023, 145, 15036.)使用手性脲和干燥的HCl來影響乙烯基環丙醇的轉化,合成了對映體富集的α,α-二取代的環丁酮。此外,在一項關于HAT化學的研究中,Pronin課題組(J. Am. Chem. Soc. 2018, 140, 16982.)發現,在Co-salen以及過量的PhSiH2Me和N-fluorocollidinium triflate存在下,烯丙醇可以進行擴環,生成環烷酮衍生物。這些經典的HAT條件下,使用化學計量還原劑(硅烷)和氧化劑([F+]),可實現[Co]-催化劑在不同氧化態之間的穿梭。最近,Carreira(Angew. Chem. Int. Ed. 2024, 63, e202319515.)與Ohmiya課題組(J. Am. Chem. Soc. 2022, 144, 7953.)分別報道了非活化烯烴的環異構化和加氫醚化反應。此類反應通過對烯烴的氫加成,然后氧化成陽離子中間體來進行。并且,使用關鍵的光催化劑、鈷催化劑和氫三氟甲磺酸鹽(hydrotriflate salt),消除了對化學計量氧化劑/還原劑的需求。
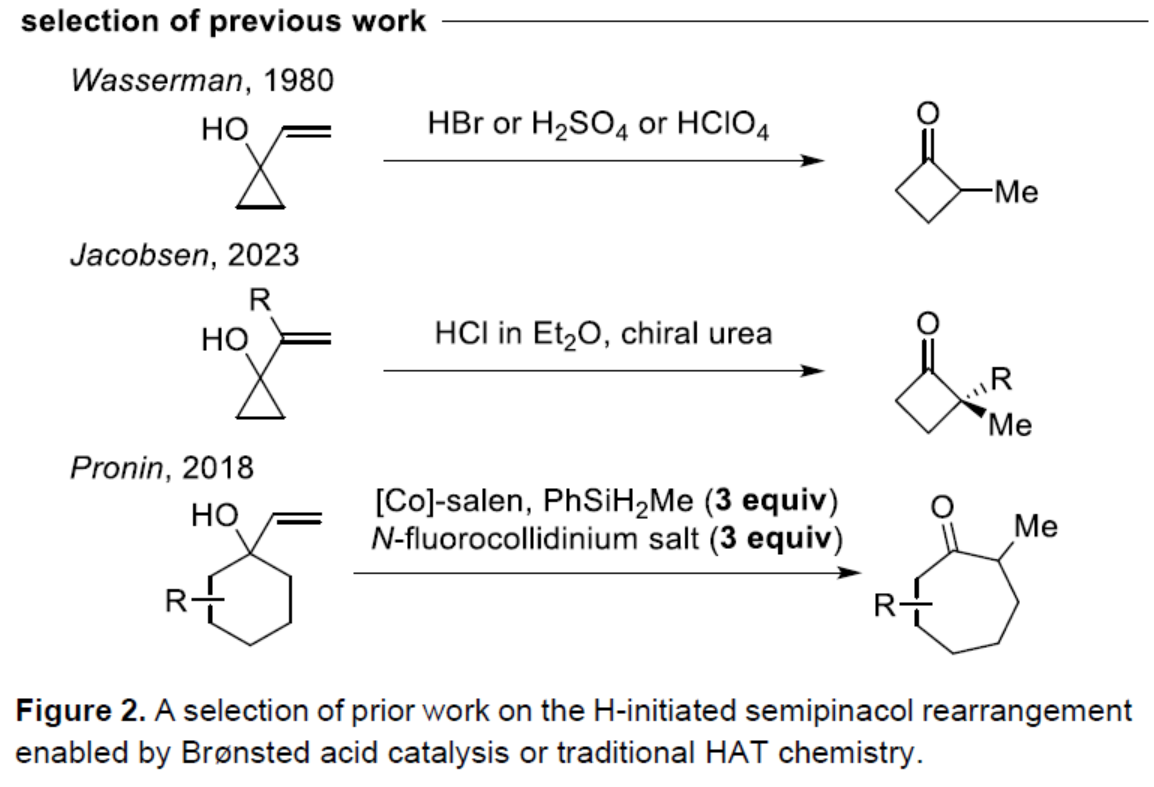
(圖片來源:Angew. Chem. Int. Ed.)
首先,作者以烯丙醇衍生物1a作為模型底物,進行了相關反應條件的篩選(Table 1)。當以PC(1 mol %)作為光催化劑,Co-1(0.5 mol %)作為金屬催化劑,Lut-HOTf(10 mol %)作為添加劑,藍色LEDs作為光源,在CH2Cl2溶劑中40 oC反應24 h,可以85%的收率得到α-甲基化酮產物2a。
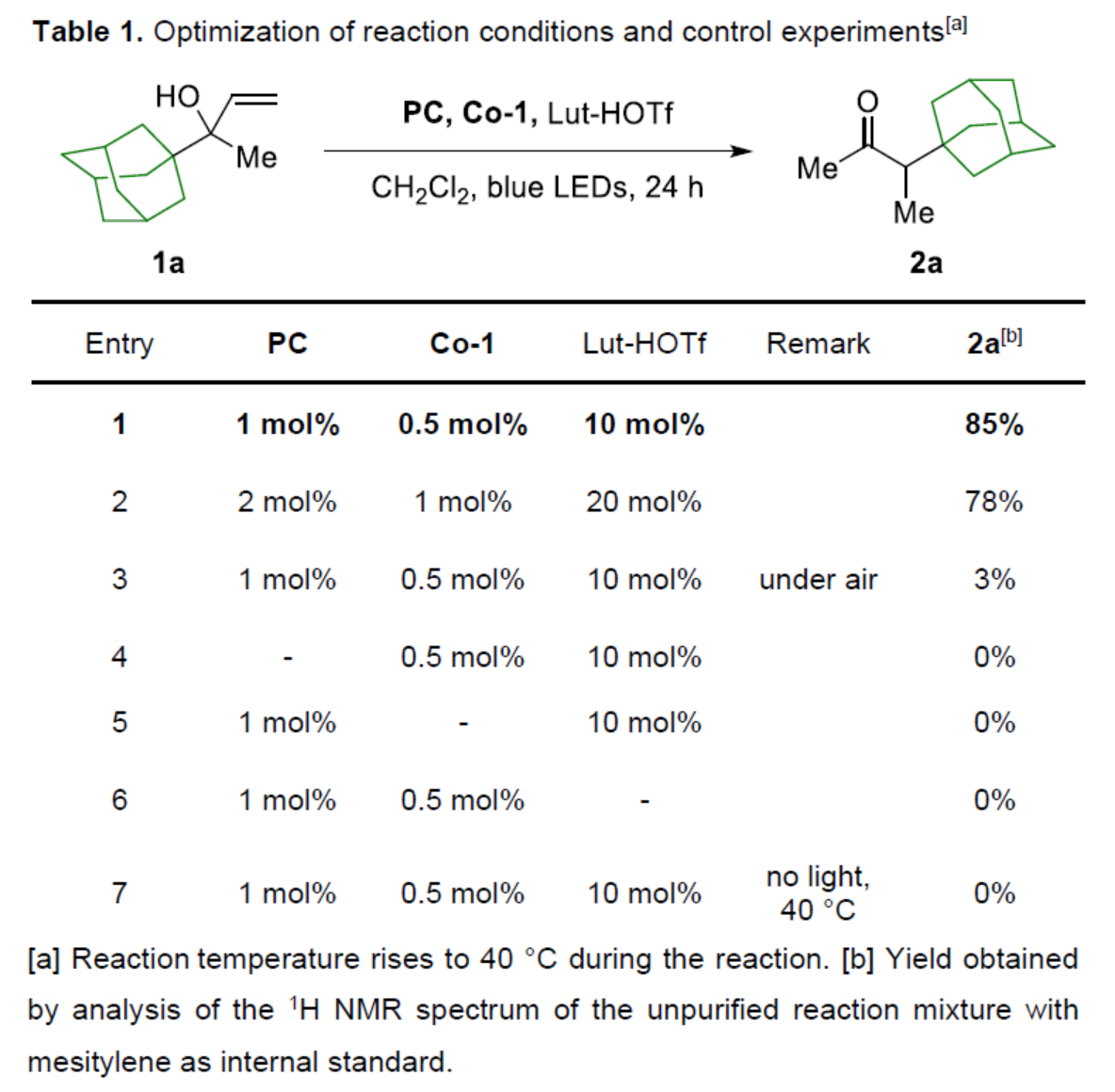
(圖片來源:Angew. Chem. Int. Ed.)
在獲得上述最佳反應條件后,作者對底物范圍進行了擴展(Figure 3)。首先,當底物中的R2為金剛烷基、三甲基、環烷基、游離羥基、不同電性取代的芳基、萘基等時,均可順利反應,獲得相應的產物2a-2k,收率為54-87%。同時,該方法還可進行雙重半頻哪醇重排反應,可以76%的收率得到產物2l,dr為1:1。該反應還可用于擴環,可以44%的收率得到產物2m。其次,當底物中的R1為各種烷基、環烷基以及不同電性取代的芳基時,也能夠順利進行反應,獲得相應的產物2n-2z,收率為60-87%。此外,該策略還可用于藥物分子的后期衍生化,如酮洛芬和非諾貝特,獲得相應的產物2aa(收率為68%)和2ab(收率為76%,dr為1:1,rr為1:1)。
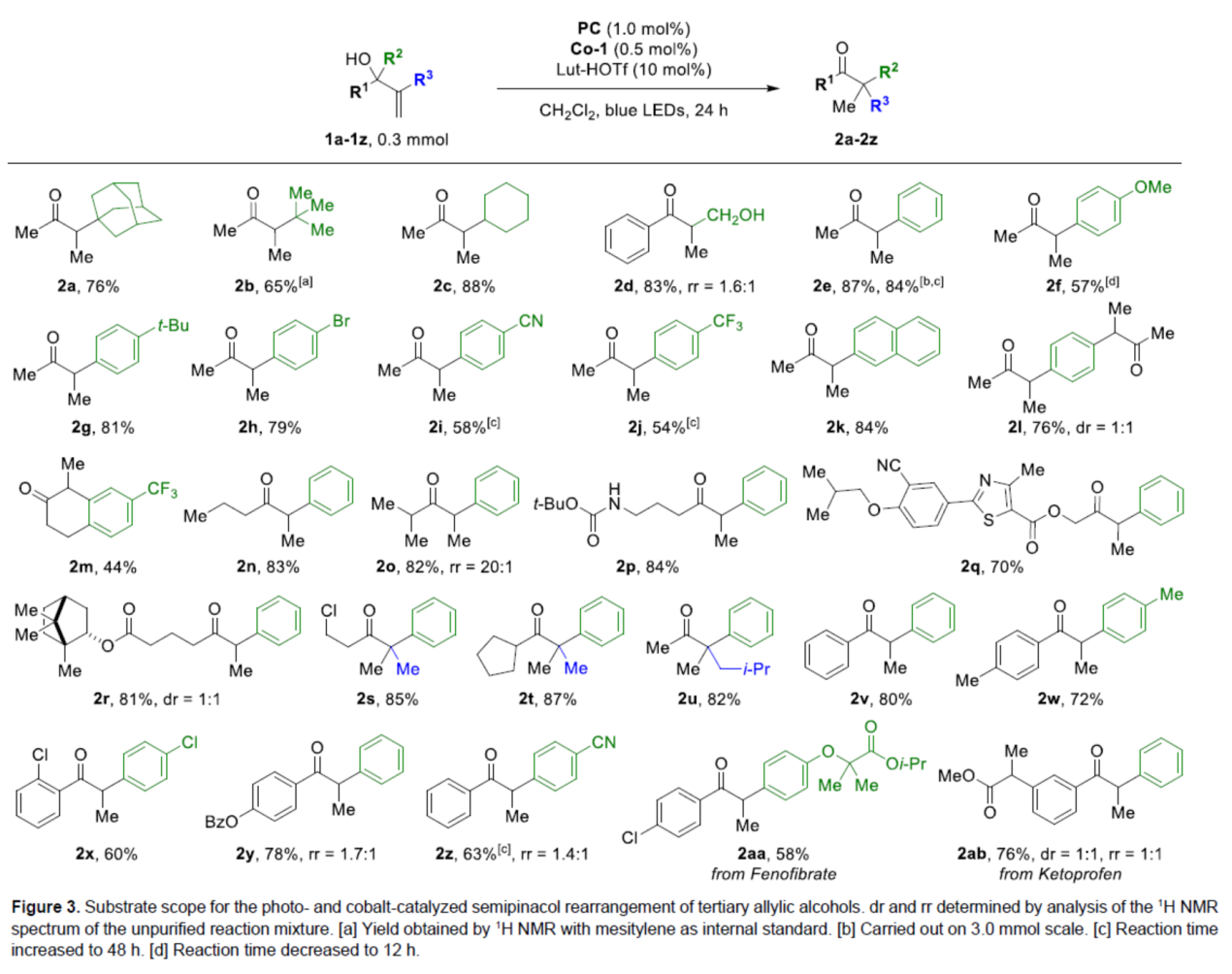
(圖片來源:Angew. Chem. Int. Ed.)
緊接著,作者對二級烯丙醇的底物范圍進行了研究(Figure 4)。研究表明,當使用3a或3b作為底物,可獲得兩種不同重排產物且不可分離的混合物4a(收率為77%,rr為1.7:1)和4b(收率為72%,rr為1:4.6)。其中,1,2-氫轉移優先于非取代芳烴的遷移(4a)。同時,遷移芳烴的電子差異影響其遷移能力(4b)。
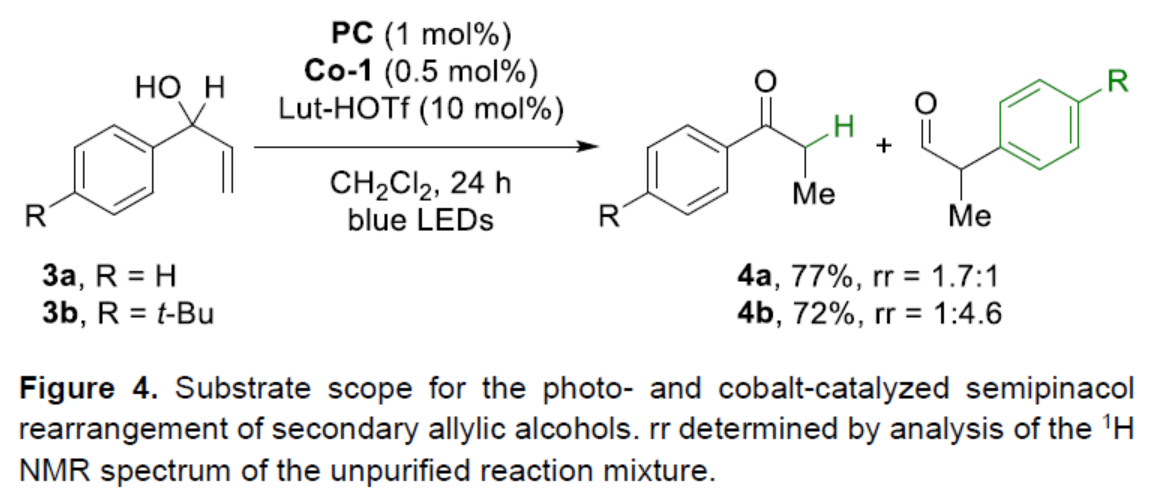
(圖片來源:Angew. Chem. Int. Ed.)
此外,作者還對反應機理進行了進一步的研究(Figure 5)。自由基抑制實驗結果表明,反應涉及自由基的機理。氘代實驗結果表明,醇是HAT步驟中轉移的質子源。基于上述的研究以及相關文獻的查閱,作者提出了一種合理的催化循環過程。首先,[CoII]-salen催化劑Co-1被激發態光催化劑PC*還原,生成陰離子[CoI]-配合物,并且可逆質子化生成共軛酸[CoIII]-H。隨后,[CoIII]-H與非活化的烯烴進行HAT,生成更穩定的二級[CoIII]-烷基配合物。二級[CoIII]-烷基配合物被PC·+氧化,生成[CoIV]-烷基配合物,該配合物與游離碳陽離子平衡。最后,在堿介導下,[CoIV]-烷基配合物進行半頻哪醇重排,生成目標產物并再生[CoII]-salen催化劑Co-1,已完成催化循環的過程。
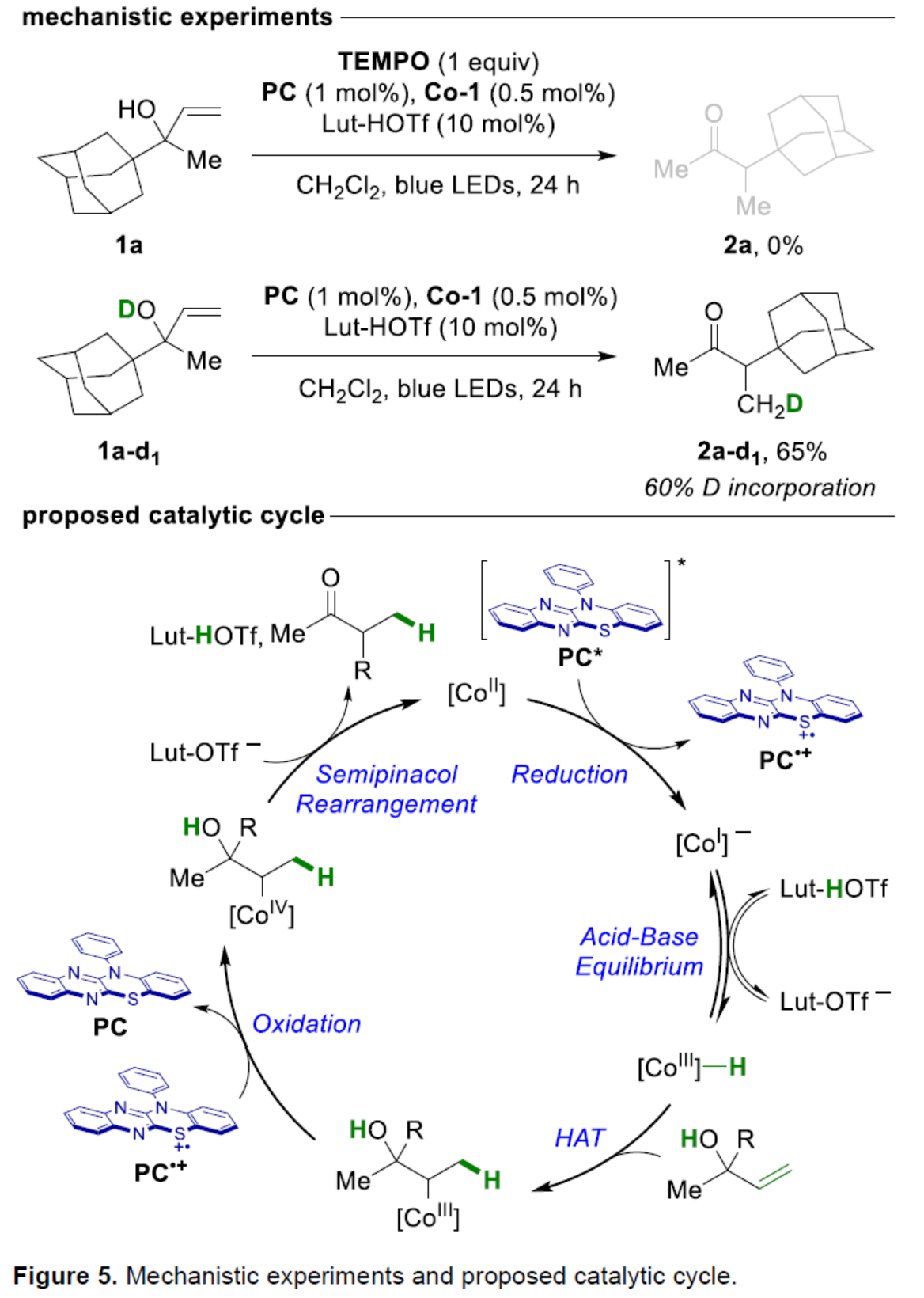
(圖片來源:Angew. Chem. Int. Ed.)
同時,作者還通過控制實驗對Br?nsted酸催化反應的差異性進行了研究(Figure 6)。研究結果表明,當使用Br?nsted酸時,質子化有兩種選擇。當質子化發生在醇上時,反應是快速的,生成氧鎓離子,其經脫水后生成烯丙基陽離子(路徑a)。當質子化發生在烯烴上時,反應速度慢,生成三級陽離子(路徑b)。相反,HAT化學能夠提供具有不同反應性的額外途徑來產生碳陽離子(路徑c)。
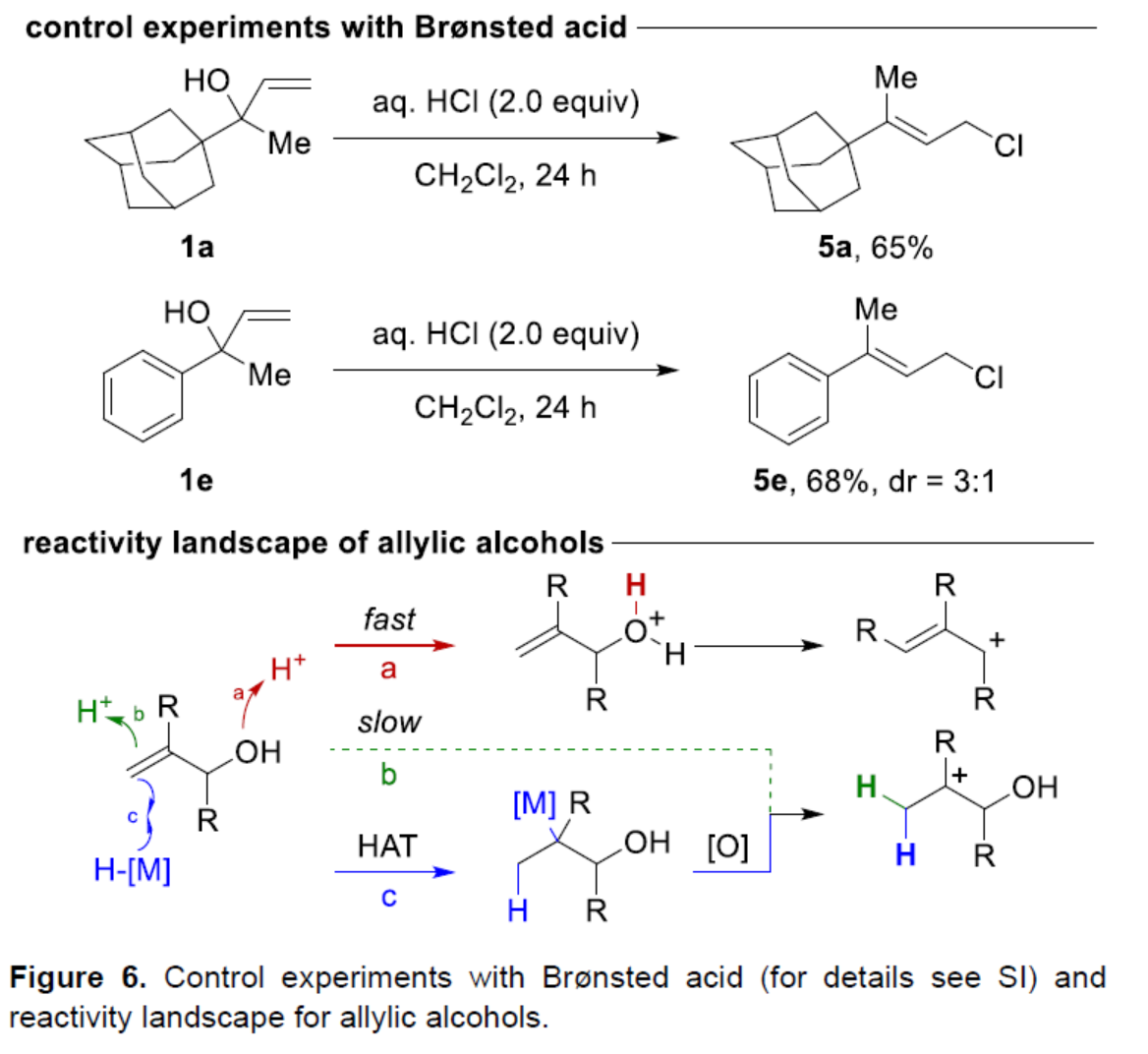
(圖片來源:Angew. Chem. Int. Ed.)
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn