

(圖片來源:J. Am. Chem. Soc.)
正文
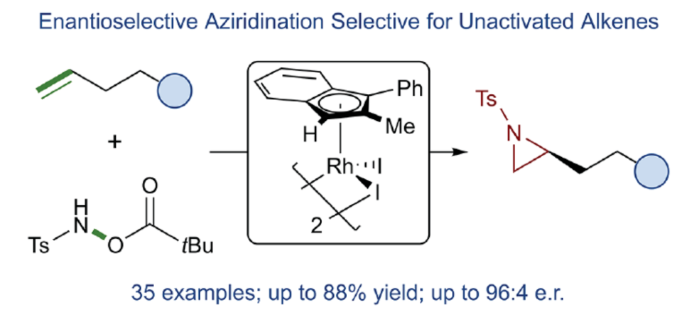
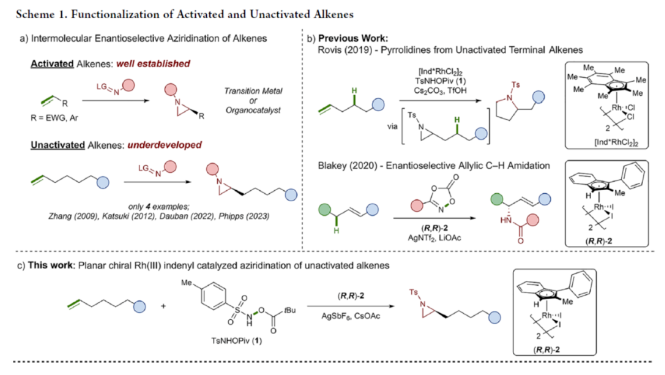
氮雜環丙烷是一種具有價值的張力三元含氮雜環。其立體選擇性合成可以通過三種不同的斷裂方式來實現:(1)手性鹵代胺或氨基醇的分子內縮合,(2)碳源到亞胺的立體選擇性加成,(3)氮賓等價物與烯烴的立體選擇性加成(最具吸引力)。目前,化學家們還開發了大量通過過渡金屬催化立體選擇性合成手性氮雜環丙烷的方法。然而,這些方法集中于活化烯烴(如苯乙烯和α,β-不飽和體系)的氮雜環丙烷化反應(Scheme 1a,top)。同時,具有烷基取代的非活化烯烴的立體選擇性氮雜環丙烷化反應仍然具有挑戰(Scheme 1a,bottom)。目前,僅只有四種方法實現了非活化烯烴的分子間對映選擇性氮雜環丙烷化反應(Chem. Commun. 2009, 4266;Chem. Commun.2012, 48, 7188; J. Am. Chem. Soc. 2022, 144, 17156;J. Am. Chem. Soc.2023, 145, 7516.)。然而,上述的方法對于非活化底物通常具有較低的產率和對映選擇性。2019年,Rovis課題組(J. Am. Chem. Soc. 2019, 141, 12536.)開發了一種Rh(III)-催化非活化末端烯烴的形式[4+1]環加成反應,合成了一系列吡咯烷的方法(Scheme 1b,top)。2020年,Blakey課題組(J. Am. Chem. Soc. 2020, 142, 13996.)設計一種用于區域與對映選擇性烯丙基C-H胺化的平面手性銠茚基催化劑(Scheme 1b,bottom)。受此啟發,韓國科學技術院Mu-Hyun Baik與美國埃默里大學Simon B. Blakey課題組報道了一種平面手性銠茚基催化劑促進非活化末端烯烴的對映選擇性氮雜環丙烷化反應,合成了一系列對映體富集的手性氮雜環丙烷衍生物(Scheme 1c)。 下載化學加APP到你手機,更加方便,更多收獲。
(圖片來源:J. Am. Chem. Soc.)
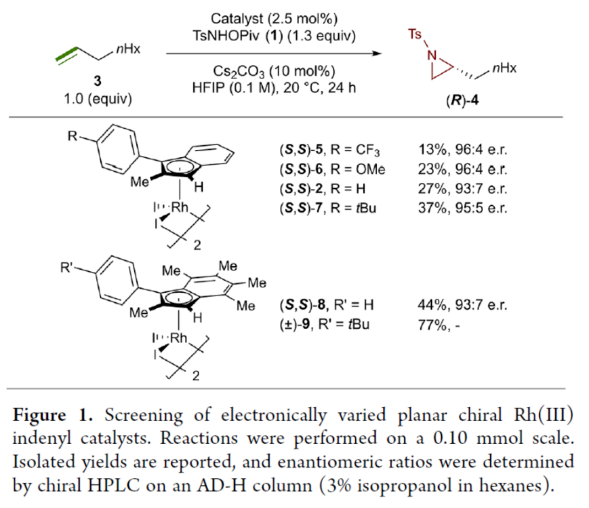
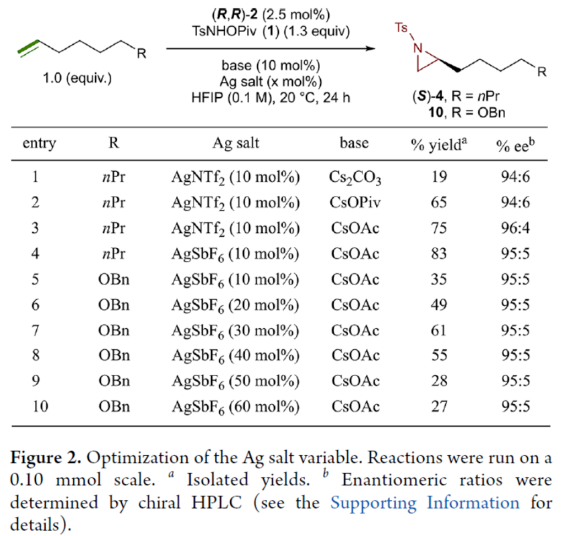
首先,作者對平面手性Rh(III)茚基催化劑(Figure 1)以及反應的條件進行了篩選(Figure 2)。篩選結果表明,當以1-壬烯作為底物,TsNHOPiv(1,1.3 equiv)作為氮源,(R,R)-2(2.5 mol %)作為催化劑,AgSbF6(10 mol %)作為銀鹽,CsOAc(10 mol %)作為堿,在HFIP溶劑中20 oC反應24 h,可以83%的收率得到產物(S)-4,e.r.為95:5。同時,當以芐基保護的5-己烯-1-醇為底物時,需將銀鹽的負載量提高至30 mol %,可以61%的收率得到產物10,e.r.為95:5。
(圖片來源:J. Am. Chem. Soc.)
(圖片來源:J. Am. Chem. Soc.)
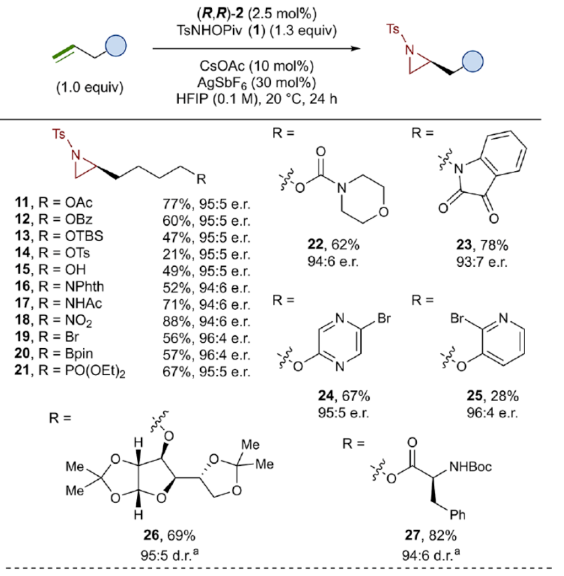
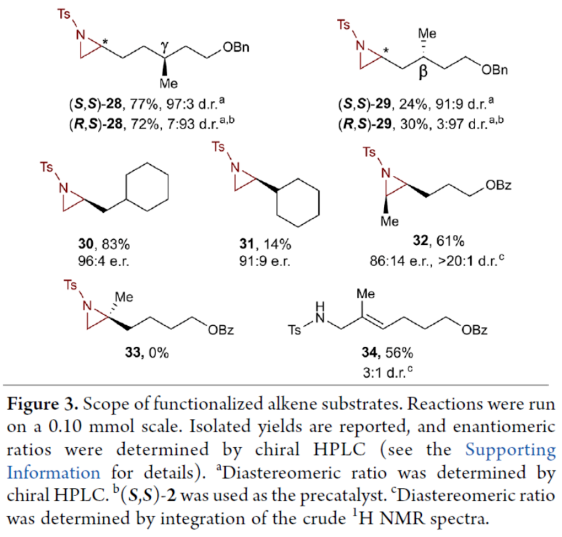
在獲得上述最佳反應條件后,作者對底物范圍進行了擴展(Figure 3)。首先,一系列不同取代的末端烯烴底物,均可順利進行反應,獲得相應的產物11-21,收率為21-88%,e.r.為93:7-96:4。其中,烷基鹵化物、硼酸酯和膦酸酯等活性的官能團,均與體系兼容。含有更為復雜取代的底物(如嗎啉氨基甲酸酯、靛藍、二嗪和吡啶),均為合適的底物,獲得相應的產物22-25,收率為28-78%,e.r.為93:7-96:4。受保護的D-呋喃葡萄糖和L-苯丙氨酸衍生的烯烴底物,也與體系兼容,獲得相應的產物26(收率為69%,d.r.為95:5)和27(收率為82%,d.r.為94:6)。其次,L-香茅醇衍生的烯烴,在使用兩種不同構型的催化劑時,可分別獲得相應的產物(S,S)-28(收率為77%,d.r.為97:3)和(R,S)-28(收率為72%,d.r.為7:93)。同時,將手性中心轉移至β-位時,可分別獲得相應的產物(S,S)-29(收率為24%,d.r.為91:9)和(R,S)-29(收率為30%,d.r.為3:97)。烯丙基環己烷和乙烯基環己烷,也是合適的底物,分別獲得相應的產物30(收率為83%,e.r.為96:4)和31(收率為14%,e.r.為91:9)。此外,Z-二取代的烯烴,可順利進行反應,獲得相應的產物32(收率為41%,e.r.為86:14,d.r.> 20:1)。然而,1,1-二取代烯烴未能有效的進行反應(如33),但可獲得末端烯丙基胺產物34(收率為56%,d.r.為 3:1)。
(圖片來源:J. Am. Chem. Soc.)
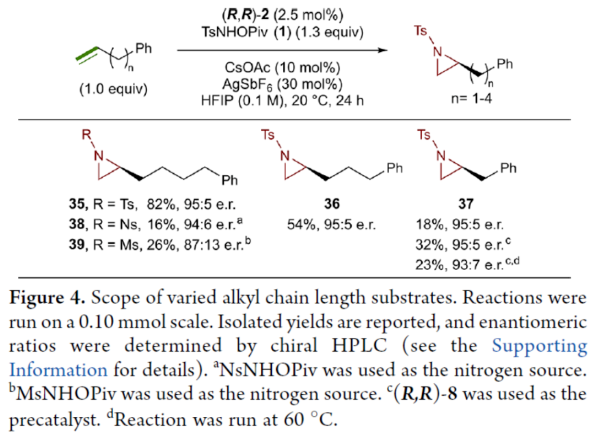
緊接著,作者研究了烷基鏈長度對反應的影響(Figure 4)。研究發現,碳鏈長度為4時不會影響反應(如35),但將碳鏈長度降為3或1時,收率明顯下降(如36和37)。值得注意的是,在碳鏈長度發生變化時,對映選擇性不受影響。同時,當使用NsNHOPiv與MsNHOPiv作為氮源時,反應的收率也出現明顯的下降,對映選擇性略有降低,如38和39。
(圖片來源:J. Am. Chem. Soc.)
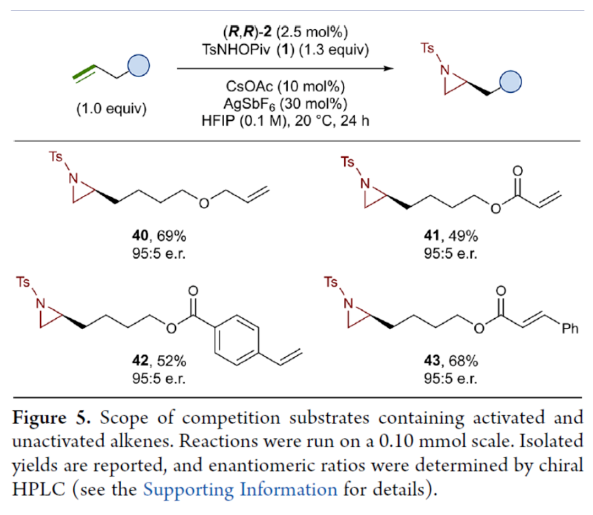
接下來,作者對同時含有活化與非活化的烯烴底物進行了競爭性反應,用于研究烯烴的電性對于反應的影響(Figure 5)。研究發現,氮雜環丙烷化僅發生在非活化的烯烴上,而活化的烯烴保持完整,從而表明在對映選擇性氮雜環丙烷化方法中具有全新的選擇性水平。
(圖片來源:J. Am. Chem. Soc.)
此外,作者提出了兩種合理的催化循環過程(Scheme 2)。第一種機理涉及酰胺的形成以及隨后的烯烴插入過程(黑色)。第二種機理涉及氮賓形成(藍色和綠色)。由于其不切實際的高能量需求,從而排除了烯烴直接進行協同金屬化-去質子化(CMD)的可能性。
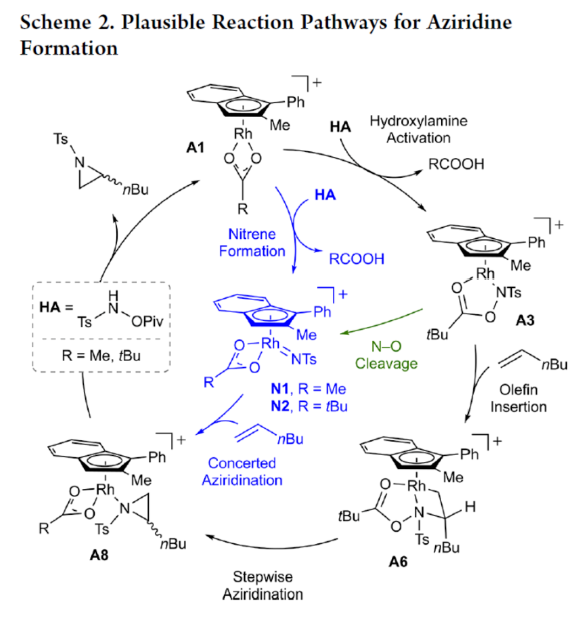
(圖片來源:J. Am. Chem. Soc.)
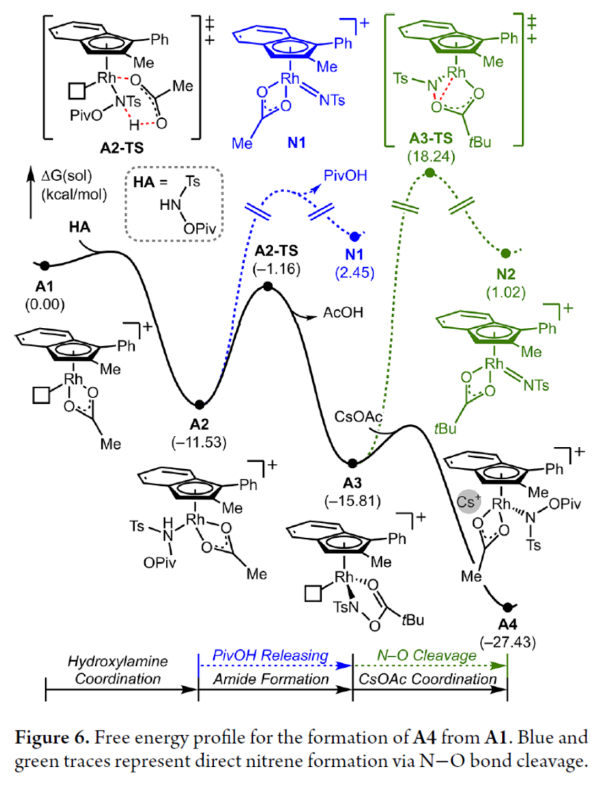
為了進一步證明上述機理的合理性,作者進行了相關的理論計算研究(Figures 6-8)。首先,羥胺HA與A1的配位生成18-電子的配合物A2。配合物A2經分子內去質子化,生成金屬-酰胺配合物A3,并釋放乙酸。配合物A3與堿基結合,生成銫-結合配合物A4。值得注意的是,在A4的形成過程中,兩個中間體A2和A3有可能形成氮賓中間體N1和N2。然而,由于其所需的高能量表明反應不是通過氮賓中間體進行的。由于A4是飽和狀態,它釋放CsOAc并生成16-電子配合物A3(Figure 6)。
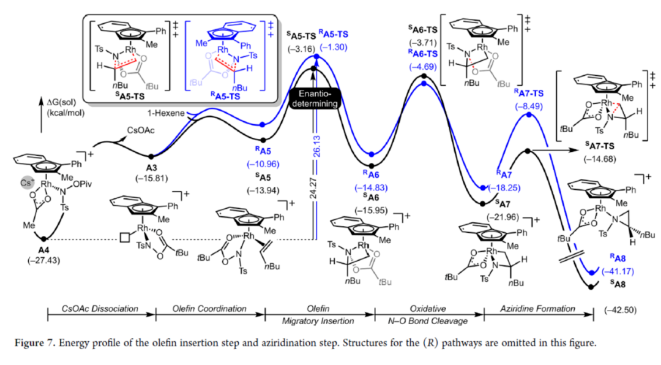
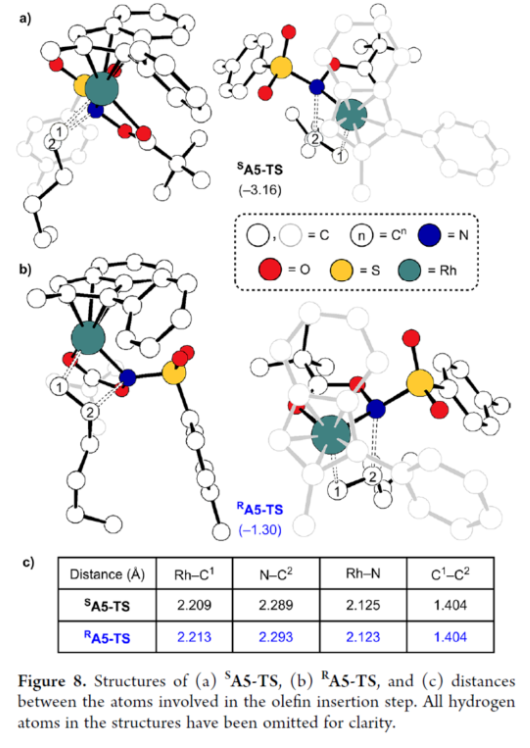
其次,配合物A3可與烯烴反應,生成配合物A6。由于A3的非對稱結構,它為烯烴提供了兩個不同的空位,這導致了對映選擇性的C?N鍵的形成(SA5和RA5)。同時,(S)-產物的收率比(R)-產物高19-24倍。并且,發現這種遷移插入(第一個C?N鍵的形成)在整個催化循環中具有最高的活化能,它可能同時作為對映選擇性和速率決定步驟(Figure 7)。值得注意的是,反應的立體選擇性源于底物、磺酰胺和催化劑茚基配體上的苯基取代基之間的相互作用。同時,SA5-TS和RA5-TS之間能量差的主要來自空間相互作用(Figure 8a)。
隨后,遷移插入后,中間體A6經氧化N?O鍵斷裂,生成中間體A7。利用A7中的缺電子環境作為驅動力,SA7-TS和RA7-TS分別容易形成還原性的C?N鍵,生成中間體A8。最后,中間體A8通過解離后,生成目標產物,并再生活性催化劑A1,從而完成催化循環的過程。
(圖片來源:J. Am. Chem. Soc.)
(圖片來源:J. Am. Chem. Soc.)
(圖片來源:J. Am. Chem. Soc.)
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn