

(圖片來源:J. Am. Chem. Soc.)
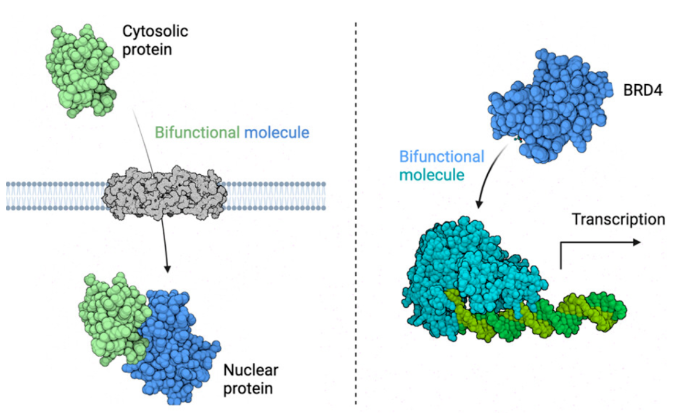
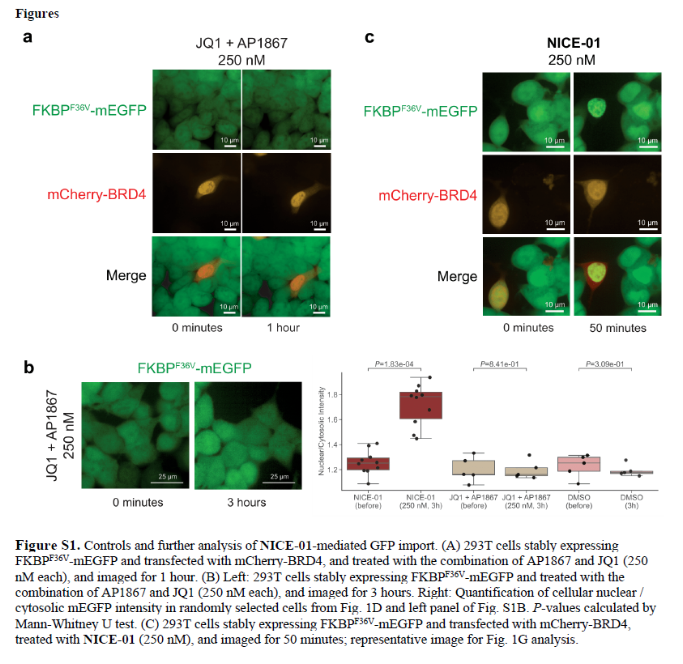
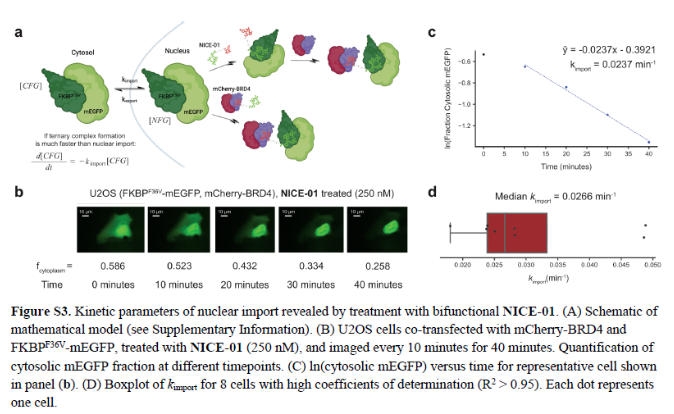
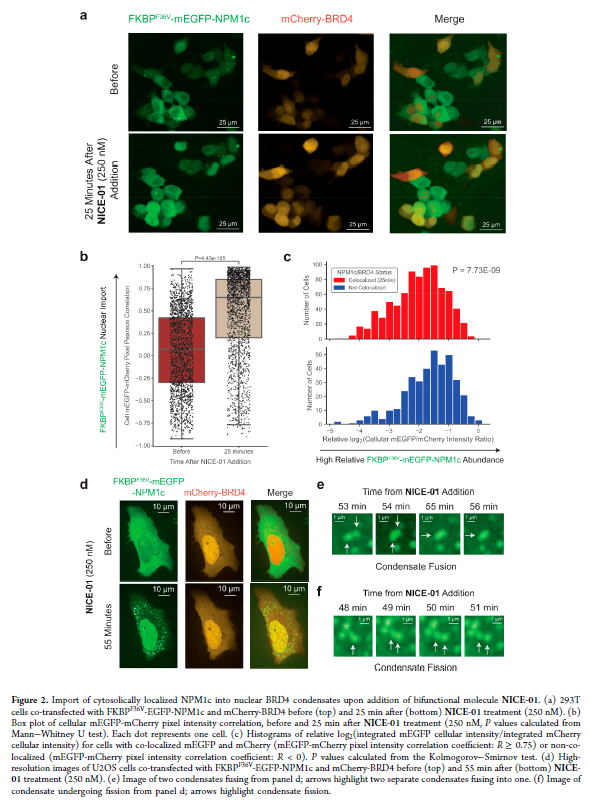
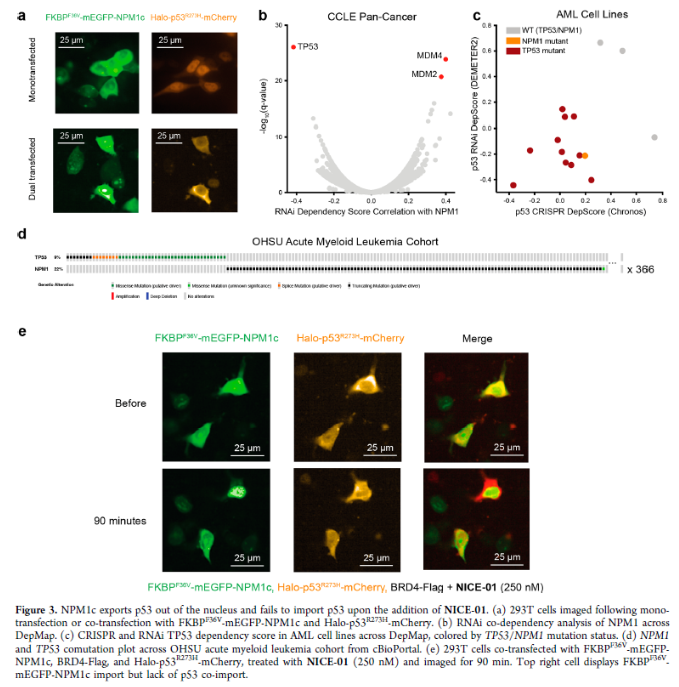
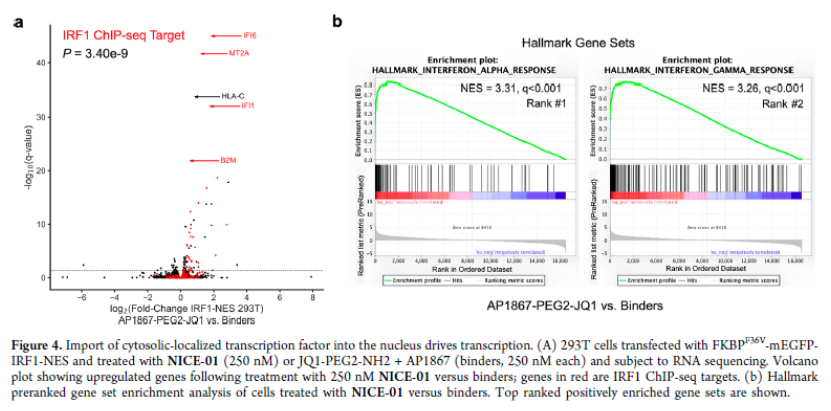
正文 細胞被劃分為不同的隔間,以調節信息流并聚集生物分子。在真核細胞中,有兩個主要的區室:細胞質和細胞核。最近的研究進一步強調了蛋白質空間定位的重要性,蛋白質在細胞中的異常定位是各種疾病發展的關鍵因素。為了更好地理解并潛在地操縱蛋白質定位以治療各種相關疾病,作者設計了一種雙功能分子來達到上述目的。下載化學加APP到你手機,更加方便,更多收獲。 首先,作者假設化學誘導靶蛋白與組成性核蛋白的接近將實現靶蛋白核定位(圖1a)。為了證實這一點,作者選取了一種豐富的、核定位的且具有經過充分驗證的、可以功能化的小分子結合劑的蛋白質——BET溴結構域蛋白,并以JQ1為其配體,合成了由JQ1和AP1867組成的雙功能分子(NICE-01,圖1b),AP1867用來結合FKBPF36V。隨后作者發現,在FKBPF36V-mEGFP和mCherry-BRD4共轉染的細胞中添加NICE-01(200 nM,40分鐘;圖1c)后FKBPF36V-EGFP快速易位到細胞核。然后,作者假設內源性含BET的蛋白質可以用作核導入的“載體”。在穩定表達FKBPF36V-mEGFP的細胞中,NICE-01(250 nM,3小時)可以在細胞核中富集mEGFP(圖1d和圖S1)。 雙功能化合物的一個決定性特征是觀察到“鉤效應”(hook effect)。在缺乏外源mCherry-BRD4的細胞中,10 μM NICE-01不能誘導FKBPF36V-mEGFP的入核。然而,在該劑量下轉染mCherry-BRD4能夠讓入核發生(圖1f)。這與理論一致,即在給定濃度的化合物下,三元復合物形成的減少可以通過進一步添加蛋白質來緩解。 (圖片來源:J. Am. Chem. Soc.) 隨后,作者還發現,三元復合物組分的化學計量是影響核導入的關鍵。當依賴于內源性BET蛋白時,FKBPF36V-mEGFP的入核程度較弱,缺乏mEGFP胞質排斥(圖1g和圖S1),這可能與通過瞬時轉染獲得的蛋白水平異常高于內源性蛋白水平有關。這一結果表明,核導入的細胞特異性一部分表現在核定位載體表達的數量差異。另外,配體親和力似乎也很重要。 (圖片來源:J. Am. Chem. Soc.) 接下來,作者假設可以使用化合物處理后觀察到的FKBPF36V-mEGFP濃度的變化來計算蛋白質在核膜中擴散的動力學參數并構建了一個核導入步驟的模型(圖S3)。對單個細胞的胞質FKBPF36V-mEGFP的部分進行定量。在短的初始期后,核輸入相對于細胞質中的FKBPF36V-mEGFP部分顯示出一級動力學(圖S3)。這個估算的結果接近HeLa細胞中麥芽糖結合蛋白的被動輸入速率。這些數據表明,結合BRD4的雙功能化合物誘導靶蛋白封閉在核內。 (圖片來源:J. Am. Chem. Soc.) 先前的研究表明,將細胞質突變體NPM1c重新定位到細胞核中可以減少HOX基因的表達,從而誘導白血病分化和細胞死亡。用FKBPF36V-mEGFP-NPM1c和mCherry-BRD4共轉染的細胞在用NICE-01處理后幾分鐘內顯示FKBPF36V-mEGFP-NPM1c快速重新定位到細胞核中(圖2a)。 (圖片來源:J. Am. Chem. Soc.) 有趣的是,并不是所有的細胞對化合物處理都表現出一致的反應。作者分析了導入程度不同的細胞的FKBPF36V-EGFP-NPM1c與mCherry-BRD4的比率(圖2c)。數據表明,三元復合物組分的化學計量可以影響對雙功能化合物的表型反應,并可以解釋觀察到的單細胞表型異質性。 作者用雙功能化合物處理NPM1c和BRD4共轉染的U2OS細胞,然后每1分鐘進行一次高分辨率顯微鏡成像,證實了胞質和核仁凝聚物中的NPM1c移動到BRD4凝聚物中(圖2d)。作者還注意到FKBPF36V-mEGFP摻入核凝聚物中,即使它們依賴于內源性含BET的蛋白質入核(圖1e)。這些發現表明,鄰近誘導分子可以針對性地改變凝聚物的組成。 隨后,作者假設p53能夠作為核載體來誘導NPM1c在細胞核中的定位。用FKBPF36V-mEGFP-NPM1c和Halo-p53R273H-mCherry轉染293T細胞,令人驚訝的是, Halo-p53R273H-mCherri僅在與FKBPF36V-mEGFP-NPM1c共轉染時定位于細胞質(圖3a)。 (圖片來源:J. Am. Chem. Soc.) 細胞溶質p53與DNA在物理上分離,其大部分腫瘤抑制活性可能受到抑制。因此,NPM1c介導的p53出核可能對突變的致癌性至關重要,這一點尚不清楚。作者發現NICE-01并不能在表達BRD4 Flag和FKBPF36V-mEGFP-NPM1c的293T細胞中重新定位Halo-p53R273H-mCherry,這表明p53并不總是以一定的共定位方式與NPM1c在物理上連接(圖3e)。 (圖片來源:J. Am. Chem. Soc.) 最后,作者認為NICE-01可以誘導轉錄因子IRF1的核導入和轉錄激活。在不存在雙功能化合物的情況下,FKBPF36V-mEGFP-IRF1-NES從細胞核中移出(圖S4)。當用NICE-01(250 nM)處理時,在共表達mCherry-BRD4和FKBPF36V-mEGFP-IRF1-NES的細胞中可以觀察到mEGFP快速導入(<20分鐘)。然而,在沒有外源性BRD4的情況下,作者無法通過光學顯微鏡檢測到FKBPF36V-mEGFP-IRF1-NES的輸入,這可能是因為與BRD4相比,FKBPF36V-mEGFP-IRF1-NES大大過量(圖S4)。在用NICE-01(250 nM)處理并表達FKBPF36V-mEGFP-IRF1-NES的293T細胞中,RNA-seq顯著上調IRF1-ChIP-seq靶點(圖4a)。通過基因集富集分析,作者還觀察到標志性干擾素反應基因集的顯著陽性富集(圖4b)。這些結果表明化學誘導BRD4定位于胞質轉錄因子足以誘導其靶基因的表達。 (圖片來源:J. Am. Chem. Soc.) 總結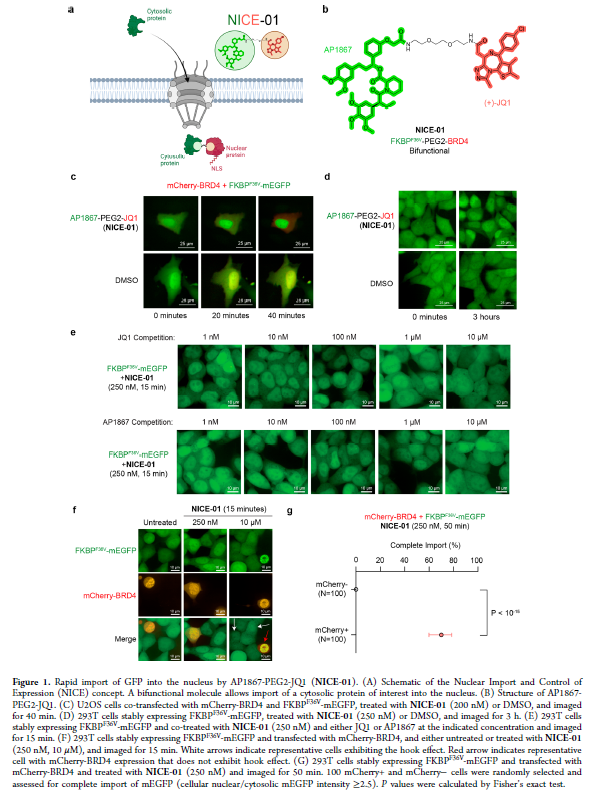

聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn