- 首頁
- 資訊
Science:光促進,非活化烯烴的分子間環丙烷化反應
來源:化學加原創 2023-08-10
導讀:近日,美國賓夕法尼亞州立大學(The Pennsylvania State University) Ramesh Giri課題組報道了簡單的光氧化還原催化體系,高效實現了非活化烯烴與活性亞甲基化合物的分子間環丙烷化反應。該反應在空氣或氧氣存在下進行,由藍光激發的光氧化還原催化劑以及碘(作為碘分子添加或由烷基碘原位生成)作為輔助催化劑共同催化下完成的。機理研究表明光敏O2在碳自由基的生成過程中起著至關重要的作用。相關成果發表在Science上,文章鏈接DOI: 10.1126/science.adg3209。
(圖片來源:Science)
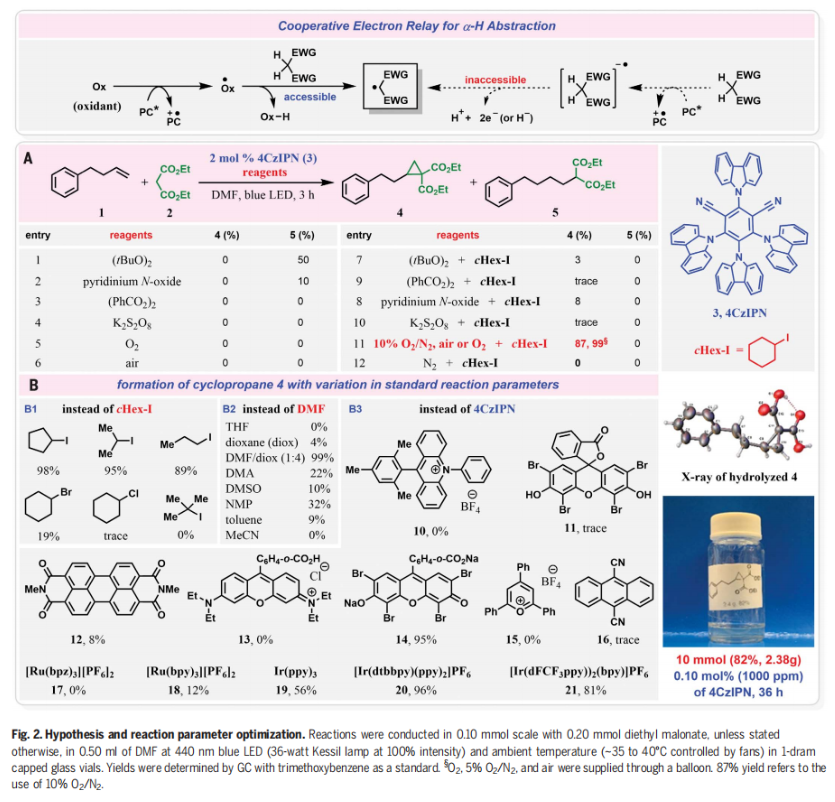
環丙烷是合成復雜分子和天然產物的重要中間體,此外,環丙基也是生物活性分子和天然產物的關鍵基團(Fig. 1)。因此,環丙烷化反應是有機合成中研究最多的構建張力環的反應之一。然而,全碳三元環也是最難制造的環之一,因為其存在較大的張力會使環非常不穩定,從而使其在反應過程中極容易開環。盡管卡賓插入烯烴、Simmons-Smith反應、Johnson-Corey-Chaykovsky反應、Kulinkovich反應等反應過程可以實現環丙烷骨架的構建,但是均在某些方面存在一定的缺陷和局限性。因此,利用簡單易得的起始原料實現非活化烯烴的催化環丙烷化反應具有重要意義,且具有一定的挑戰。最近,美國賓夕法尼亞州立大學Ramesh Giri課題組發展了簡單的光氧化還原催化體系,高效實現了非活化烯烴與活性亞甲基化合物的分子間環丙烷化反應。該反應在空氣或氧氣存在下進行,由藍光激發的光氧化還原催化劑或者在碘作為輔助催化劑下完成的(Fig. 2)。下載化學加APP到你手機,更加方便,更多收獲。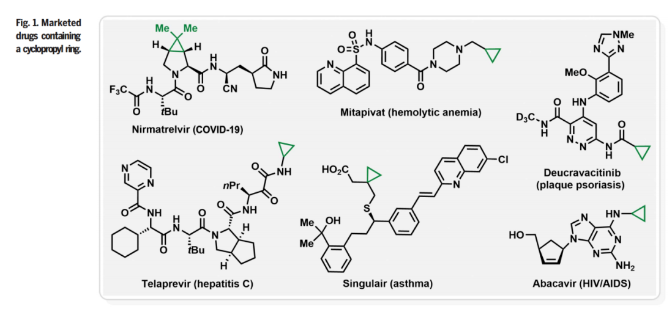
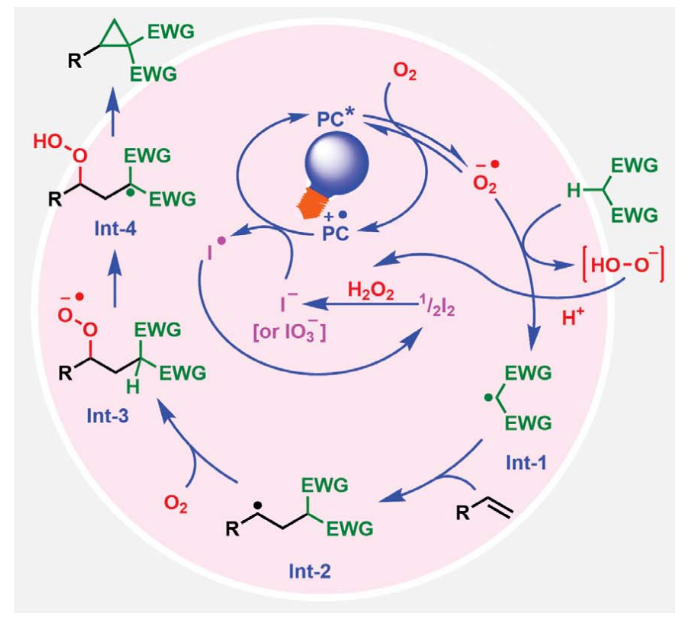
首先,作者選用4-苯基丁烯1和丙二酸二乙酯2作為模板底物進行反應探索(Fig. 2)。通過一系列反應參數篩選,作者發現當使用1(0.1 mmol), 2 (0.2 mmol), 4-CzIPN (2 mol%), cHex-I (0.1 mmol), 在DMF (5.0 mL)中,440 nm藍色LED照射下,在氧氣氛圍下室溫(35-40 oC)反應3小時可以以99%的GC產率得到環丙烷化產物4,且產物結構通過X-射線單晶衍射得到了驗證。在條件優化過程中,作者得到了如下關鍵信息:1)除了cHex-I之外,其它的烷基碘化物如正丁基碘、異丁基碘和環戊基碘等均可實現該轉化。但烷基氯化物和烷基溴化物對反應無效;2)反應在極性溶劑DMF作溶劑時最有效,在其它極性溶劑和中等極性溶劑中反應效果欠佳;3)在氮氣氣氛下以及不存在cHex-I時反應不發生;4)當在10% O2/N2氣氛下,小量反應(0.1 mmol)時同樣高效(99%),但大量反應(10 mmol)時產率有所降低(82%)。隨后,作者對此轉化的反應機理進行了考察(Fig. 3)。通過對PC(光催化劑)、烷基碘和4-苯基丁烯的DMF溶液進行紫外-可見(UV-Vis)和熒光光譜分析表明,烷基碘與PC和烯烴均沒有相互作用。在標準催化條件下,作者通過與十二烷基碘和十六烷基碘化物進行反應,證實了反應中生成了甲酸烷基酯(22, 69%; 23, 72%)(Fig. 3A)。由于反應溶液在反應過程中通常會變成紅棕色,作者進一步用紫外可見光譜分析了反應混合物,并證實了I2的產生(Fig. 3B)。這些實驗表明,烷基自由基在催化轉化過程中并不參與PC自由基陽離子的還原。更確切地說,是由I2的水解或氧化所產生的I?或IO3?來提供所需的電子來實現PC自由基陽離子中間體的還原。基于上述實驗結果以及一系列控制實驗的結果(Fig. 3D),作者提出了此環丙烷化反應可能的反應機理(Fig. 3C)。首先,氧氣被光激發的光催化劑還原得到超氧離子O2??,并攫取活性亞甲基化合物的α-H形成α-C自由基Int-1;隨后,α-C自由基中間體Int-1與烯烴發生自由基加成形成二級碳自由基Int-2,并與氧氣反應形成過氧自由基陰離子Int-3;接下來,過氧自由基陰離子Int-3攫取分子內的α-H形成α-C自由基Int-4,并與過氧化氫經歷1,3-取代得到環丙基產物。此外,作者通過開關燈實驗得出產物必須在藍光照射下才能形成,由此排除了自由基鏈式機理的可能性(Fig. 3E)。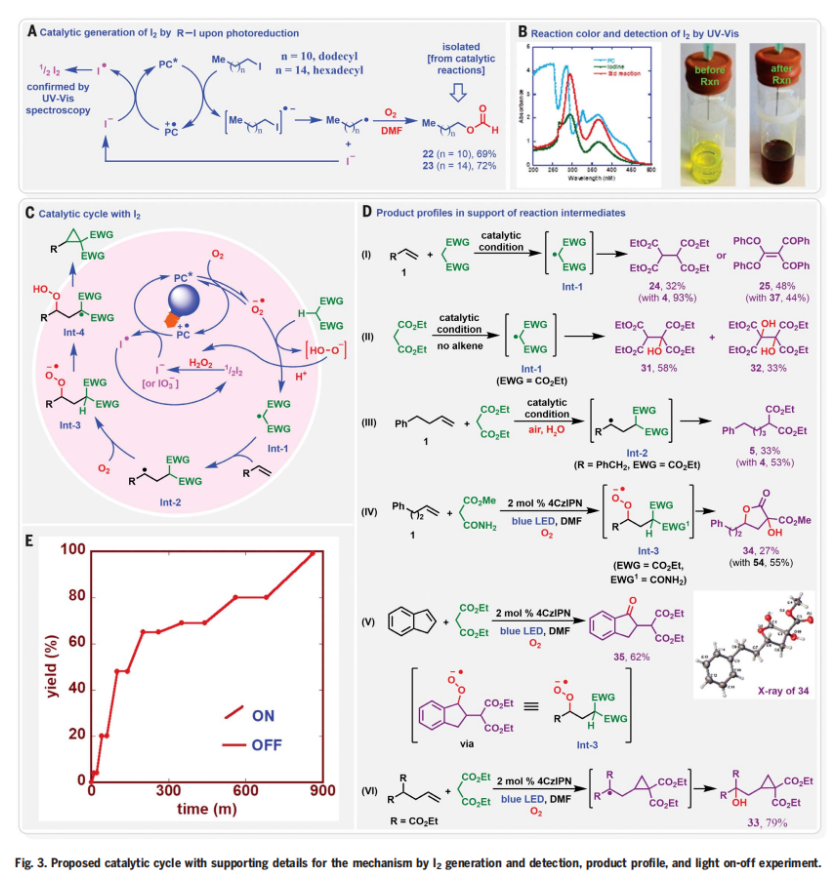 為了進一步證實I2的作用,作者在標準條件下使用5 mol% I2來替代cHex-I,可以以3小時分別以99%(O2氛圍下),89%(空氣氛圍下)和83%(10% O2/N2氛圍下)的產率得到環丙烷化產物4(Fig. 4A)。分子內競爭實驗表明反應中并不涉及到卡賓中間體的形成(Fig. 4B)。1,3-SN2取代的環丙烷化反應通常需要堿來實現去質子化從而生成親核碳試劑。相反的是,在目前的反應條件下,堿對環丙烷化反應是不利的(Fig. 4C)。在沒有烯烴存在的催化條件下,使用0.5當量的I2與丙二酸二乙酯進行對照實驗,并沒有觀察到α-碘和α,α-二碘化產物的生成,且未反應的丙二酸二乙酯以75%的收率回收(Fig. 4D)。當使用α-碘代丙二酸二乙酯作為還原劑時并沒有得到產物4,而以77%的產率觀察到了1,2-碘甲酰化產物(Fig. 4E)。當使用1,3-二酮在碘存在下,不加烯烴時可以以31%的產率得到α-碘代二酮以及14%的產率得到1,2,3-三酮,并以48%的收率回收了1,3-二酮(Fig. 4F)。然而,當使用α-碘代二酮或α-碘代二酮和α,α-二碘代二酮混合(2:3)在標準條件下反應時,作者均未觀察到環丙基化產物4的生成,而是觀察到了1,2,3-三酮和1,2-碘甲酰化產物。由此進一步證實了α-碘代二酮和α,α-二碘代二酮中間體并不能得到環丙基化產物(Fig. 4G,4H)。上述實驗清晰的表明了α-碘代二酮和α,α-二碘代二酮既不是反應的底物,也不是反應的中間體。反應最有可能是通過光激發,氧氣介導,PC*/I2-催化的反應路徑發生的。其中氧氣可以促使丙二酸酯α-C自由基的形成并捕獲二級碳自由基完成關環。
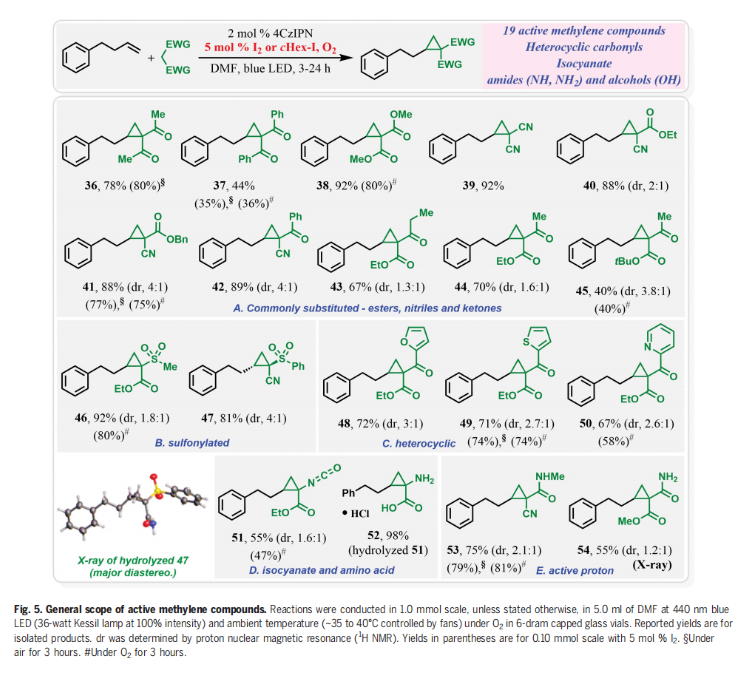
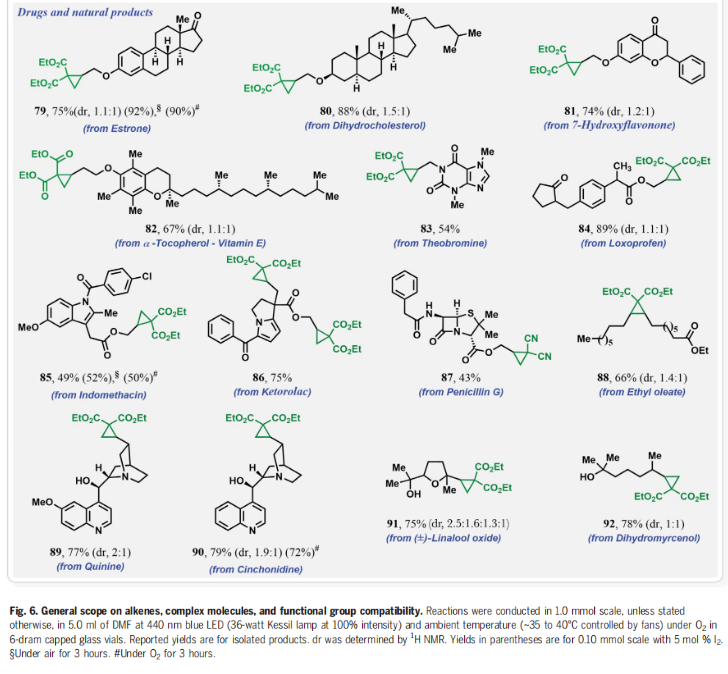
為了進一步證實I2的作用,作者在標準條件下使用5 mol% I2來替代cHex-I,可以以3小時分別以99%(O2氛圍下),89%(空氣氛圍下)和83%(10% O2/N2氛圍下)的產率得到環丙烷化產物4(Fig. 4A)。分子內競爭實驗表明反應中并不涉及到卡賓中間體的形成(Fig. 4B)。1,3-SN2取代的環丙烷化反應通常需要堿來實現去質子化從而生成親核碳試劑。相反的是,在目前的反應條件下,堿對環丙烷化反應是不利的(Fig. 4C)。在沒有烯烴存在的催化條件下,使用0.5當量的I2與丙二酸二乙酯進行對照實驗,并沒有觀察到α-碘和α,α-二碘化產物的生成,且未反應的丙二酸二乙酯以75%的收率回收(Fig. 4D)。當使用α-碘代丙二酸二乙酯作為還原劑時并沒有得到產物4,而以77%的產率觀察到了1,2-碘甲酰化產物(Fig. 4E)。當使用1,3-二酮在碘存在下,不加烯烴時可以以31%的產率得到α-碘代二酮以及14%的產率得到1,2,3-三酮,并以48%的收率回收了1,3-二酮(Fig. 4F)。然而,當使用α-碘代二酮或α-碘代二酮和α,α-二碘代二酮混合(2:3)在標準條件下反應時,作者均未觀察到環丙基化產物4的生成,而是觀察到了1,2,3-三酮和1,2-碘甲酰化產物。由此進一步證實了α-碘代二酮和α,α-二碘代二酮中間體并不能得到環丙基化產物(Fig. 4G,4H)。上述實驗清晰的表明了α-碘代二酮和α,α-二碘代二酮既不是反應的底物,也不是反應的中間體。反應最有可能是通過光激發,氧氣介導,PC*/I2-催化的反應路徑發生的。其中氧氣可以促使丙二酸酯α-C自由基的形成并捕獲二級碳自由基完成關環。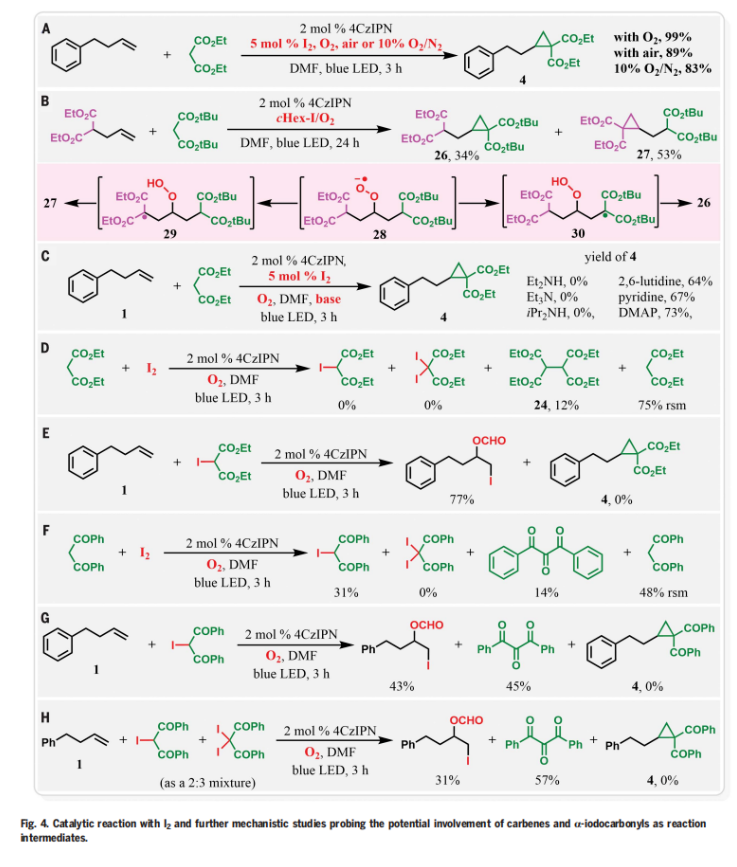 接下來,作者對此轉化的底物范圍進行了考察(Fig. 5)(Fig. 6)。實驗結果表明,不同取代的活性亞甲基化合物,包括二酮類、丙二腈類、氰酯類、氰酮類、酮酯類、磺酰基取代的酯類、磺酰基取代的氰類等均可兼容,以40-98%的產率得到相應的環丙烷化產物36-54(Fig. 5)。此外,不同取代的端炔、內炔均可順利參與反應,以48-95%的產率得到產物55-78。遺憾的是,苯乙烯和共軛二烯烴不能參與此轉化。值得注意的是,含有活性分子骨架衍生物的烯烴類底物,如estrone、cholesterol、cholesterol、α-tocopherol、theobromine、loxoprofen、indomethacin、ketorolac、penicillin G、quinine、cinchonidine等均可順利實現轉化,以43-92%的產率得到相應的環丙基化產物79-92,由此證明了此轉化的實用性,并為這些生物活性分子的后期修飾提供了新的途徑(Fig. 6)。
接下來,作者對此轉化的底物范圍進行了考察(Fig. 5)(Fig. 6)。實驗結果表明,不同取代的活性亞甲基化合物,包括二酮類、丙二腈類、氰酯類、氰酮類、酮酯類、磺酰基取代的酯類、磺酰基取代的氰類等均可兼容,以40-98%的產率得到相應的環丙烷化產物36-54(Fig. 5)。此外,不同取代的端炔、內炔均可順利參與反應,以48-95%的產率得到產物55-78。遺憾的是,苯乙烯和共軛二烯烴不能參與此轉化。值得注意的是,含有活性分子骨架衍生物的烯烴類底物,如estrone、cholesterol、cholesterol、α-tocopherol、theobromine、loxoprofen、indomethacin、ketorolac、penicillin G、quinine、cinchonidine等均可順利實現轉化,以43-92%的產率得到相應的環丙基化產物79-92,由此證明了此轉化的實用性,并為這些生物活性分子的后期修飾提供了新的途徑(Fig. 6)。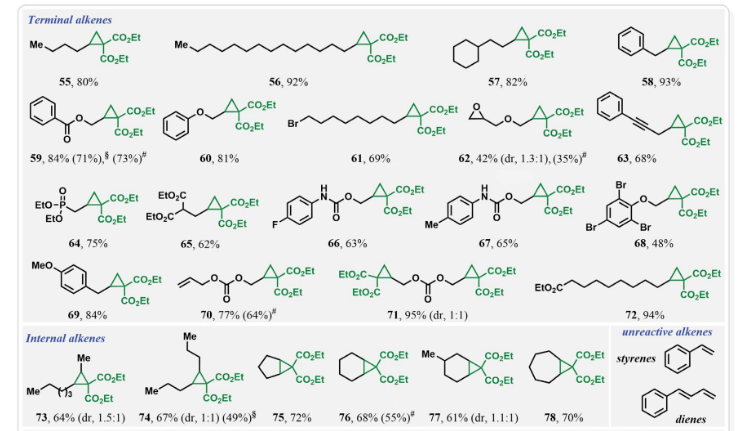
Ramesh Giri課題組發展了簡單的光/碘共催化反應體系,高效實現了非活化烯烴與活性亞甲基化合物的分子間環丙烷化反應。其中,反應中的碘可以來源于碘分子的添加或由烷基碘原位生成。此轉化具有良好的底物適用性和官能團兼容性,并可以實現一系列生物活性分子衍生物的環丙烷化,展現出了良好的實用性。機理研究表明光敏O2在碳自由基的生成過程中起著至關重要的作用。此反應的發展為非活化烯烴的催化環丙烷化提供了新的途徑。 文獻詳情:
Dhruba P. Poudel, Amrit Pokhrel?, Raj Kumar Tak?, Majji Shankar, Ramesh Giri*. Photosensitized O2 enables intermolecular alkene cyclopropanation by active methylene compounds. Science, 2023, 381, 545-553. https://www.science.org/doi/10.1126/science.adg3209.
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn