



(圖片來源:J. Am. Chem. Soc.)
正文
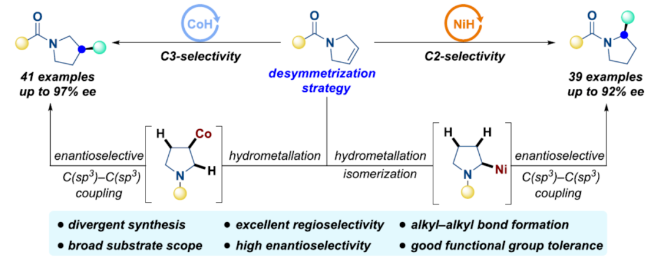
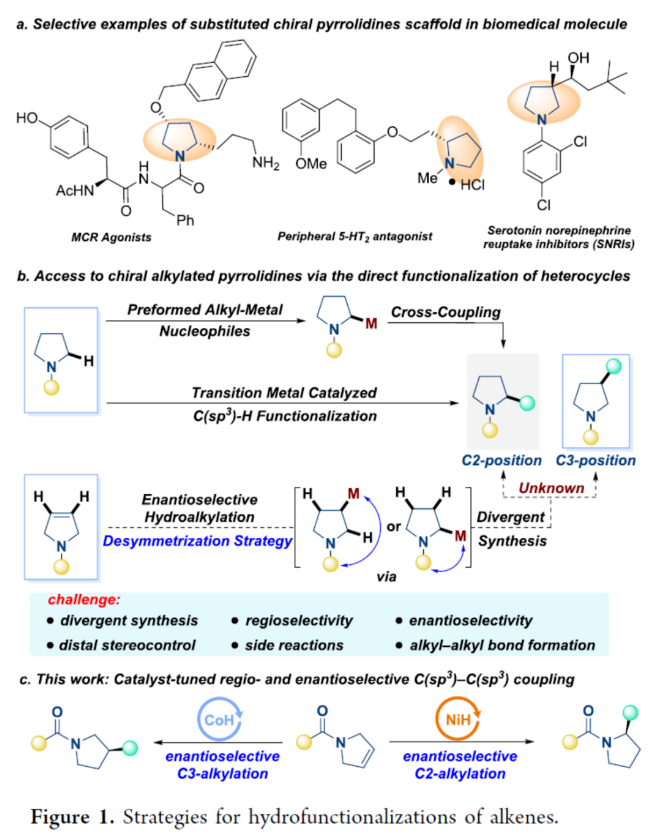
手性2-/3-烷基取代的吡咯烷衍生物廣泛存在于藥物、生物活性分子以及不對稱催化領域中的手性助劑中(Figure 1a)。然而,對于手性2-/3-烷基取代吡咯烷衍生物的高效構建,一直是不對稱合成領域重要的研究方向。近年來,雜環(huán)化合物的直接官能團化反應在合成界引起了極大的關注。目前,化學家們開發(fā)了多種構建不同取代吡咯烷衍生物的方法,包括預生成化學計量有機金屬試劑的交叉偶聯(lián)反應、飽和N-雜環(huán)化合物在特定和預官能團化位點的直接C(sp3)-H鍵官能團化反應等(Figure 1b)。然而,上述的方法仍存在適用性不夠好、立體選擇性難以控制等問題。近年來,鎳或鈷催化的對映選擇性還原加氫官能團化已成為手性C-C鍵構建的一種非常有效的策略,通過該策略從簡單易得的環(huán)狀內烯烴出發(fā)來合成不同取代的手性吡咯烷類化合物是最直接有效的方法,然而,非活化環(huán)狀內烯烴的不對稱氫官能團化仍然存在極大的挑戰(zhàn)。2019年,胡喜樂教授課題組(Angew. Chem., Int. Ed. 2019, 58, 18519.)報道了一種配體控制3-吡咯啉的區(qū)域發(fā)散性加氫烷基化反應,但以外消旋的形式進行。近日,西北工業(yè)大學榮子強課題組報道了一種催化劑(Ni-H或Co-H)調節(jié)3-吡咯啉衍生物與烷基碘的區(qū)域和對映選擇性加氫烷基化反應,合成了一系列手性C2-和C3-烷基化吡咯烷衍生物(Figure 1c)。下載化學加APP到你手機,更加方便,更多收獲。
(圖片來源:J. Am. Chem. Soc.)
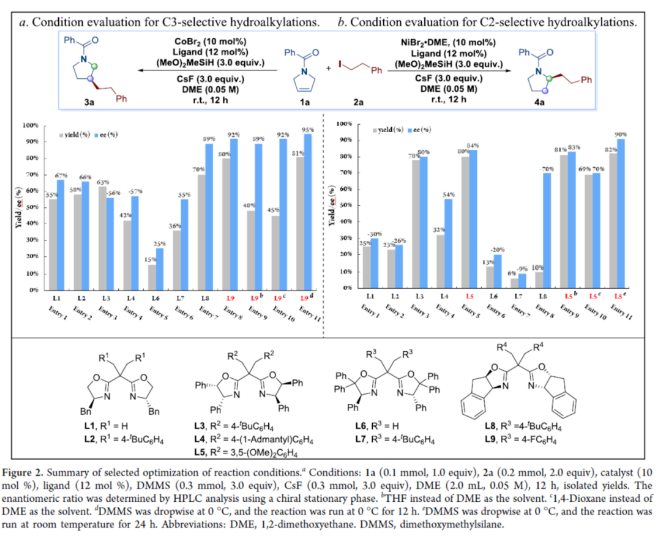
首先,作者以(2,5-二氫-1H-吡咯-1-基)苯基甲酮1a與2-碘代乙基苯2a作為模型底物,進行了相關偶聯(lián)反應條件的篩選(Figure 2)。當以CoBr2(10 mol %)作為催化劑,L9(12 mol %)作為配體,DMMS(3.0 equiv)作為氫化物源,CsF(3.0 equiv)作為堿,在DME溶劑中0 oC反應12 h,可以81%的收率和95%ee得到C3-烷基化產物3a。當以NiBr2?DME(10 mol %)作為催化劑,L5(12 mol %)作為配體,DMMS(3.0 equiv)作為氫化物源,CsF(3.0 equiv)作為堿,在DME溶劑中室溫下反應24 h,可以82%的收率和90%ee得到C2-烷基化產物4a。
(圖片來源:J. Am. Chem. Soc.)
在獲得上述最佳反應條件后,作者對烷基碘底物的范圍進行了擴展(Figure 3)。在CoBr2/L9催化體系下,當烷基碘底物中的末端含有一系列不同電性取代芳基、萘基、雜芳基以及烷基時,均可與1a順利反應,獲得相應的C3-烷基化產物3a-3v,收率為28-92%,ee為91-96%。其中,異丁基碘化物由于空間位阻較大,導致產物3n的收率偏低(28%)以及對映選擇性有所下降(91%ee)。同樣,在NiBr2?DME/L5催化體系下,當烷基碘底物中的末端含有一系列不同電性取代芳基、萘基、雜芳基以及烷基時,均可與1a順利反應,獲得相應的C2-烷基化產物4a-4u,收率為42-82%,ee為85-92%。

(圖片來源:J. Am. Chem. Soc.)
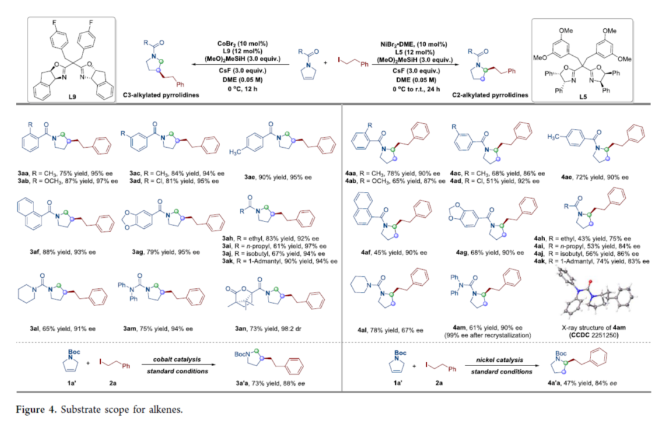
緊接著,作者對烯烴的底物范圍進行了擴展(Figure 4)。在CoBr2/L9催化體系下,當烯烴底物中R為不同電性取代芳基、萘基、烷基時,均可與2a順利反應,獲得相應的C3-烷基化產物3aa-3an,收率為61-90%,ee為91-97%。同樣,在NiBr2?DME/L5催化體系下,當烯烴底物中R為不同電性取代芳基、萘基、烷基時,均可與2a順利反應,獲得相應的C3-烷基化產物4aa-4am,收率為43-78%,ee為67-92%。此外,底物1a’在上述兩種條件下,也可與2a順利反應,獲得相應的C3-和C2-烷基化產物3a’a(73%收率和88%ee)和4a’a(47%收率和84%ee)。
(圖片來源:J. Am. Chem. Soc.)
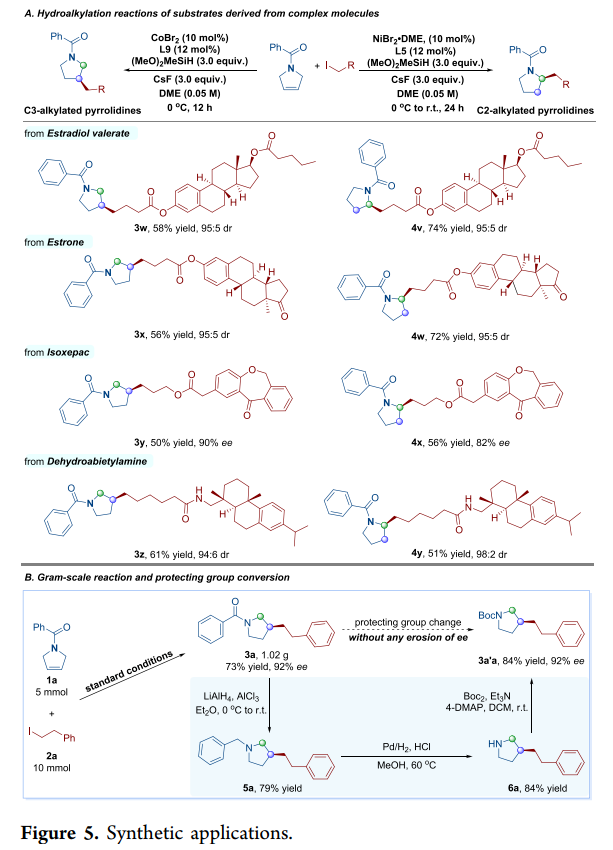
隨后,作者對反應的實用性進行了研究(Figure 5)。首先,該策略可用于一系列含有碘取代藥物和生物活性分子的后期衍生化,如戊酸雌二醇衍生物、雌酮衍生物、伊索克酸衍生物和脫氫松香胺衍生物,獲得相應的產物3w-3z和4v-4y,收率為50-74%,ee為82-90%或dr為94:6-98:2(Figure 5A)。其次,1a和2a的克級規(guī)模實驗,同樣能夠以73%收率和92%ee得到產物3a。同時,3a通過還原與脫芐基化反應后,可以兩步66%的總收率得到含游離NH鍵的吡咯烷衍生物6a(Figure 5B)。
(圖片來源:J. Am. Chem. Soc.)
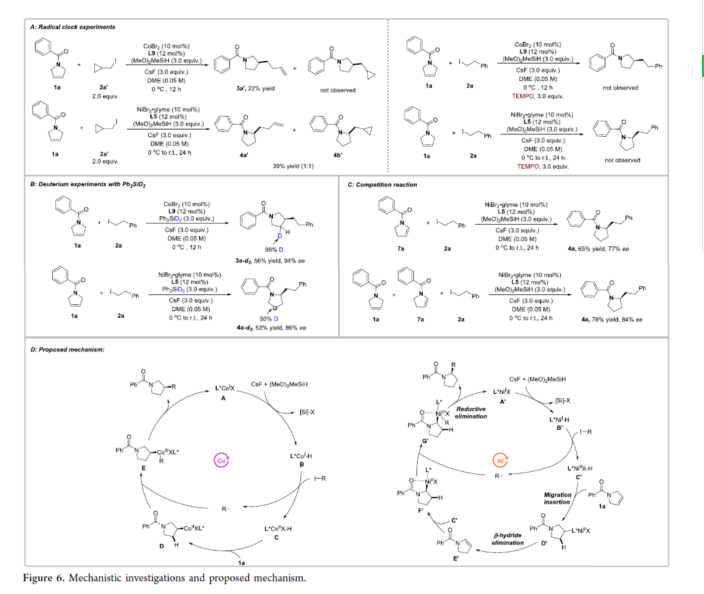
此外,作者還對反應機理進行了進一步的研究(Figure 6)。自由基鐘實驗表明,C-I鍵的斷裂涉及自由基途徑。同時,在反應過程中形成了烷基自由基(Figure 6A)。其次,氘代實驗表明,Co-H與1a的遷移插入可能是不可逆的,并且在通過Ni-H插入的C2-選擇性加氫烷基化中,3-吡咯烷異構化為2-吡咯烷也可能是不可逆的(Figure 6B)。競爭性實驗表明,7a可能是鎳催化循環(huán)中的中間體(Figure 6C)。
基于上述的研究以及相關文獻,作者提出了一種合理的催化循環(huán)過程(Figure 6D)。在鈷催化C3-選擇性加氫烷基化反應中,由L*CoIX前體A引發(fā)反應,其在硅烷和堿存在下生成L*CoI-H配合物B。隨后,配合物B與烷基鹵化物反應形成L*CoIIX-H配合物C和烷基自由基,然后遷移插入到1a中的C-C雙鍵中,得到烷基-CoII配合物D,其可以捕獲烷基自由基生成CoIII中間體E。最后,中間體E經還原消除后,可獲得所需的C3-選擇性加氫烷基化產物和再生活性催化劑A。在鎳催化C2-選擇性加氫烷基化反應中,在硅烷和堿存在下,由L*NiIX前體A’可生成L*NiI-H配合物B’。然后,配合物B’通過烷基碘的單電子氧化進行碘原子轉移,得到L*NiIIX-H配合物C’。隨后,通過遷移插入后生成烷基-NiII中間體D’。最后,通過β-氫消除和烯烴的重新插入得到中間體F’,然后進行自由基重組和還原消除,獲得所需的C2-選擇性加氫烷基化產物并實現催化循環(huán)。
(圖片來源:J. Am. Chem. Soc.)
總結
西北工業(yè)大學榮子強課題組報道了一種高效的催化劑調節(jié)區(qū)域和對映選擇性加氫烷基化反應,通過易得的3-吡咯啉衍生物的去對稱化過程,實現了手性C2-和C3-烷基化吡咯烷衍生物的發(fā)散性合成。在CoBr2與BOX配體(L9)催化體系中,通過遠端立體控制實現了不對稱C(sp3)-C(sp3)偶聯(lián),高效地合成了一系列C3-烷基化吡咯烷衍生物。在鎳催化體系中,通過烯烴異構化/加氫烷基化的串聯(lián)過程,合成了一系列C2-烷基化吡咯烷衍生物。這種發(fā)散性方法使用現成的催化劑、手性BOX配體和試劑,獲得了一系列具有優(yōu)異區(qū)域和對映選擇性(高達97%ee)的2-/3-烷基取代的吡咯烷衍生物。該方法具有廣泛的底物范圍、良好的官能團兼容性,可用于不對稱C(sp3)-C(sp3)偶聯(lián)反應。這種直接的過程能夠以良好的效率直接獲得區(qū)域選擇性C2-和C3-烷基化的手性吡咯烷以及結構復雜的生物活性化合物,從而證明了該策略具有獲得含有藥物和生物活性類似物的手性吡咯烷衍生物的潛力。
聲明:化學加刊發(fā)或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn