

2023年6月22日,《自然·納米技術》(Nature Nanotechnology)期刊在線發表了復旦大學化學系教授張凡團隊的科研成果《近紅外二區熒光增強的納米晶體用于實時動態的活體多重熒光成像》(“Fluorescence amplified nanocrystals in the second near-infrared window for in vivo real-time dynamic multiplexed imaging”),為以上難題的攻克提供了全新的思路。這也是復旦大學通過交叉學科研究取得的又一重大成果。
復旦大學化學系2019級博士生楊一唯、陳瑩為第一作者;復旦大學化學系張凡教授、凡勇青年研究員為通訊作者。研究工作得到了復旦大學化學系、聚合物工程國家重點實驗室、上海市分子催化和功能材料重點實驗室、國家重點研發項目、國家自然科學基金委員會、上海市科學技術委員會等機構與項目的大力支持。
技術進步:近紅外熒光成像逐步應用于實時動態的活體多重成像
熒光是自然界中的一種光致發光現象。由于其靈敏度高、即時反饋、操作便捷等特點,使得熒光成像在臨床醫學診斷、基礎生物學探索及解剖學結構研究中有著巨大的優勢。而借助于多種熒光探針同時標記多個待測物的多重熒光成像技術,研究人員能夠對多個待測物的活動進行實時動態的追蹤,有利于揭示生物體復雜的生理-病理機制。
目前該成像技術主要集中在可見光區(400-650 nm)及近紅外一區(650-900 nm),由于存在生物組織對該窗口光的吸收和散射強等問題,使得在這個窗口內的光學穿透深度和成像分辨率都不理想。為了解決這個問題,研究人員通常會采用手術開辟視窗的方法來暴露所研究的部位,從而期望能夠更精準的理解活體原位微環境的生理機制,但視窗不可避免地對正常生理環境造成破壞,為檢測結果帶來不可控的干擾。因此如何在深層組織中實現多重熒光成像是阻礙這一技術進一步發展的至關重要的問題。
近年來的研究表明,近紅外第二窗口的光(1000-1700 nm)在皮膚、脂肪和骨骼等生物組織中傳播時受到比可見光和近紅外一區光更小的散射作用和生物體自發熒光背景噪聲。尤其對于波長位于1500-1700 nm的子成像窗口,其受到的組織散射進一步降低,生物體自發熒光背景噪聲幾乎消失,因此被認為是一個實現活體深組織高分辨和高信噪比成像極具發展潛力的生物 “透明”窗口。然而位于該“透明”成像窗口的動態多重活體熒光成像研究仍舊不理想,一方面是受限于該成像窗口可用的熒光探針,目前已報道的只有基于Er3+的稀土熒光探針以及半峰寬度大的半導體量子點;另一方面是缺乏相應能夠進行實時多重熒光成像的裝置和技術,因此無法在活體實現實時動態的多重熒光成像。
研究突破:開發熒光增強的近紅外稀土熒光探針及雙通道熒光成像裝置實現實時動態的多重活體熒光成像
針對以上難題,張凡團隊開發了一系列立方晶相的稀土堿金屬氟化物納米熒光探針,并搭建了雙通道熒光成像裝置,在1500-1700 nm波段實現了活體實時動態的多重成像。傳統的研究中,由于六方晶相的稀土堿金屬氟化物(β-NaREF4)具有較小的聲子能,從而導致的更低的非輻射弛豫概率,通常被認為更加有利于提高發光效率,因此作為一種經典的稀土探針基質而廣泛使用。而在張凡團隊成員發現,相較于β-NaREF4基質,在立方晶相的堿金屬氟化物(α-NaREF4)基質中,Tm3+摻雜的稀土熒光探針在1632 nm處中有近百倍的下轉移發光增強。通過拉曼光譜、變溫熒光及光子數測試證明α-NaREF4基質較高的聲子能有效地促進了Tm3+的電子從3H4能級通過非輻射躍遷的方式到達3F4能級,從而增強了3F4能級的電子布居,且立方相基質中激活劑離子間的交叉弛豫以及激活劑離子與敏化劑離子之間的能量傳遞過程也進一步導致了Tm3+在1632 nm處的下轉移發光增強。基于此熒光增強機理,也實現了Er3+和Ho3+摻雜的近紅外稀土熒光探針在1530 nm和1180 nm處不同程度的下轉移發光增強。該Tm3+元素摻雜的新型近紅外稀土熒光探針為近紅外二區多重熒光成像提供了新的波長選擇。
針對所開發的系列近紅外第二窗口熒光增強的新型稀土熒光探針,張凡團隊進一步開發了與之匹配的高時空同步的實時動態多重成像裝置。與常規通過切換濾光片實現多通道成像的系統相比,該成像裝置能夠對兩個不同通道的熒光信號進行實時同步收集,體外不同熒光探針同時修飾的不同微球運動模擬實驗也驗證了裝置能夠保證雙通道高度同步的時空成像,為后續多種新型近紅外稀土熒光探針用于活體實時動態多重熒光成像打下基礎。
最后,張凡團隊在生物組織精細結構水平上驗證了該成像技術用于探索深組織生理活動機制的可行性。首先通過對不同近紅外稀土熒光探針表面進行功能化修飾,實現了對活體小鼠腦部血管網絡中各級血管的區分。團隊隨后使用激素刺激小鼠來模擬神經對血流的調控作用,利用該成像技術能夠在不開辟顱窗的情況下實現對小鼠動脈血管的舒縮運動進行實時動態的監測,有望為血液動力學研究提供更加精準的信息。為進一步探索該成像技術用于活體深組織多重熒光成像的潛力,團隊利用開發的新型近紅外稀土熒光探針特異性的標記了小鼠的中性粒細胞,通過該成像技術實現了在單細胞水平上的免疫反應監測,能夠對單個中性粒細胞在皮下炎癥部位及腦損傷部位趨化性、外滲、激活等過程的進行實時動態監測。相比于傳統的成像方法,該近紅外新型稀土熒光探針及雙通道實時成像技術有效避免了開辟視窗造成組織損傷對觀測結果帶來的干擾,為在活體水平研究細胞免疫反應提供了新的思路。
目前,盡管該研究已經取得了較好的初步應用效果,未來還需要更進一步地提高探針的發光效率以及增加熒光發射通道,從而滿足對活體內更高成像速度、更深組織成像以及更高通量多重檢測應用的需求。此外,改善熒光探針的功能修飾特性,增強與前沿生物與成像技術的兼容性等問題仍然有待后續研究。但是這一科研成果所點亮的諸多可能,都將為化學與材料科學、生物醫學光子學、生命科學、生物醫學工程和醫療診斷等領域拓寬研究視野。
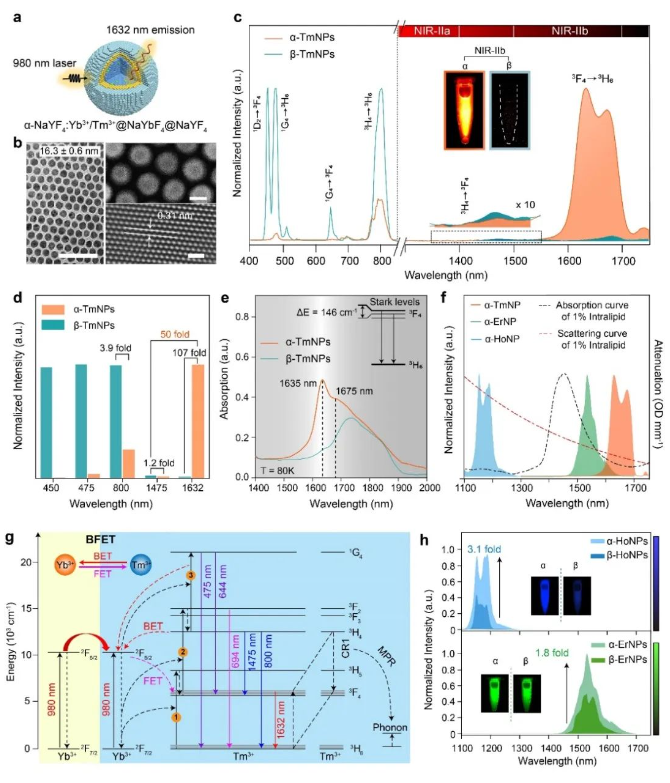
圖1:(a-b) Tm3+摻雜的立方相納米顆粒核殼結構示意圖及電鏡圖;(c-d) Tm3+摻雜的立方相及六方晶相納米顆粒發射光譜及不同波長處發光強度柱狀圖;(e) 低溫吸收光譜;(f) 基于Tm3+、Er3+、Ho3+摻雜的立方相納米顆粒發射光譜及脂肪乳劑的吸收、散射曲線;(g) Yb-Tm體系能量傳遞機理;(h)Er3+和Ho3+元素摻雜的立方相和六方相納米顆粒的發射光譜及熒光成像圖。
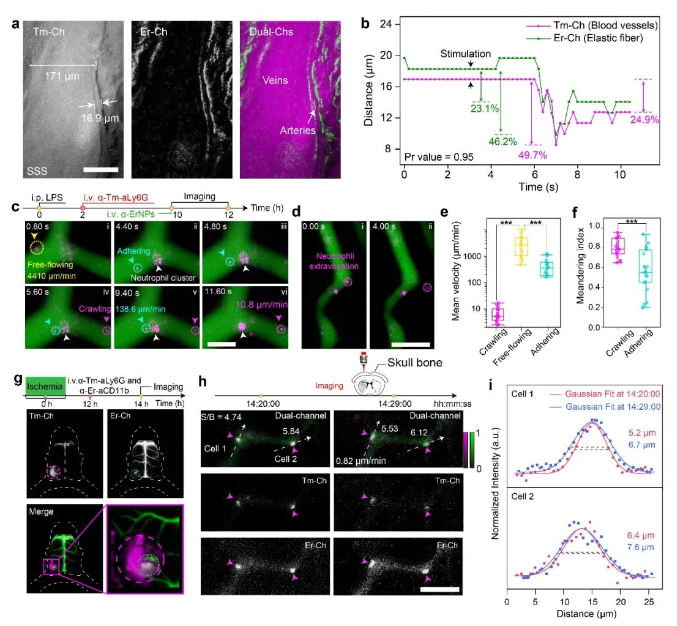
圖2:(a-b) 基于新型近紅外熒光探針構建的活體動態多重成像方案,實現了小鼠腦部血管舒縮運動的實時動態監測;(c-f) 基于新型近紅外熒光探針構建的活體動態多重成像方案,實現了對中性粒細胞在皮下炎癥部位趨化作用及外滲過程的實時動態監測和分析。(g-i) 基于新型近紅外熒光探針構建的活體動態多重成像方案,實現了在腦卒中小鼠腦損傷部位激活態中性粒細胞免疫反應的實時動態成像。
全文鏈接:https://doi.org/10.1038/s41565-023-01422-2
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn