

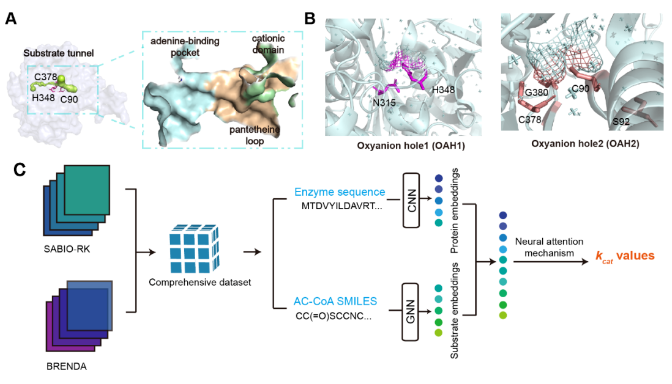
在生物合成途徑中,形成新的碳-碳鍵是化合物衍生化中最重要的一步,因其可以從簡單的起始分子生成復雜的有機化合物。硫解酶催化的Claisen縮合可以催化生物體形成碳-碳鍵,從而構建多種多樣的化合物碳骨架。在催化過程中,硫解酶的底物通道對底物的結合和縮合反應起著重要作用,可以直接影響酶活。然而,底物通道如何影響β-酮硫酶的催化機制尚不清楚,這限制了底物通道的理性工程設計以提高酶的性能。因此,探索底物通道的普適性調控機制,有助于建立一種可靠、通用的提高β-酮硫酶性能工程方法,從而廣泛應用于碳-碳鍵的形成。
該研究解析了來自褐色喜熱裂孢菌的一種耐熱的β-酮硫解酶Tfu_0875的晶體結構。該酶具有Cys-His-Cys催化三聯體,主要由陽離子結構域、腺嘌呤結合口袋和泛酰巰基乙胺環構成狹窄的底物通道。Tfu_0875的活性結構域含有氧陰離子空穴(OAHs)來穩定底物的過渡態。然后聚焦于底物通道,通過深度學習方法(DLKcat)預測突變體們的kcat來篩選底物通道內酶活提高的突變體。
經篩選后發現Tfu_0875陽離子域的突變體L163H酶活提高最顯著,比Tfu_0875提高了313%。L163H的咪唑基團比活性中心His348的咪唑基團更接近底物乙酰輔酶A的Cα原子,且Tfu_0875L163H的G147可以與L163H形成氫鍵,這與Tfu_0875中的活性中心H348和N315 (OAH1)相同。同時測量Tfu_0875H348A和Tfu_0875L163H/H348A的相對酶活性,結果表明Tfu_0875L163H/H348A的相對酶活性比Tfu_0875H348A高1.79倍,因此認為突變體L163H可以發揮與His348相同的作用,作為氫鍵供體幫助錨定底物。經過分子動力學模擬發現,Tfu_0875L163H產生的氫鍵數量明顯高于Tfu_0875,說明Tfu_0875L163H與底物乙酰輔酶A之間存在更強的相互作用,可以更快錨定底物乙酰輔酶A,間接縮短反應時間。此外,當L163變為H163時,陽離子域的體積從69.18 ?3增大到81.15 ?3。
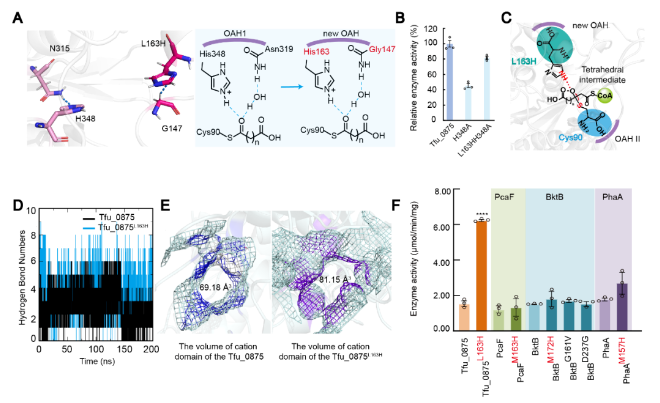
根據上述分析,該研究揭示了一個局部陽離子域設計規則(LCDMR)。將loop區域和三明治拓撲結構的α5螺旋交界處的非保守殘基突變為組氨酸,通過:(1)增加陽離子結構域的體積,為底物提供更寬的反應空間;(2)增加周圍殘基與底物的氫鍵相互作用,加速Claisen縮合反應;(3)與活性中心H348功能相似,從而錨定底物穩定四面體中間體。這一規律對提高其他β-酮硫酶的酶活性具有普遍適用性。
上述研究工作中,江南大學19級博士研究生劉麗霞為論文的第一作者,鄧禹教授和周勝虎副研究員為論文的共同通訊作者。此研究工作得到了國家重點研發計劃(2022YFC2104600)、江蘇省杰出青年基金(BK20220089)和天津市合成生物技術創新能力提升項目(TSBICIP-KJGG-015)的資助。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn