




阿爾茨海默病(Alzheimer’s disease,AD)是一種常見(jiàn)的神經(jīng)退行性疾病,可影響大腦認(rèn)知、記憶能力。目前AD致病機(jī)制的認(rèn)知多來(lái)源于對(duì)家族遺傳性AD(fAD)的研究。淀粉樣前體蛋白(APP)和γ分泌酶的酶切活性中心(PS1和PS2)的一些突變加速淀粉樣斑塊的形成,最終導(dǎo)致fAD。但fAD僅占所有AD的~1%,另外~99%是非家族遺傳性的散發(fā)性AD(sAD)。sAD患者并不攜帶導(dǎo)致fAD的APP或者PS1/2突變。載脂蛋白E4(ApoE4)是sAD最大的風(fēng)險(xiǎn)因子。約有14%的人攜帶至少一個(gè)ApoE4基因。攜帶兩個(gè)ApoE4拷貝的人與攜帶正常ApoE3的人相比,患AD的風(fēng)險(xiǎn)增加十倍,并且患病年齡提前至70歲之前,病患程度也大大增加。而ApoE2卻能顯著降低AD的發(fā)病風(fēng)險(xiǎn)。雖然對(duì)AD的影響截然不同,但ApoE2,ApoE3和ApoE4的氨基酸序列僅有1-2個(gè)位點(diǎn)的不同。目前并不清楚為什么同一基因編碼的不同ApoE異構(gòu)體在AD進(jìn)程中發(fā)揮著截然相反的影響。sAD風(fēng)險(xiǎn)基因ApoE與fAD致病基因APP和PS1/2之間是否有功能上的聯(lián)系也是不清楚的。
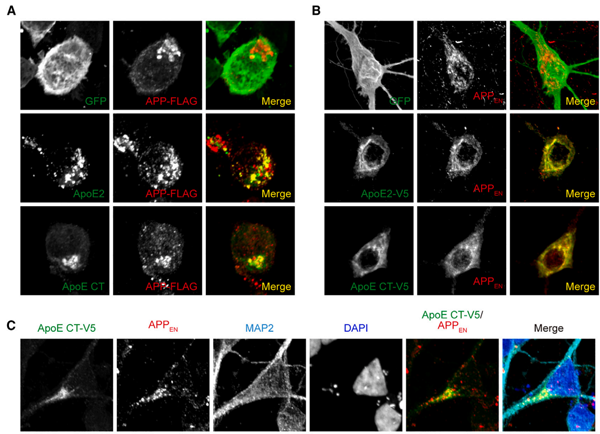
ApoE與APP相互作用
陳椰林課題組發(fā)現(xiàn)ApoE異構(gòu)體帶來(lái)的致病風(fēng)險(xiǎn)與其直接特異性抑制APP的γ剪切活性相關(guān),提出了ApoE異構(gòu)體改變AD風(fēng)險(xiǎn)的新理論。具有保護(hù)作用的ApoE2具有最強(qiáng)的抑制活性,而增加患病風(fēng)險(xiǎn)的ApoE4則失去了該活性,因此兩者在AD疾病進(jìn)程中功能截然不同。該理論首次將fAD的致病基因和sAD的風(fēng)險(xiǎn)基因從功能上直接聯(lián)系在一起,提示APP的γ酶切異常是fAD和sAD共同的致病原因。
有趣的是,陳椰林課題組發(fā)現(xiàn)ApoE是通過(guò)其C末端抑制了APP的γ酶切,但是ApoE三種異構(gòu)體僅在N末端有1或2個(gè)氨基酸位點(diǎn)的差異,在C末端是完全相同的。那么完全相同的C端連接上略有不同的N端之后為什么活性就不一樣了呢?后續(xù)研究發(fā)現(xiàn),在全長(zhǎng)蛋白中,C端活性受到N端抑制。結(jié)合前人關(guān)于ApoE結(jié)構(gòu)的研究,這可能是因?yàn)锳poE4的N端與C端通過(guò)鹽橋相互作用,離得更近,故而N端對(duì)C端的抑制更強(qiáng);而ApoE2的N端與C端沒(méi)有鹽橋,離得更遠(yuǎn),因此N端對(duì)C端的抑制較弱;所以ApoE2抑制APP γ酶切的活性要強(qiáng)于ApoE4。當(dāng)然這一猜想還有賴于后續(xù)原子尺度的解析進(jìn)行驗(yàn)證。
AD患者大腦中的核心病理特征是存在大量由Aβ組成的淀粉樣斑塊。目前,臨床上已經(jīng)證明使用Aβ抗體清除淀粉樣板塊可以部分緩解AD的疾病進(jìn)程,但是該類型療法的治療效果非常有限。有一種可能性是因?yàn)椋壳暗目贵w治療僅僅能清除已經(jīng)從細(xì)胞中分泌出來(lái)的Aβ及其在細(xì)胞外聚集而成的淀粉樣斑塊。實(shí)際上有證據(jù)表明細(xì)胞內(nèi)的Aβ也具有毒性,抗體治療還無(wú)法觸達(dá)此類Aβ。陳椰林課題組的研究發(fā)現(xiàn)ApoE活性區(qū)域以高特異性的方式從源頭抑制腦細(xì)胞內(nèi)Aβ的生成,并且精準(zhǔn)定位于神經(jīng)元以及淀粉樣斑塊周邊的Aβ高發(fā)區(qū)域,達(dá)到減少淀粉樣斑塊的目的。
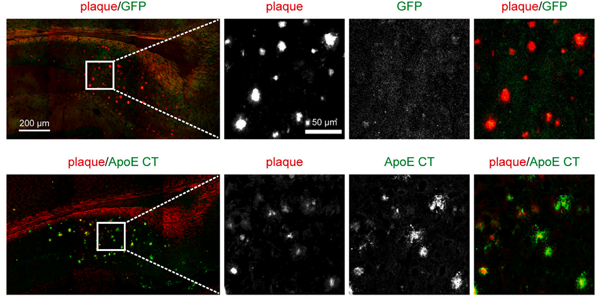
ApoE的活性區(qū)域減少淀粉樣斑塊
此外,該研究提示抑制γ分泌酶可以作為治療sAD的方法。但是γ分泌酶的底物不只是APP,還有100多種不同的底物,現(xiàn)有γ分泌酶抑制劑會(huì)無(wú)差別地抑制所有底物的γ剪切。由于有一些γ底物具有重要的生理功能,抑制其剪切會(huì)導(dǎo)致嚴(yán)重的副作用。故而此類γ分泌酶抑制劑的開(kāi)發(fā)目前已經(jīng)陷入停頓。然而ApoE的活性區(qū)域?qū)Ζ梅置诿傅囊种剖蔷哂械孜镞x擇性的,它選擇性地抑制APP的γ剪切,卻不抑制其它一些重要蛋白的γ剪切,比如Notch。因此,該活性區(qū)域,或者是模擬其活性的其他分子就具有理論上治療AD的潛力。這可能成為開(kāi)發(fā)AD療法的全新方向。
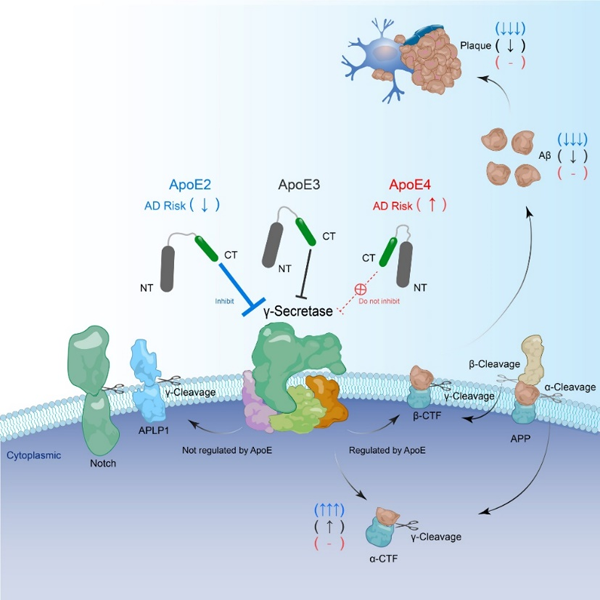
ApoE2、ApoE3和ApoE 4對(duì)γ分泌酶的差異化和底物特異性抑制
該論文的第一作者為侯祥龍博士和博士生張雪馨,通訊作者是陳椰林研究員和耿泱副研究員。該工作得到了交叉中心張?jiān)跇s研究員和王文元研究員的協(xié)助和支持。該項(xiàng)研究受到了中國(guó)科學(xué)院和上海市科技重大專項(xiàng)基金的資助支持。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn