



核糖體肽是自然界通過翻譯后修飾化學(xué)創(chuàng)造的一類結(jié)構(gòu)復(fù)雜、活性優(yōu)良的肽類天然產(chǎn)物。許多有廣泛應(yīng)用的抗生素,如乳酸鏈球菌素和硫鏈絲菌素,均通過翻譯后修飾化學(xué)從20種天然氨基酸構(gòu)成的簡單多肽轉(zhuǎn)化而來。上海有機(jī)所劉文課題組長期從事富硫細(xì)菌環(huán)肽的翻譯后修飾化學(xué)研究,近期對相關(guān)肽的主鏈骨架修飾、氮雜核心環(huán)的形成以及非天然氨基酸的引入等酶促反應(yīng)過程進(jìn)行了剖析(J. Am.Chem.Soc.2020, 142,8454–8463;J.Am.Chem.Soc.2021,143,13790-13797; Cell Chem.Biol. 2021,28, 675-685;J.Am.Chem.Soc.2022,144,4431-4438)。
賽普霉素是鏈霉菌產(chǎn)生的一類核糖體肽,具有顯著抑制藤黃微球菌和小鼠白血病細(xì)胞生長的作用。自發(fā)現(xiàn)以來三十余年,人們對該類核糖體肽的翻譯后修飾過程知之甚少。基于前期工作基礎(chǔ),劉文課題組對該分子的骨架形成機(jī)制展開了研究。研究結(jié)果修正了賽普霉素的化學(xué)結(jié)構(gòu):除了已知的脫氫丁胺酸殘基外,該分子還含未被發(fā)現(xiàn)的11個(gè)D型氨基酸殘基,表明賽普霉素是一種長期以來被低估了的高度修飾核糖體肽。研究發(fā)現(xiàn),僅由兩個(gè)膜蛋白的共同作用,便能催化肽鏈上的4個(gè)蘇氨酸脫水、1個(gè)半胱氨酸脫硫和11個(gè)氨基酸(3個(gè)丙氨酸、2個(gè)纈氨酸、2個(gè)天冬酰胺、2個(gè)異亮氨酸、2個(gè)脯氨酸)發(fā)生差向異構(gòu)化反應(yīng)。
研究證明,上述三種后修飾反應(yīng)在化學(xué)機(jī)制上是一致的。脫水反應(yīng)、脫硫反應(yīng)和差向異構(gòu)化反應(yīng)可以互換,例如將 D 型氨基酸位點(diǎn)突變蘇氨酸,后修飾過程中該位點(diǎn)發(fā)生了脫水反應(yīng);將蘇氨酸位點(diǎn)突變?yōu)榘腚装彼釀t發(fā)生了脫硫反應(yīng)。通過同位素標(biāo)記實(shí)驗(yàn),證明差向異構(gòu)化反應(yīng)只斷裂Ca-H鍵,從而支持上述反應(yīng)經(jīng)歷相同的Ca烯醇化過程。盡管自然界存在多種脫水酶、消旋酶和脫硫酶,但從未發(fā)現(xiàn)在多肽水平上由相同化學(xué)機(jī)制串聯(lián)起三種反應(yīng)的酶促機(jī)制。該發(fā)現(xiàn)為這種高普適性、高底物泛雜性的氨基酸殘基翻譯后修飾化學(xué)提供了有力證據(jù),并為解析該后修飾過程的分子機(jī)制打下良好基礎(chǔ)。通過前體肽的工程化改造,獲得了三十余種賽普霉素類似物,有助于探究賽普霉素的構(gòu)效關(guān)系,以及通過合成生物學(xué)方法獲得更高產(chǎn)量和更高活性的賽普霉素變體。
該研究成果近期在“Journal of the American Chemical Society”上發(fā)表(DOI:10.1021/jacs.3c01730)。有機(jī)所博士生薛彥青和博士后王曉峰為共同第一作者,劉文研究員為通訊作者。感謝上海有機(jī)所公共技術(shù)服務(wù)中心王昊陽老師和宋瑋老師在分析方面提供的大力支持。該工作得到科技部、國家自然科學(xué)基金委相關(guān)基金的大力資助。
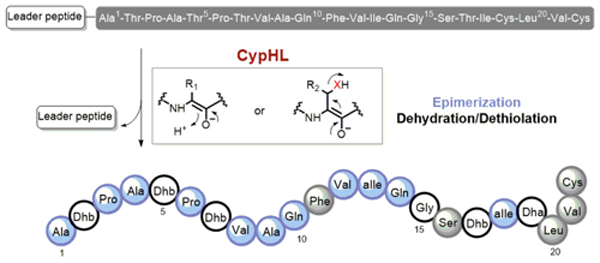
圖:Fig 1. 林那羅定肽生物合成中的脫水、脫硫和異構(gòu)化反應(yīng)

聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn