



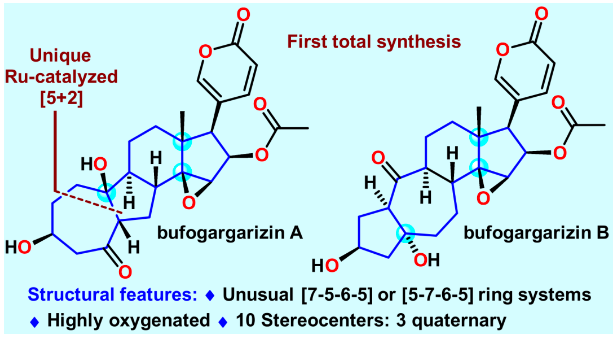
甾體類天然產(chǎn)物由于具有重要且多樣的生物活性和豐富的結(jié)構(gòu),在藥物發(fā)現(xiàn)和合成化學(xué)領(lǐng)域占有著重要的地位。蟾蜍作為一種傳統(tǒng)中藥材,長(zhǎng)期被用來(lái)治療癌癥、心力衰竭、牙痛、抗炎等,而甾體類化合物是其主要活性成分。孿生甾體bufogargarizins A和B是暨南大學(xué)葉文才教授團(tuán)隊(duì)于2010年從中華大蟾蜍的毒液中分離鑒定的具有全新骨架的類固醇天然產(chǎn)物。相比于普通的甾體結(jié)構(gòu),bufogargarizins A和B分別具有[7-5-6-5]和[5-7-6-5]四環(huán)核心骨架,其也是首次于蟾蜍源甾體中發(fā)現(xiàn)的具有重排A/B環(huán)系的天然產(chǎn)物。有趣的是,生源假說(shuō)認(rèn)為bufogargarizin A和B可能來(lái)源于相同的生源前體,通過(guò)不同的生物途徑轉(zhuǎn)化得到,然而其假說(shuō)尚未得到證實(shí)。這些天然產(chǎn)物的自然來(lái)源相對(duì)匱乏,且尚沒(méi)有全合成報(bào)道,阻礙了其進(jìn)一步的生物活性研究。因此開(kāi)發(fā)一條高效的全合成路線,進(jìn)而為生物活性研究和構(gòu)效關(guān)系研究提供物質(zhì)基礎(chǔ),具有較大的現(xiàn)實(shí)意義。從結(jié)構(gòu)上分析,bufogargarizins A和B具有氧化態(tài)極高的核心骨架,以及10個(gè)手性中心,其中大多數(shù)是連續(xù)的,并且有三個(gè)是季碳中心,其中一個(gè)為全碳季碳中心;同時(shí)還具有一個(gè)極富電子的?-吡喃酮環(huán)(圖1)。這些特征使得bufogargarizins A和B的全合成具有極大的挑戰(zhàn)性。由于其潛在的生理活性以及頗具合成挑戰(zhàn)的結(jié)構(gòu),骨架重排的甾體吸引了合成化學(xué)界廣泛的研究興趣,國(guó)內(nèi)的楊震、李昂、桂敬漢、馬志強(qiáng)等教授團(tuán)隊(duì)均做出了重要貢獻(xiàn)。然而,目前尚沒(méi)有這類含有?-吡喃酮環(huán)的A/B重排甾體的全合成報(bào)道。此外,合成這種[7-5-6-5]四環(huán)核心骨架的方法也非常有限。2018年,李闖創(chuàng)教授團(tuán)隊(duì)報(bào)道了一種采用Type ? [5+2] 環(huán)加成反應(yīng)構(gòu)建bufogargarizin A核心骨架的方法(Org. Chem. Front. 2019, 6, 22),然而后期的官能團(tuán)修飾卻遭遇了較大的困難。在其后對(duì)于這類獨(dú)特分子不懈努力的合成實(shí)踐中,李闖創(chuàng)教授團(tuán)隊(duì)發(fā)展了烯醇醚環(huán)丙烷(VECP)—炔的釕催化[5+2]環(huán)加成反應(yīng)作為關(guān)鍵反應(yīng),完成了bufogargarizin A和B的首次不對(duì)稱全合成。
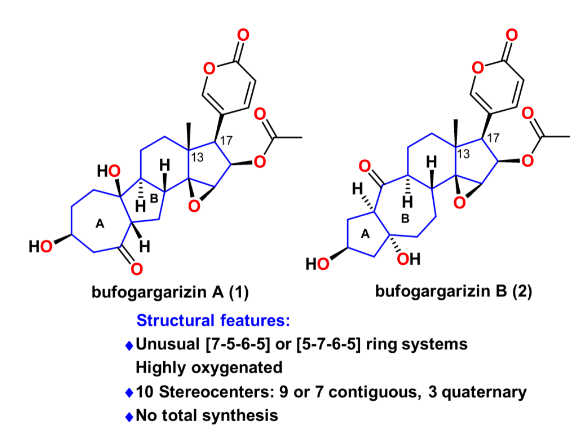
圖1. bufogargarizin A和B分子及背景介紹(圖片來(lái)源:J. Am. Chem. Soc.)
逆合成分析如圖2所示,天然產(chǎn)物bufogargarizin A可以通過(guò)一系列官能團(tuán)轉(zhuǎn)化從化合物3合成,這主要包括若干步的C-O鍵生成反應(yīng)。從策略上來(lái)說(shuō)這將產(chǎn)生一系列從低到高氧化態(tài)的衍生物,有利于將來(lái)的構(gòu)效關(guān)系研究。而bufogargarizin B可以通過(guò)仿生的retro-aldol/跨環(huán)aldol串聯(lián)反應(yīng)直接從bufogargarizin A得到。然而其生源途徑有待于進(jìn)一步證實(shí),且跨環(huán)aldol反應(yīng)的區(qū)域選擇性和非對(duì)映選擇性難以預(yù)測(cè),因此該策略有不小的挑戰(zhàn)性。其次bufogargarizin B可以從四環(huán)骨架的化合物4得到,該[5-7-6-5]四環(huán)骨架可以從[7-5-6-6]四環(huán)骨架3通過(guò)仿生的環(huán)系重整得到,盡管目前沒(méi)有關(guān)于[7-5-X]骨架重整以生成[5-7-X]骨架的例子。受到Wender教授以及Trost教授關(guān)于VCP [5+2]環(huán)加成反應(yīng)開(kāi)創(chuàng)性工作的啟發(fā),化合物3可以通過(guò)VECP—炔的[5+2]環(huán)加成反應(yīng)得到。該反應(yīng)區(qū)別于傳統(tǒng)的VCP [5+2]環(huán)加成反應(yīng),直接得到高度氧化的產(chǎn)物,可以為后續(xù)的修飾提供便利。而其前體5可以由商業(yè)可得的便宜原料sitolactone通過(guò)幾步簡(jiǎn)單轉(zhuǎn)化得到。
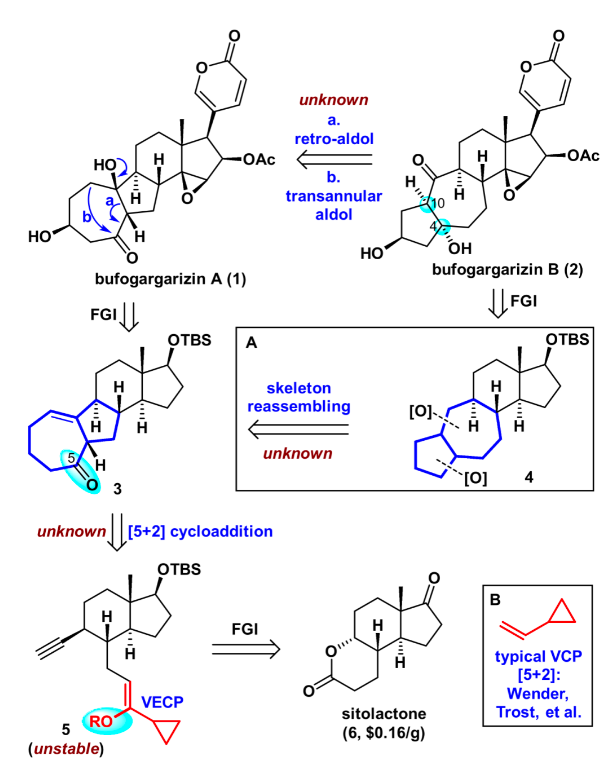
圖2. 逆合成分析(圖片來(lái)源:J. Am. Chem. Soc.)
具體合成路線如圖3所示,化合物6通過(guò)還原、氧化、上保護(hù)等幾步轉(zhuǎn)化得到醛酮化合物7,隨后醛基選擇性的和環(huán)丙基格氏試劑加成,一鍋法對(duì)羥基進(jìn)行原位保護(hù),以62%產(chǎn)率得到化合物8。利用van Leusen反應(yīng)對(duì)化合物8進(jìn)行增碳,隨后用DIBAL還原氰基成醛(dr=1.5:1, C9),在甲醇/甲醇鈉的條件下將C9醛基異構(gòu)化(>8:1 dr ),所得化合物9,隨后和Ohira–Bestmann試劑、碳酸鉀在甲醇溶劑下順利得到[5+2]前體11。
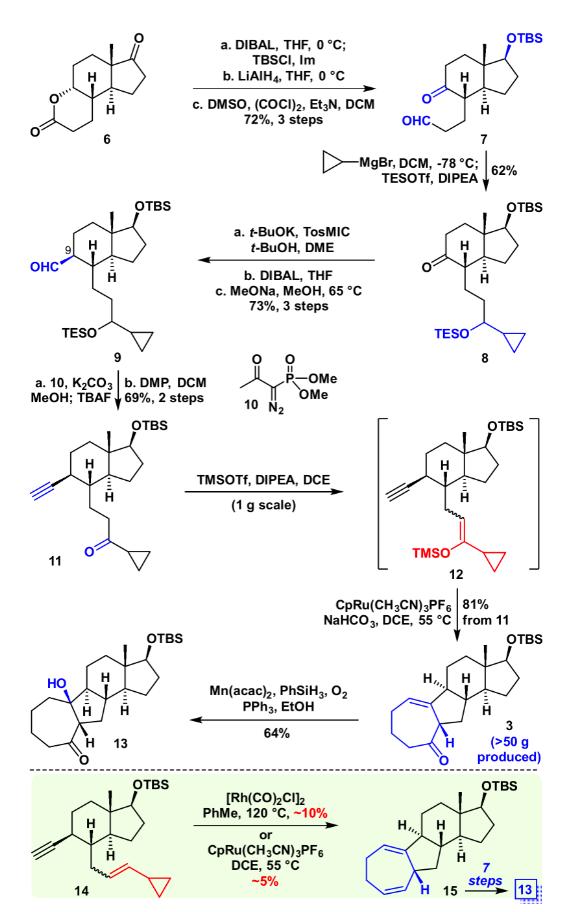
圖3. 化合物13的合成(圖片來(lái)源:J. Am. Chem. Soc.)
將化合物11在TMSOTf、DIPEA作堿的條件下制成烯醇硅醚(Z/E = 2.5:1),隨后加入碳酸氫鈉中和過(guò)量的三氟甲磺酸酯,在DCE為溶劑,CpRu[CH3CN]3PF6作為催化劑,加熱至55 ℃的條件下,以一鍋81%的產(chǎn)率順利得到VECP [5+2]產(chǎn)物3。隨后在Mukaiyama Hydration條件下,順利引入相應(yīng)的叔醇,得到化合物13,其絕對(duì)構(gòu)型通過(guò)衍生物的單晶確認(rèn)。作為對(duì)比,底物14(Z/E = 1:1)在傳統(tǒng)的銠催化或者釕催化的條件下以很低(5~10%)的產(chǎn)率得到相應(yīng)的[5+2]產(chǎn)物15,其主要的原因是銠催化劑對(duì)端炔不兼容,以及釕催化劑要求VCP的雙鍵為反式。而后續(xù)轉(zhuǎn)化成13卻需要額外的7步,這證明VECP [5+2]環(huán)加成反應(yīng)的高效性,以及其在全合成后期官能團(tuán)修飾中的巨大優(yōu)勢(shì)。
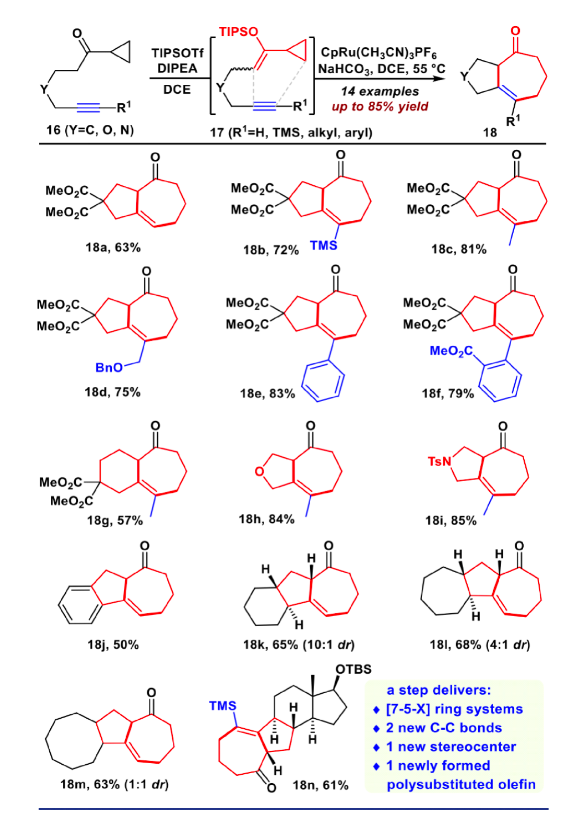
圖4. VECP [5+2]環(huán)加成反應(yīng)的底物拓展(圖片來(lái)源:J. Am. Chem. Soc.)
接下來(lái)作者考察了該VECP [5+2]反應(yīng)的底物適用范圍(如圖4)。研究發(fā)現(xiàn),該反應(yīng)對(duì)各種炔烴都是兼容的,如端炔、非端炔、TMS、烷基或者芳基取代的炔烴,都得到良好的產(chǎn)率(18a-18f)。甚至對(duì)于之前被證明是困難的[7/6]并環(huán)產(chǎn)物(18g)也取得了成功。此外,對(duì)于氧雜環(huán)(18h)和氮雜環(huán)(18i)都取得了良好的收率。隨后作者進(jìn)一步嘗試構(gòu)建更加復(fù)雜的環(huán)系,例如苯并[5-7]環(huán)(18j)、[7-5-6]并環(huán)(18k)、[7-5-7]并環(huán)(18l)、[7-5-8]并環(huán)(18m)、以及[7-5-6-5]并環(huán)(18n),這些底物均取得中等收率,這再一次證實(shí)該VECP [5+2]反應(yīng)具有廣泛的適用性。接下來(lái),作者開(kāi)始進(jìn)行bufogargarizin A的全合成。將化合物13用DIBAL還原,并在一鍋內(nèi)用TBAF脫除硅基保護(hù)。用DMP同時(shí)對(duì)C5和C17進(jìn)行氧化,隨后進(jìn)行雙Saegusa氧化,以三步62%的產(chǎn)率得到雙不飽和烯酮化合物19。化合物19經(jīng)過(guò)優(yōu)化的(SiO2, DIPEA , PhCF3)化學(xué)選擇性雙鍵遷移,立體選擇性環(huán)氧化,以及Mukaiyama 水合,原位進(jìn)行雙TMS保護(hù),以46%的產(chǎn)率得到化合物20。將20在KHMDS作堿的條件下和Comins試劑反應(yīng)順利得到三氟甲磺酸乙烯酯,隨后用二碘化釤開(kāi)環(huán)氧,得到C3位的羥基化合物21。將其進(jìn)行MOM保護(hù),隨后DIBAL還原,以及原位TMS保護(hù),以73%的收率一鍋得到化合物22。利用Suzuki反應(yīng)將化合物22與吡喃酮片段23偶聯(lián),以85%的收率得到24。隨后用m-CPBA對(duì)C17=C18進(jìn)行環(huán)氧化,并在加入硼烷二甲硫醚絡(luò)合物的條件下發(fā)生乙烯基還原、開(kāi)環(huán)氧串聯(lián)反應(yīng),得到25。將25進(jìn)行DMP氧化,隨后在DBU的條件下發(fā)生β-氧消除,得到C14=C16雙鍵,而此時(shí)C17發(fā)生了消旋,在LHMDS,-98 ℃的條件下順利對(duì)C17進(jìn)行動(dòng)力學(xué)的異構(gòu)化,以兩步68%的收率得到化合物26。化合物26嘗試過(guò)許多還原條件,均立體選擇性不佳,最后在標(biāo)準(zhǔn)CBS還原條件順利得到相應(yīng)還原產(chǎn)物,并在原位加入DMAP和醋酸酐的條件下乙酰化,以良好產(chǎn)率得到27。最后在NBS和NaOH的條件下立體選擇性的環(huán)氧化,并在加入TBAF的條件下以46%的收率一鍋法脫硅基保護(hù);隨后進(jìn)行DMP氧化,在LiBF4的作用下脫除MOM保護(hù),順利的完成了bufogargarizin A的不對(duì)稱全合成。

圖5. bufogargarizin A的不對(duì)稱全合成(圖片來(lái)源:J. Am. Chem. Soc.)
得到bufogargarizin A后,作者開(kāi)始嘗試直接通過(guò)仿生的retro aldol/跨環(huán)aldol串聯(lián)反應(yīng)得到bufogargarizin B。然而嘗試許多條件以及數(shù)個(gè)底物之后,并沒(méi)有取得令人滿意的結(jié)果,絕大多數(shù)底物伴隨著難以避免的副反應(yīng)。于是作者認(rèn)為較低的氧化態(tài)以及簡(jiǎn)單的官能團(tuán)可能對(duì)這一轉(zhuǎn)化有利,于是化合物28被設(shè)計(jì)為retro aldol/跨環(huán)aldol串聯(lián)反應(yīng)的底物。將化合物13進(jìn)行Saegusa氧化,隨后在雙氧水和氫氧化鈉的條件下進(jìn)行立體選擇性的環(huán)氧化。用二碘化釤開(kāi)環(huán)氧,隨后進(jìn)行MOM保護(hù),以4步47%的收率得到化合物28。化合物28在DBU作堿,THF為溶劑,加熱到沸點(diǎn)回流的條件下,順利實(shí)現(xiàn)所設(shè)計(jì)的retro aldol/跨環(huán)aldol串聯(lián)反應(yīng),從而完成從化合物28 的[7-5-6-5]環(huán)系到化合物30 的[5-7-6-5]環(huán)系直接轉(zhuǎn)化,且立體選擇性單一。這一實(shí)驗(yàn)結(jié)果也通過(guò)DFT理論計(jì)算驗(yàn)證,化合物30既是動(dòng)力學(xué)優(yōu)勢(shì),也是熱力學(xué)優(yōu)勢(shì)的產(chǎn)物。得到化合物30之后,進(jìn)一步展開(kāi)bufogargarizin B的全合成。用DIBAL將其羰基還原,隨后加入TBAF脫硅基保護(hù),以一鍋65%的產(chǎn)率得到相應(yīng)的三醇。隨后DMP氧化,得到化合物31。后續(xù)通過(guò)與bufogargarizin A全合成相似的方法,實(shí)現(xiàn)了bufogargarizin B的不對(duì)稱全合成。值得一提的是,經(jīng)過(guò)反復(fù)實(shí)驗(yàn),bufogargarizin B亦無(wú)法直接轉(zhuǎn)化為bufogargarizin A,因此bufogargarizin A和bufogargarizin B的相互轉(zhuǎn)化被證明是困難的,這或許能為其生源假說(shuō)提供有用的啟發(fā)。
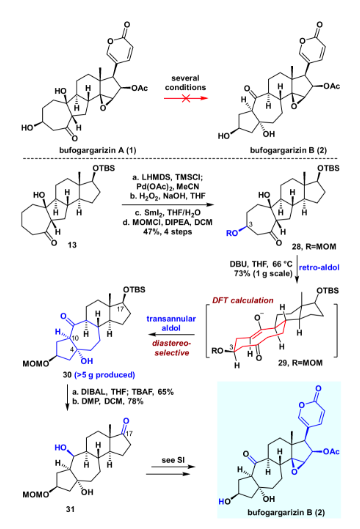
圖6. bufogargarizin B的不對(duì)稱全合成(圖片來(lái)源:J. Am. Chem. Soc.)
總結(jié)
南科大李闖創(chuàng)教授團(tuán)隊(duì),首次利用VECP [5+2]反應(yīng)高效構(gòu)建了[7-5-6-5] 四環(huán)骨架,并通過(guò)一系列的官能團(tuán)轉(zhuǎn)化,完成了 bufogargarizin A 的首次不對(duì)稱全合成。同時(shí),通過(guò)新穎的retro aldol/跨環(huán)aldol串聯(lián)反應(yīng),實(shí)現(xiàn)[7-5-6-5]環(huán)系到[5-7-6-5]環(huán)系的重組轉(zhuǎn)化,進(jìn)而完成了 bufogargarizin B 的首次不對(duì)稱全合成。該合成策略可以為今后合成其它具有類似特征的甾體類天然產(chǎn)物提供重要的借鑒。
文獻(xiàn)詳情:
Li-Ping Zhong, Rui Feng, Jing-Jing Wang, Chuang-Chuang Li*. Asymmetric Total Synthesis of Twin Bufogargarizins A and B. J. Am. Chem. Soc. 2023
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn