




(圖片來源:J. Am. Chem. Soc.)
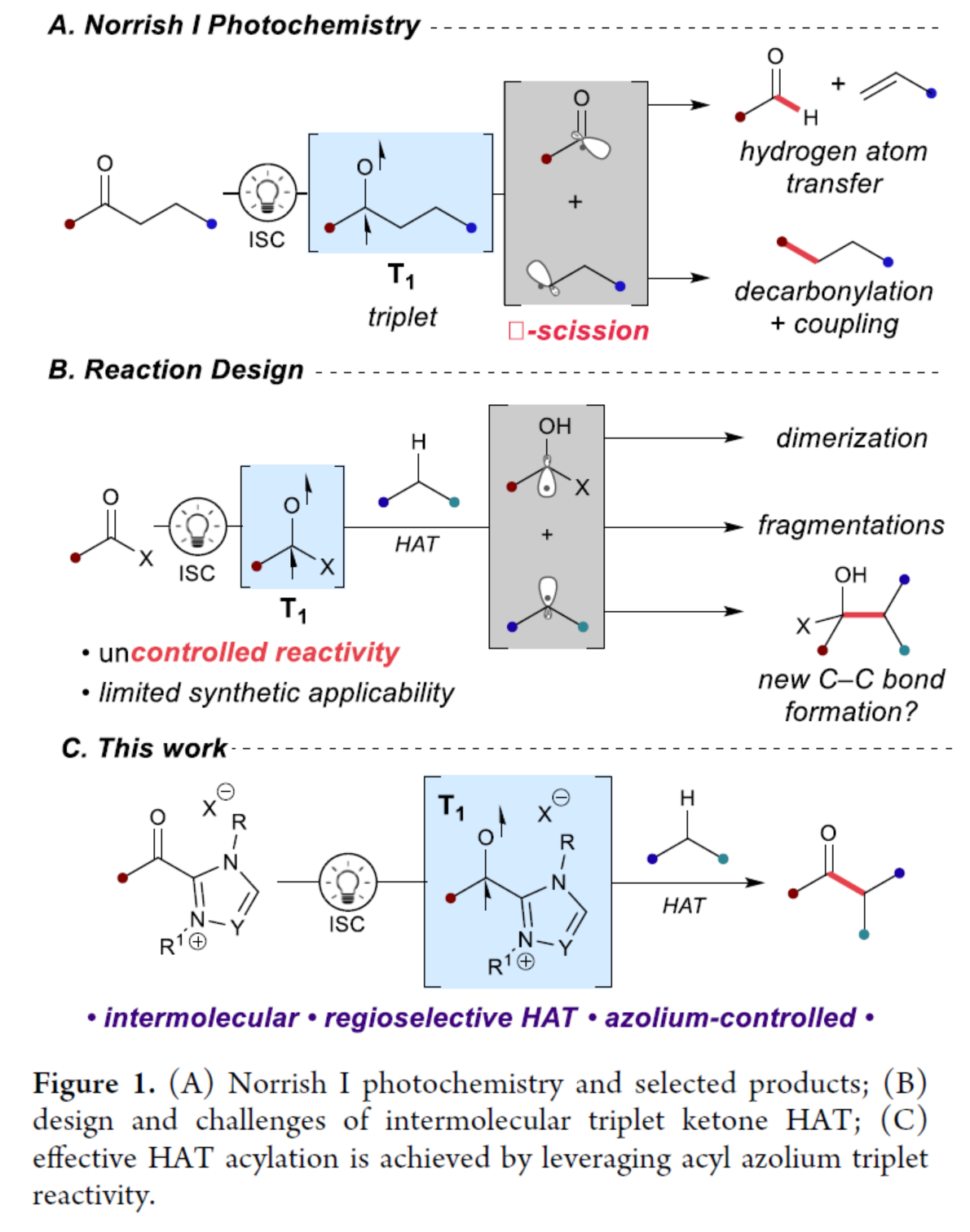
一個(gè)多世紀(jì)以來,光驅(qū)動化學(xué)轉(zhuǎn)化的能力一直吸引著合成化學(xué)家的注意。1885年,Klinger、Ciamician和Silber團(tuán)隊(duì)首次報(bào)道了有機(jī)光化學(xué)的反應(yīng),如酮類化合物的光還原反應(yīng)。其中,芳香酮的乙醚溶液暴露于日光下能夠緩慢還原為醇。從那時(shí)起,酮的光化學(xué)轉(zhuǎn)化已取得巨大的進(jìn)展。值得注意的是,早期創(chuàng)新性研究包括已發(fā)現(xiàn)的Norrish型光化學(xué)反應(yīng),其中對酮的三重態(tài)雙自由基的激發(fā)可導(dǎo)致快速且不受控制的斷裂、攫取和偶聯(lián)反應(yīng)。Norrish II和Norrish-Yang反應(yīng)源于初始分子內(nèi)氫原子轉(zhuǎn)移(HAT),并發(fā)現(xiàn)了各種合成應(yīng)用,包括天然產(chǎn)物全合成。另一方面,Norrish I型化學(xué)是通過酮輻射直接生成酰基和烷基自由基(Figure 1A)。盡管該策略為生成具有價(jià)值的自由基配合物提供了一個(gè)有吸引力的解決方案,但由于其初始自由基產(chǎn)物的反應(yīng)性不受控制而限制了其應(yīng)用。因此,能夠從Norrish型過程中提供更可控結(jié)果的策略,則更具吸引力。
在過去十年中,HAT作為一種強(qiáng)有力的鍵形成策略,從而備受關(guān)注。與其它生成自由基的方法相比,氫原子的直接攫取提供了獨(dú)特的區(qū)域和化學(xué)選擇性,并避免了對預(yù)官能團(tuán)化氧化還原活性前體的需要。類似地,三重態(tài)酮誘導(dǎo)的HAT已單獨(dú)用于催化轉(zhuǎn)化以及與過渡金屬催化結(jié)合。然而,在這些情況下,HAT生成的羰基(ketyl)自由基不會被并入最終產(chǎn)物中。
作者設(shè)想,若將這兩種光化學(xué)反應(yīng)模式相結(jié)合,可實(shí)現(xiàn)無催化劑的轉(zhuǎn)化,能夠?qū)⑼c活化C-H鍵直接連接(Figure 1B)。三重態(tài)酮驅(qū)動的分子間HAT與Norrish-Yang類自由基-自由基偶聯(lián)的結(jié)合,將為C-C鍵的形成提供一種新型的策略,但也存在二聚化、斷裂和新生成的自由基對之間發(fā)生不期望的二次HAT的問題。最近,化學(xué)家們在單電子N-雜環(huán)卡賓催化的研究中發(fā)現(xiàn),自由基氮唑鹽配合物可作為穩(wěn)定酰基自由基替代物。同時(shí),此類自由基配合物可避免常見的自由基副反應(yīng),而有利于選擇性自由基-自由基交叉偶聯(lián)。近日,美國西北大學(xué)Karl A. Scheidt與得克薩斯農(nóng)工大學(xué)Osvaldo Gutierrez團(tuán)隊(duì)利用酰基氮唑鹽作為三重態(tài)羰基試劑,實(shí)現(xiàn)了所需的HAT/偶聯(lián)反應(yīng)(Figure 1C)。首先,酰基氮唑鹽與靶底物在光照射下激發(fā)后,酰基氮唑鹽經(jīng)系間竄越后生成三重態(tài)雙自由基配合物。隨后,偶聯(lián)底物經(jīng)HAT可生成一對自由基,由于酰基氮唑鹽自由基的獨(dú)特反應(yīng)性,它可以選擇性地進(jìn)行交叉偶聯(lián)以生成所需的酮。最后,通過添加堿可以容易地釋放所需的酰化產(chǎn)物。
(圖片來源:J. Am. Chem. Soc.)
首先,作者以苯甲酰基氮唑鹽1a與N-Boc-吡咯烷2a作為模型底物,進(jìn)行了相關(guān)反應(yīng)條件的篩選(Table 1)。當(dāng)在DCE溶劑中于370 nm LEDs照射下反應(yīng)2 h后,再以DBU作為堿,在MeCN溶劑中反應(yīng)25 min,可以67%的收率得到酰化產(chǎn)物3a。

(圖片來源:J. Am. Chem. Soc.)
在獲得上述最佳反應(yīng)條件后,作者對底物范圍進(jìn)行了擴(kuò)展(Table 2)。首先,一系列N-保護(hù)的胺底物,均可順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物3a-3p,收率為34-93%。其次,一系列不同電性取代的芳基氮唑鹽,也與體系兼容,獲得相應(yīng)的產(chǎn)物3q-3aa,收率為40-69%。此外,四氫萘、環(huán)戊烯和二芐基醚衍生物,也是合適的底物,獲得相應(yīng)的產(chǎn)物5a-5c,收率為57-68%。同時(shí),該策略還可用于降脂藥苯扎貝特的后期修飾,可以83%的收率得到芐基酮產(chǎn)物5d。

(圖片來源:J. Am. Chem. Soc.)
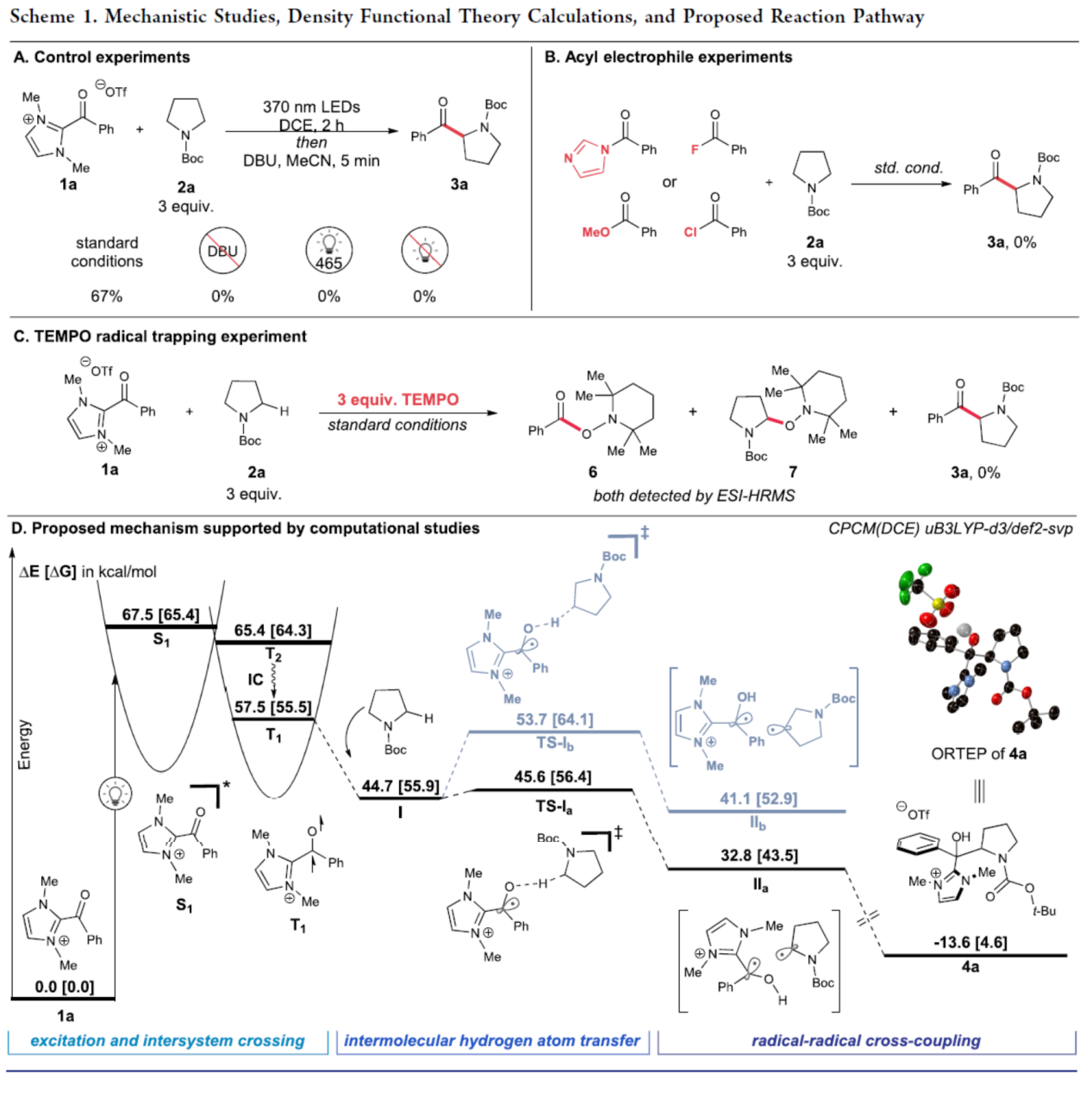
最后,作者對反應(yīng)機(jī)理進(jìn)行了進(jìn)一步的研究(Scheme 1)。首先,控制實(shí)驗(yàn)表明,酰基氮唑鹽的激發(fā)是反應(yīng)的關(guān)鍵(Scheme 1A)。UV/vis光譜研究表明,酰基氮唑鹽不會吸收超過400 nm的光。同時(shí),在酰基氮唑鹽1a和N-Boc-吡咯烷2a反應(yīng)時(shí),UV/vis吸收譜沒有發(fā)生變化,從而排除了形成電子供體-受體配合物的可能性。在1a與2a的反應(yīng)體系中無DBU時(shí),未能獲得所需的產(chǎn)物,進(jìn)一步支持了在后處理時(shí)釋放所需酮的中間體的存在。其次,當(dāng)使用其它的酰基親電試劑替代1a時(shí),未能獲得所需的酮產(chǎn)物3a,從而表明酰基氮唑鹽的酰化反應(yīng)性是獨(dú)特的(Scheme 1B)。此外,通過自由基捕獲實(shí)驗(yàn)表明,反應(yīng)形成了兩種自由基,并且TEMPO抑制了自由基酰化過程(Scheme 1C)。基于上述的實(shí)驗(yàn)以及相關(guān)的理論計(jì)算,作者提出了一種合理的反應(yīng)機(jī)理(Scheme 1D)。首先,酰基氮唑鹽1a在紫外或UVA照射下可達(dá)到單線態(tài)激發(fā)態(tài)S1。S1經(jīng)系間竄越后,生成三重態(tài)激發(fā)態(tài)(T2),其經(jīng)快速地分子內(nèi)轉(zhuǎn)化后可生成最低能量三重態(tài)激發(fā)態(tài)T1。值得注意的是,對優(yōu)化的T1結(jié)構(gòu)的分析表明,自旋密度主要位于氧原子上,與HAT步驟中選擇性的O-H鍵形成(vs C-H)一致。與觀察到的酰化的高區(qū)域選擇性一致,N-Boc-吡咯烷的α-氨基C-H鍵中的氫原子攫取通過一個(gè)小的能壘(TS-Ia),而HAT在β-位的能壘(TS-Ib)要高得多。這種能量差異和相應(yīng)的選擇性與文獻(xiàn)報(bào)道的極性匹配和失配HAT動力學(xué)一致,并反映了形成的自由基對的相對穩(wěn)定性(IIb vs IIa)。最后,從自由基對IIa中,經(jīng)自由基-自由基交叉偶聯(lián)可以迅速生成叔醇4a,其經(jīng)進(jìn)一步處理后可生成產(chǎn)物3a。
(圖片來源:J. Am. Chem. Soc.)
總結(jié)
美國西北大學(xué)Karl A. Scheidt與得克薩斯農(nóng)工大學(xué)Osvaldo Gutierrez團(tuán)隊(duì)開發(fā)了一種利用穩(wěn)定的酰基氮唑鹽,實(shí)現(xiàn)了光誘導(dǎo)活化C-H鍵的直接酰化反應(yīng)。該過程無需要使用任何催化劑,并利用酰基氮唑鹽三重態(tài)激發(fā)態(tài)的獨(dú)特反應(yīng)性。通過簡單的照射,酰基氮唑鹽可以很容易生成三重態(tài)雙自由基,其可經(jīng)高度區(qū)域選擇性的氫原子轉(zhuǎn)移和隨后的自由基-自由基偶聯(lián),從而獲得四面體中間體。隨后,通過簡單的堿處理后,可獲得所需的酮產(chǎn)物。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn