



(圖片來源:Angew. Chem. Int. Ed.)
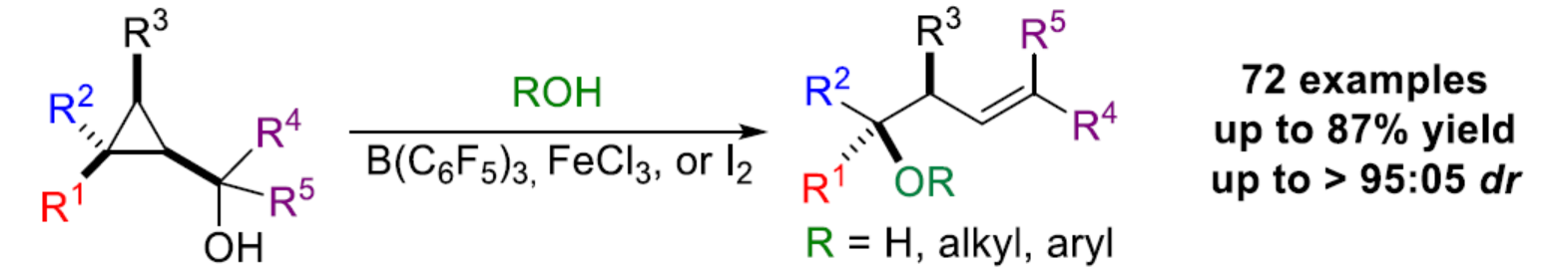
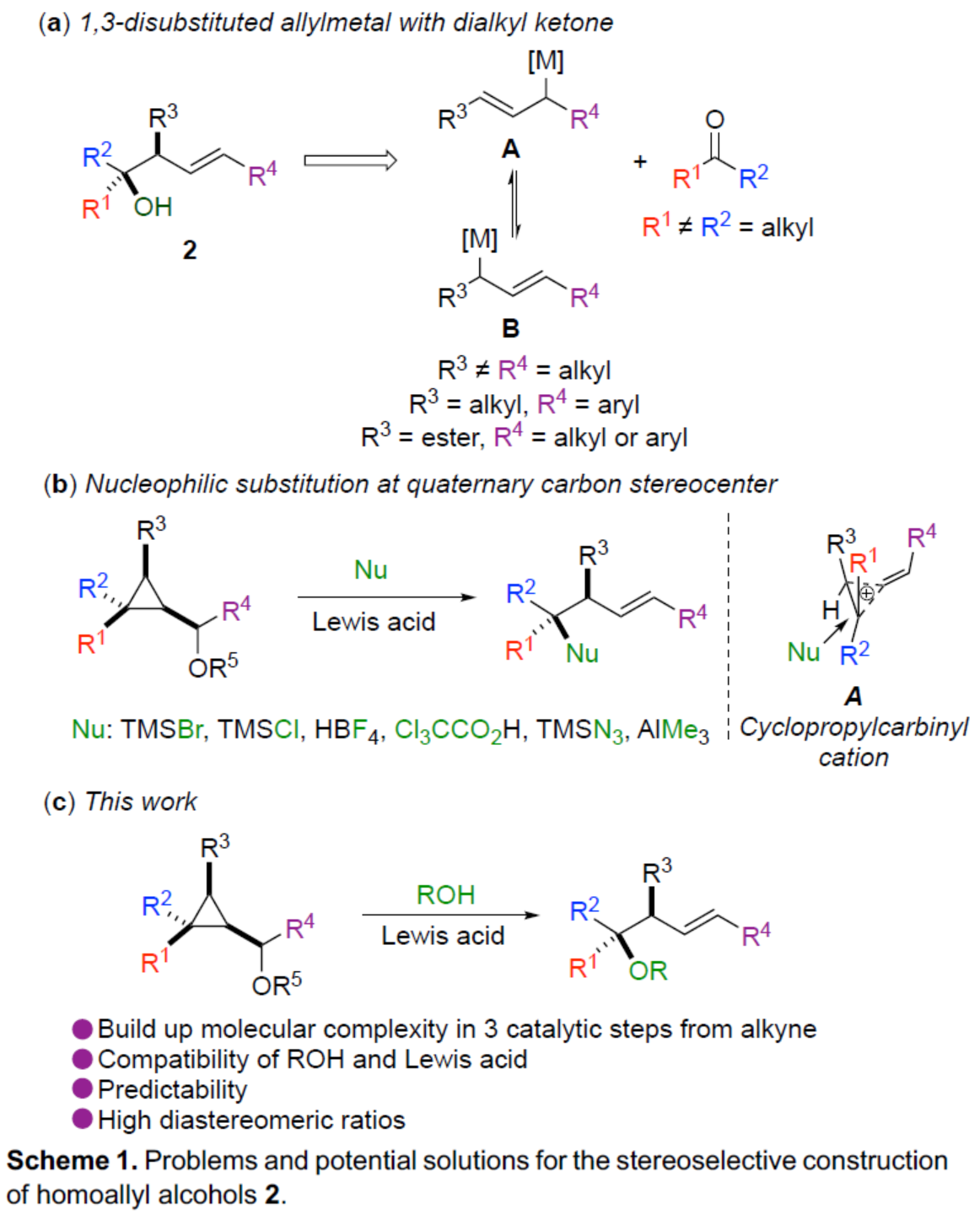
在過去的幾十年中,化學家們已經投入了大量精力來控制構建具有手性中心序列的開鏈(open-chain)分子砌塊,例如聚酮類天然產物。在廣泛研究的幾種策略中,烯丙基金屬試劑與羰基的加成占據了主導的地位。這一成功的關鍵特征是可預測性水平、高非對映和對映選擇性、潛在試劑的金屬基多樣性、高烯丙醇產物的潛在功能性。盡管該領域已取得一定的進展,但對于1,3-二取代烯丙基金屬的反應性控制仍具有難度(Scheme 1a)。當R3和R4是兩個相似的烷基時(R3≠R4= alkyl),如何控制其中一種親金屬(metallotropic)的平衡,則極具挑戰(zhàn)性。最近,Ilan Marek課題組(J. Am. Chem. Soc. 2020, 142, 5543; J. Am. Chem. Soc. 2022, 144, 7066; Chem. Sci. 2020, 11, 9378; Angew. Chem. Int. Ed. 2022, 61, e202203673.)報道了在Lewis酸存在下,一系列親核試劑(TMSX、Cl3CCO2H、TMSN3、HBF4和R3Al)能夠促進多取代環(huán)丙基甲醇(和環(huán)丙基酮)中取代最多的碳中心進行選擇性的開環(huán)(Scheme 1b)。同時,理論計算研究表明,非經典的環(huán)丙基甲基(cyclopropylcarbinyl)陽離子A是一種穩(wěn)定的中間體,其在最多取代的季碳中心以立體反轉的方式進行親核取代反應。當使用該策略用于高烯丙基醇2的合成時,需在Lewis酸存在下,contra-intuitiv加入水(或醇)。然而,許多反應性中間體和催化劑均被水分解,特別是在水中不穩(wěn)定且不相容的Lewis酸。
(圖片來源:Angew. Chem. Int. Ed.)
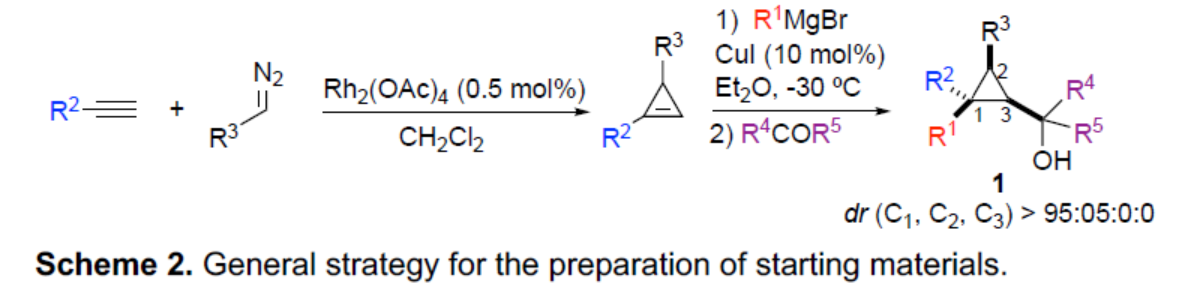
近年來,使用水作為氧源用于高度立體選擇性構建C-O鍵的新方法,極具吸引力。盡管現在越來越多的有機轉化可在水中順利進行反應,作者認為,在水存在下,強Lewis酸B(C6F5)3通常用于促進形成高活性陽離子催化劑用于烯烴聚合。在這種情況下,水與B(C6F5)3配位以生成新的配合物,該配合物可成為強Bronsted酸,可促進醇的活化。近日,Ilan Marek課題組報道了一種高效的策略,僅需三個催化步驟,即可從易得的炔烴底物中合成一系列具有價值的手性三級高烯丙基醇和醚衍生物。其中,前兩步反應涉及Rh-催化的環(huán)化反應以及Cu-催化的加成反應(Scheme 2)。同時,通過上述兩步反應,可在環(huán)丙基甲醇衍生物1中的C1、C2和C3-位形成為單個非對映體,dr(C1:C2:C3) > 95:05:0:0。值得注意的是,甲醇中心的立體化學對轉化的最終立體化學結果沒有影響。
(圖片來源:Angew. Chem. Int. Ed.)
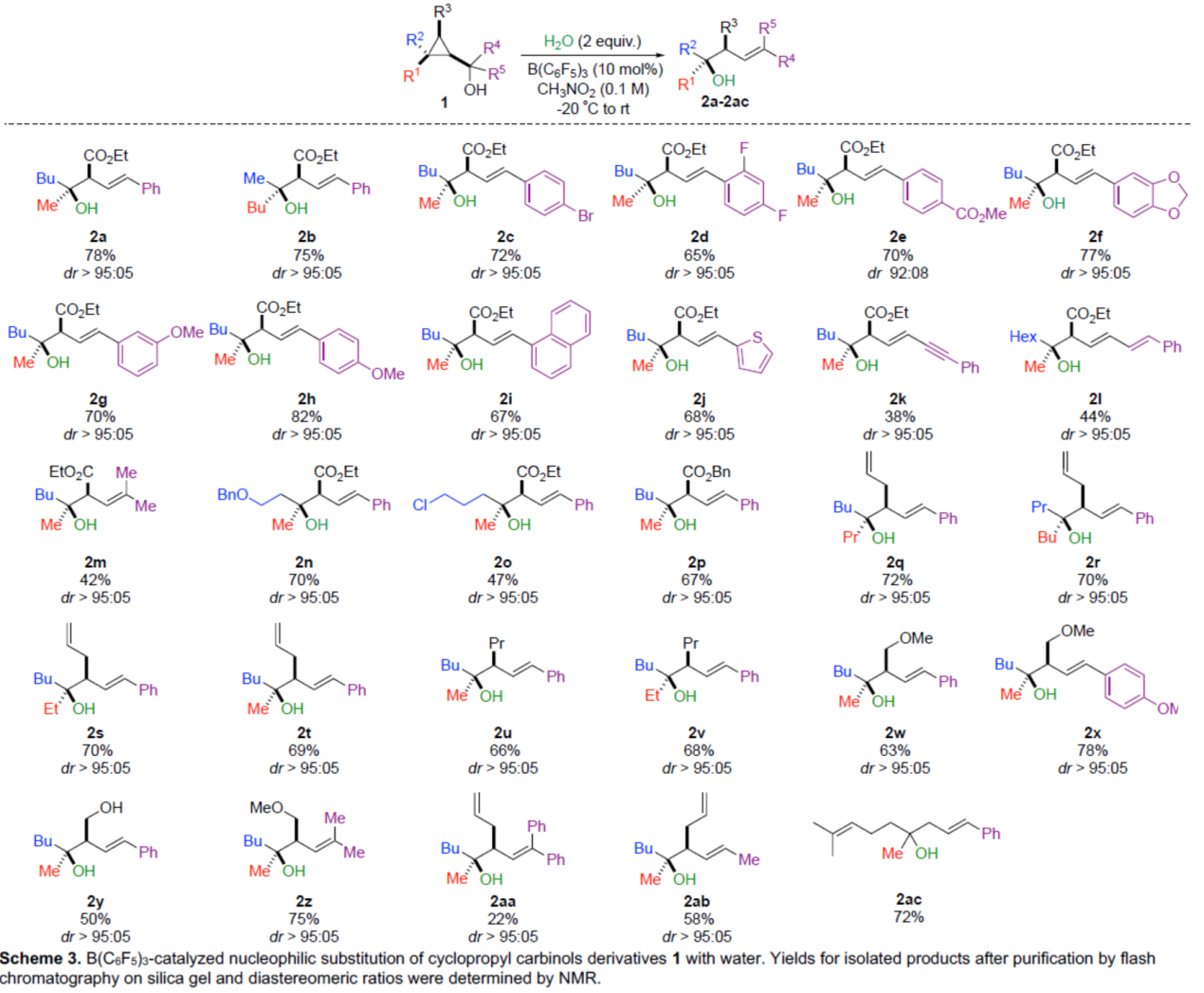
首先,作者以1a作為模型底物,進行了相關反應條件的篩選。當以B(C6F5)3作為催化劑,H2O作為親核試劑,在CH3NO2溶劑中室溫反應12 h,可以78%的收率得到產物2a,dr > 95:05。重要的是,親核取代僅發(fā)生在季碳手性中心上,并且通過形成環(huán)丙基甲基(cyclopropyl carbinyl)陽離子A從而使選擇性更為合理化。
在獲得上述最佳反應條件后,作者對底物范圍進行了擴展(Scheme 3)。首先,當底物1中的R1或R2為甲基或丁基時,均可順利反應,獲得相應的產物2a-2b,收率為75-78%,dr > 95:05。當底物1中的R4或R5為不同電性取代的芳基、噻吩基、萘基時,也能夠順利反應,獲得相應的產物2c-2j,收率為65-82%,dr > 95:05。當底物1中的R4或R5為炔基、烯基、甲基時,可獲得相應的產物2k-2m,收率為38-44%,dr > 95:05。其次,當底物1中的R2為烷基時,可獲得相應的產物2n-2o,收率為47-70%,dr > 95:05。當底物1中的R3為-CO2Bn、烯基、-Pr、-CH2OMe、-CH2OH時,均可順利反應,獲得相應的產物2p-2ab,收率為22-78%,dr > 95:05。此外,由香葉醇合成的環(huán)丙基甲醇1ac,也是合適的底物,可以72%的收率得到產物2ac。值得注意是,一系列活性基團,如烯基、炔基、鹵素等,均與體系兼容。
(圖片來源:Angew. Chem. Int. Ed.)
緊接著,通過對反應條件的再次優(yōu)化后發(fā)現,當以FeCl3作為催化劑時,一系列醇和酚底物,也可順利反應,獲得相應的三級烷基醚產物(Scheme 3)。首先,當使用甲醇作為親核試劑時,可獲得相應的產物3a-3j,收率為52-87%,dr > 95:05。其次,一系列不同取代的烷基醇底物,也能夠順利進行反應,獲得相應的產物3k-3u,收率為34-65%,dr > 95:05。此外,一系列二級醇和三級醇底物,也是合適的底物,獲得相應的產物3v-3ac,收率為28-65%,dr > 95:05。同時,該策略還可以擴展到通過分子內親核取代反應合成環(huán)醚產物3ad,收率為80%,dr為90:10。值得注意的是,該反應具有出色的官能團兼容性。
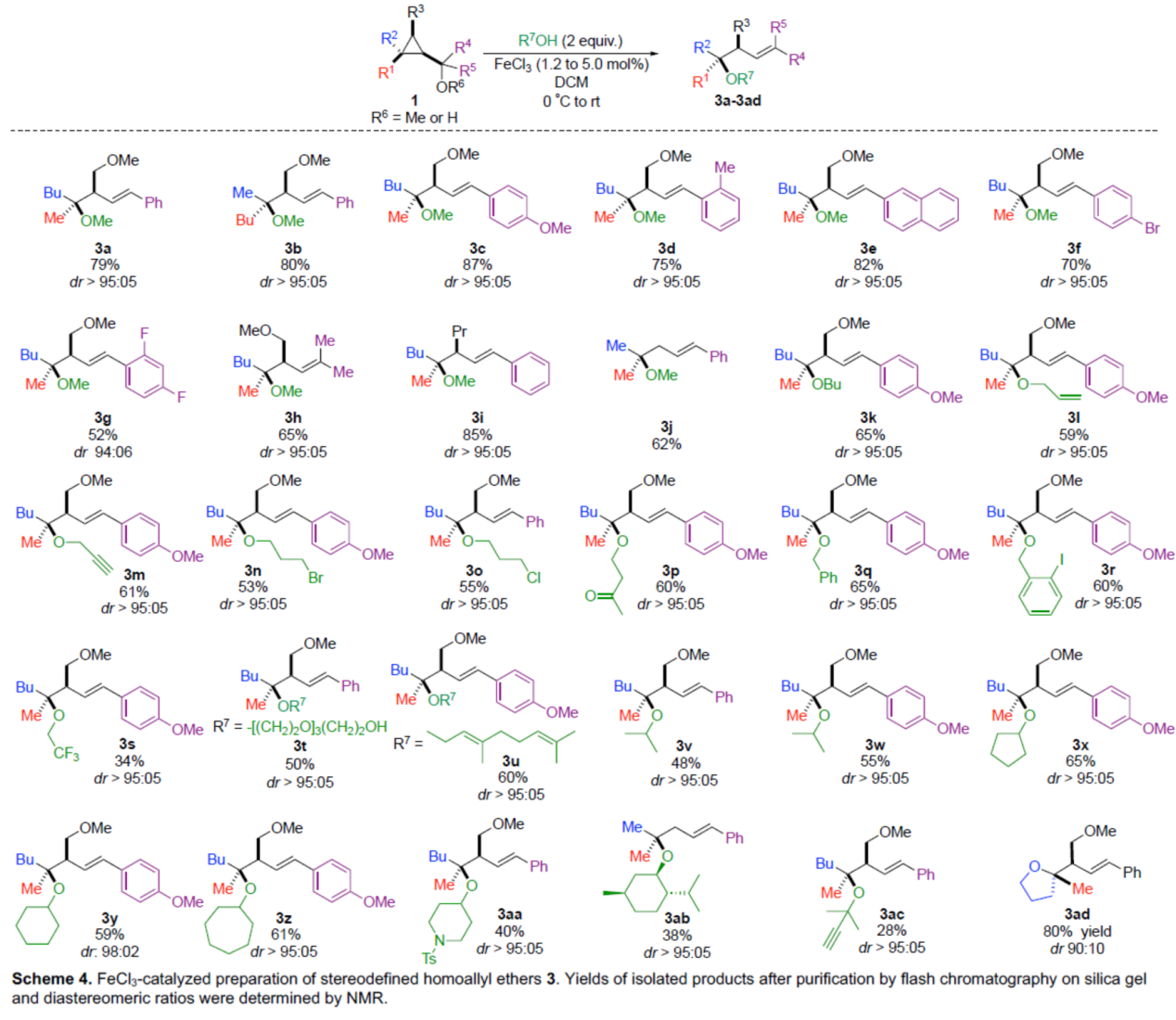
(圖片來源:Angew. Chem. Int. Ed.)
此外,當使用I2作為催化劑時,一系列具有不同電性取代的苯酚,均可與1順利反應,獲得相應的產物4a-4m,收率為38-78%,dr > 94:06(Scheme 4)。
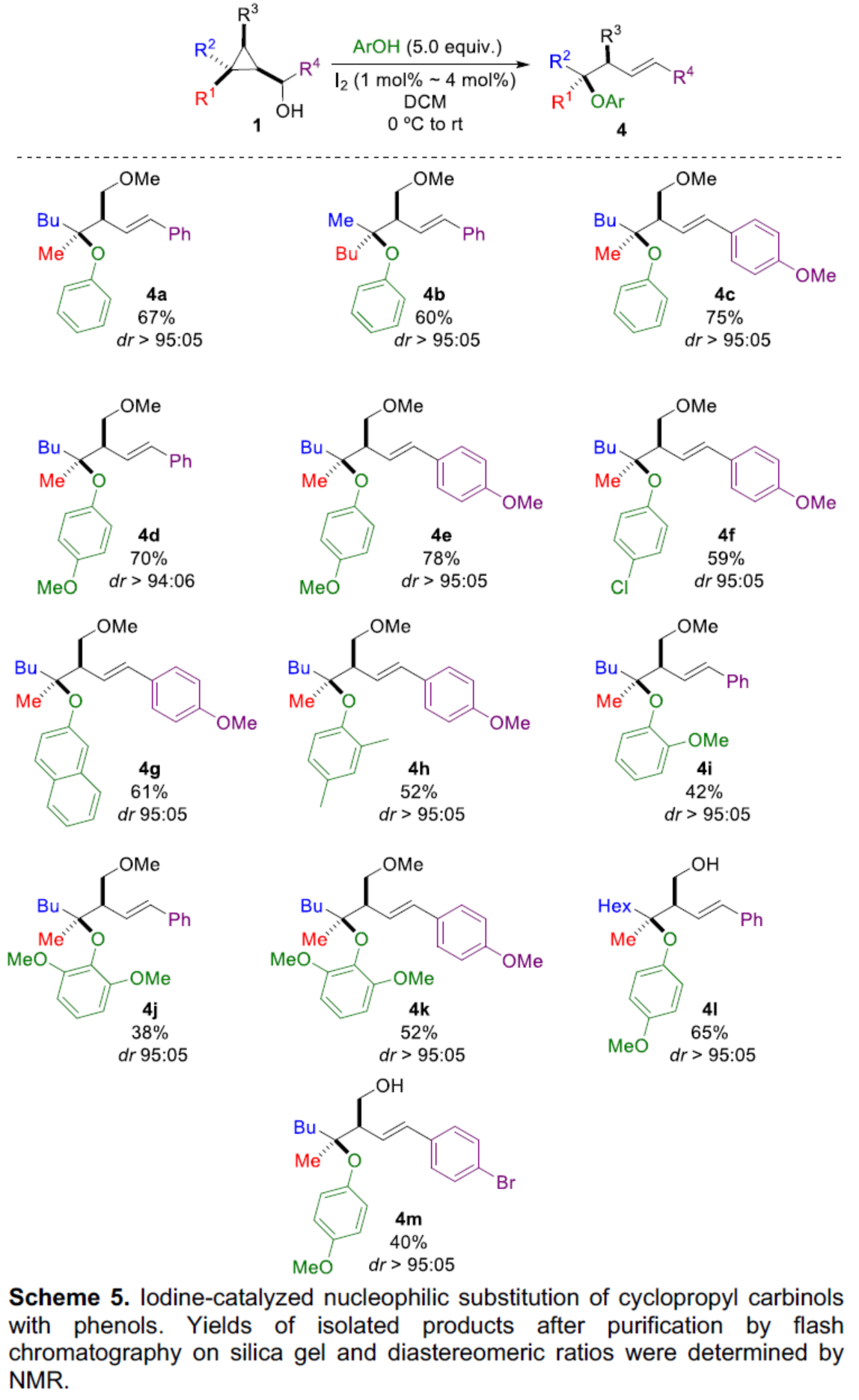
(圖片來源:Angew. Chem. Int. Ed.)
總結
以色列理工學院Ilan Marek課題組報道了一種高效的立體選擇性構建三級C-O鍵的方法,其中使用水、醇和酚作為親核試劑,涉及在環(huán)丙基甲醇衍生物的季碳手性中心處進行高度區(qū)域和立體選擇性親核取代的過程。同時,該反應具有反應條件溫和、底物范圍廣泛、官能團兼容性良好、化學選擇性出色等特點。此外,該策略是立體選擇性合成三級高烯丙基醇和醚衍生物的一種新型的途徑。
聲明:化學加刊發(fā)或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn