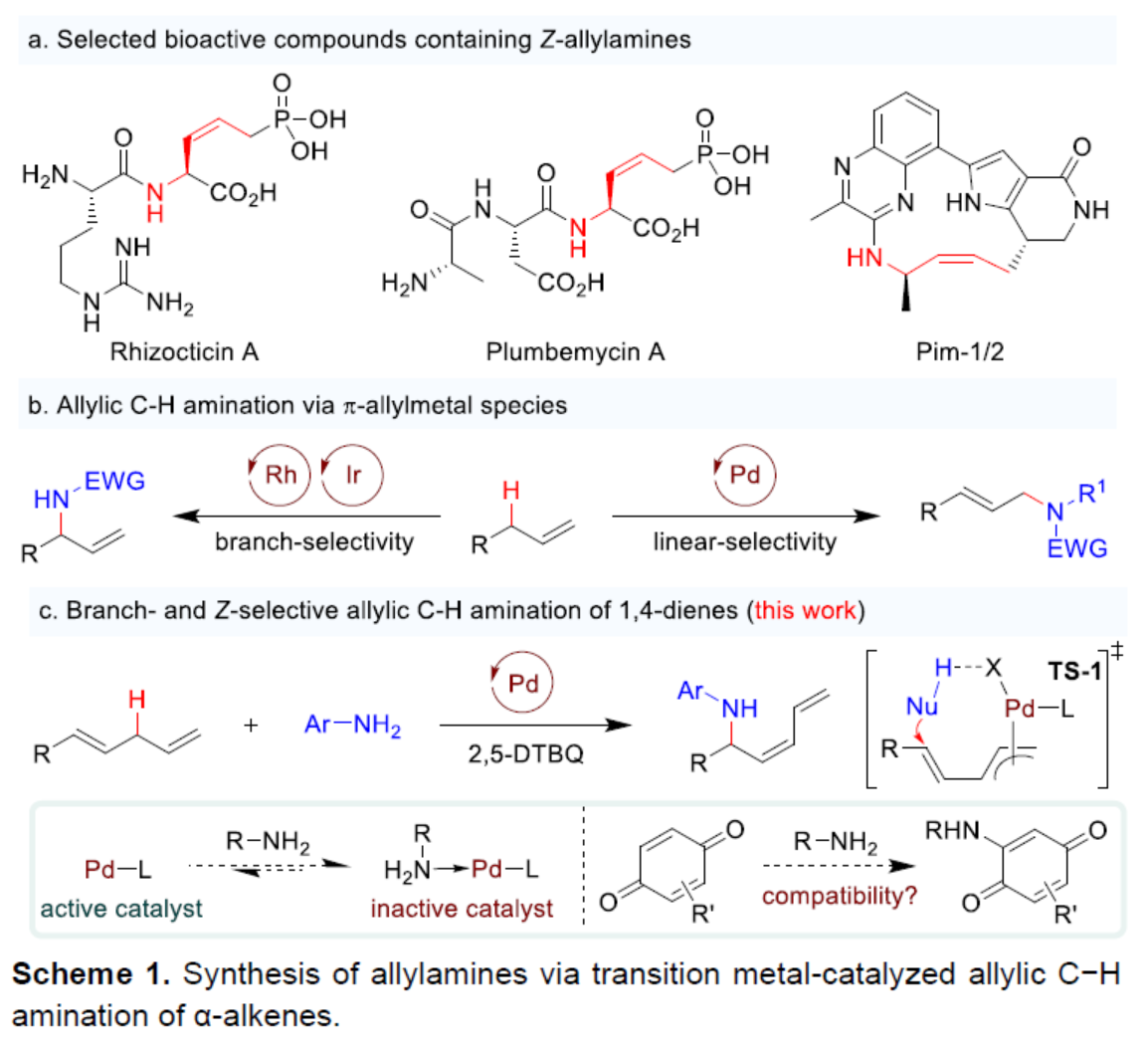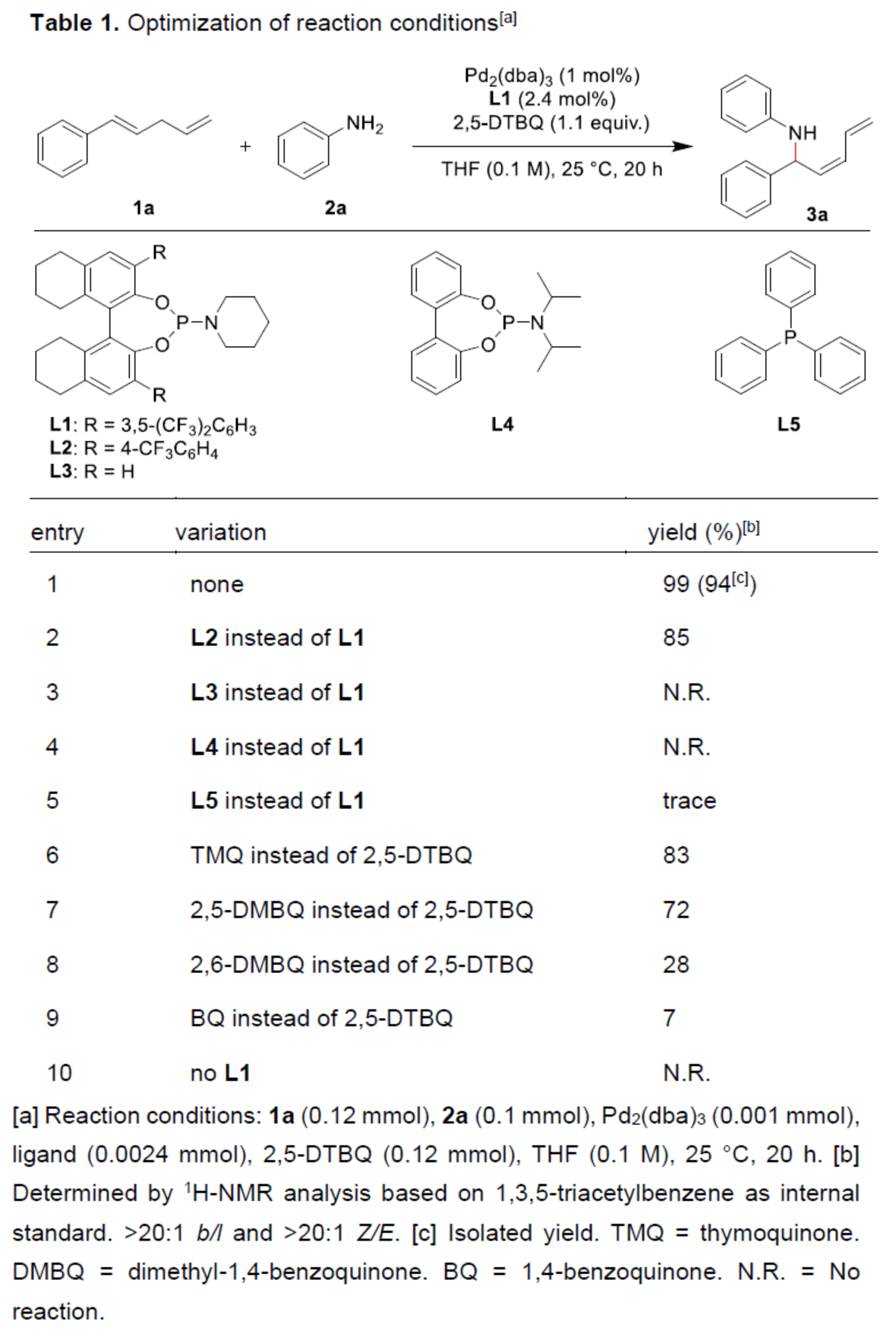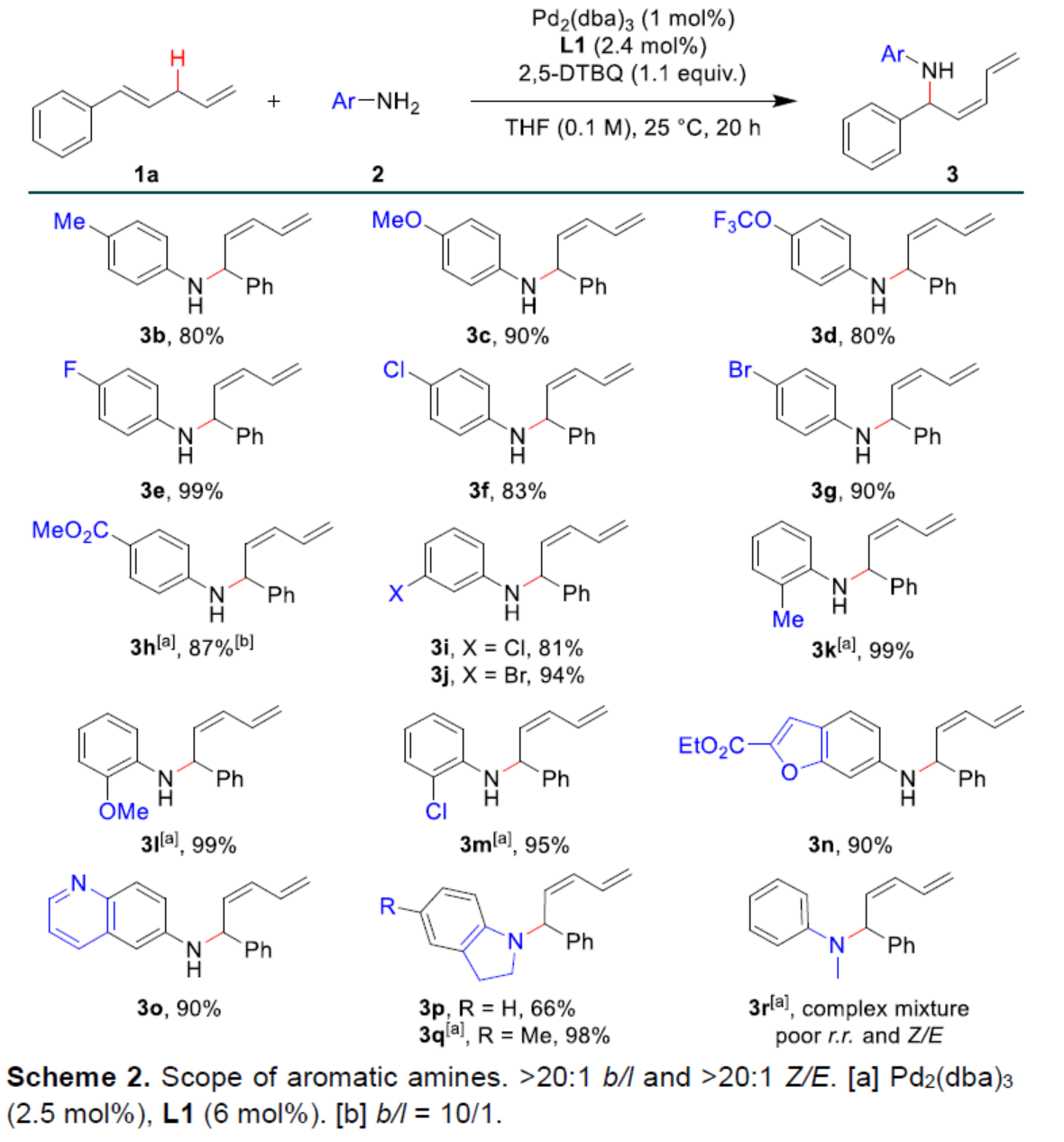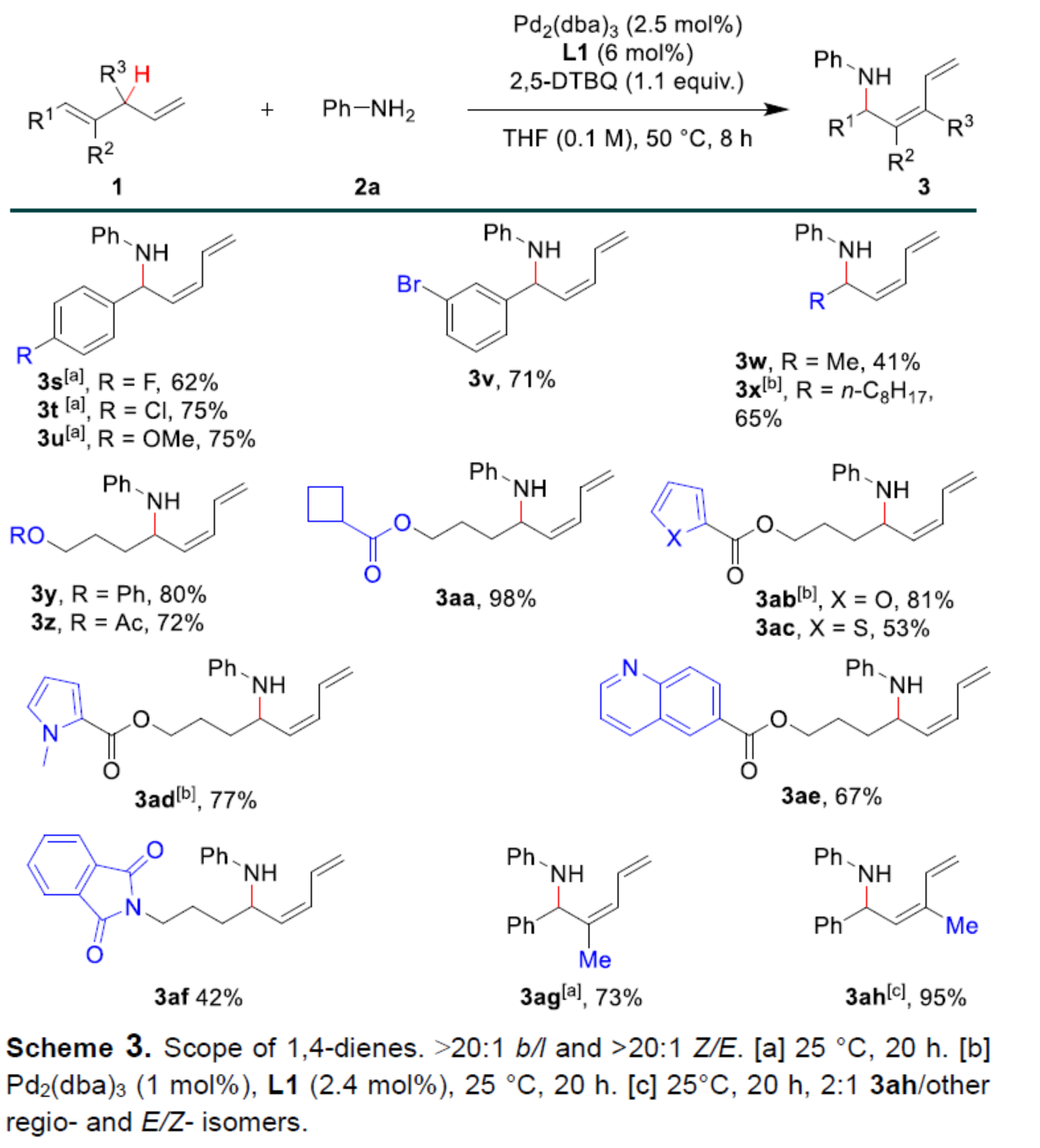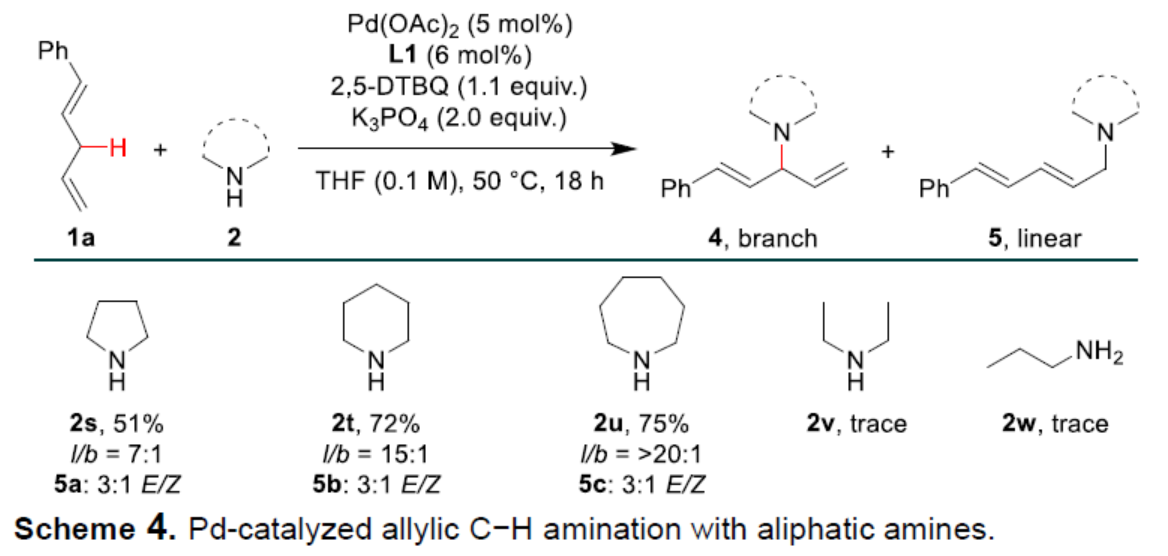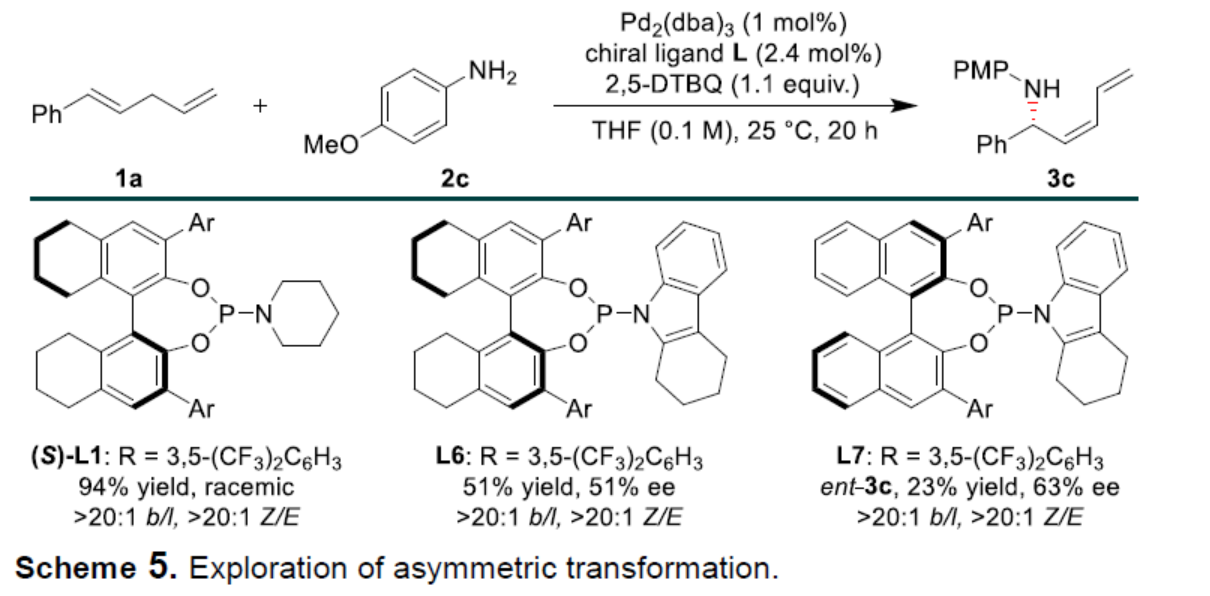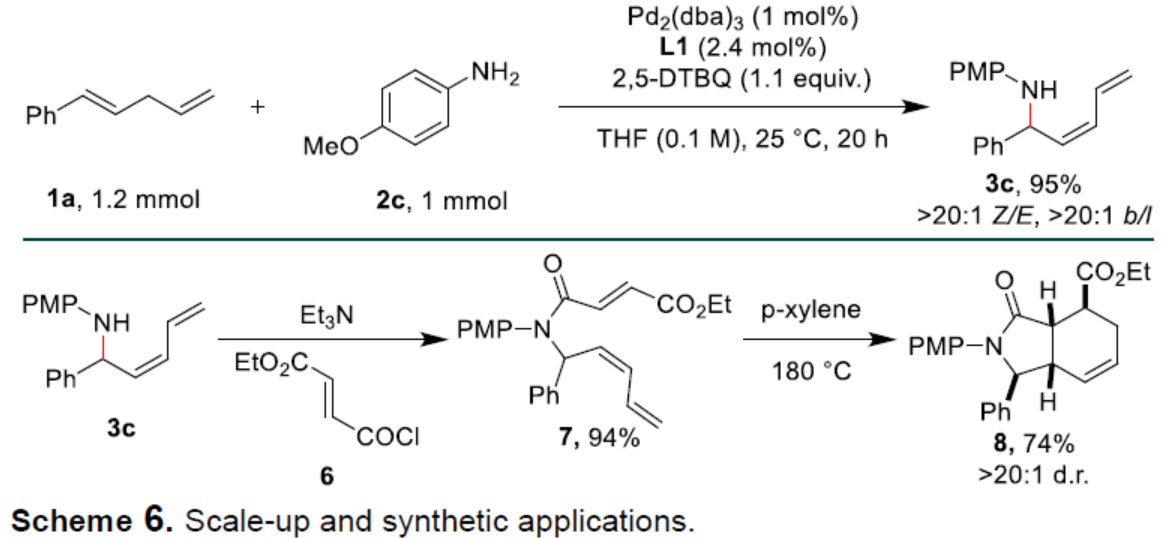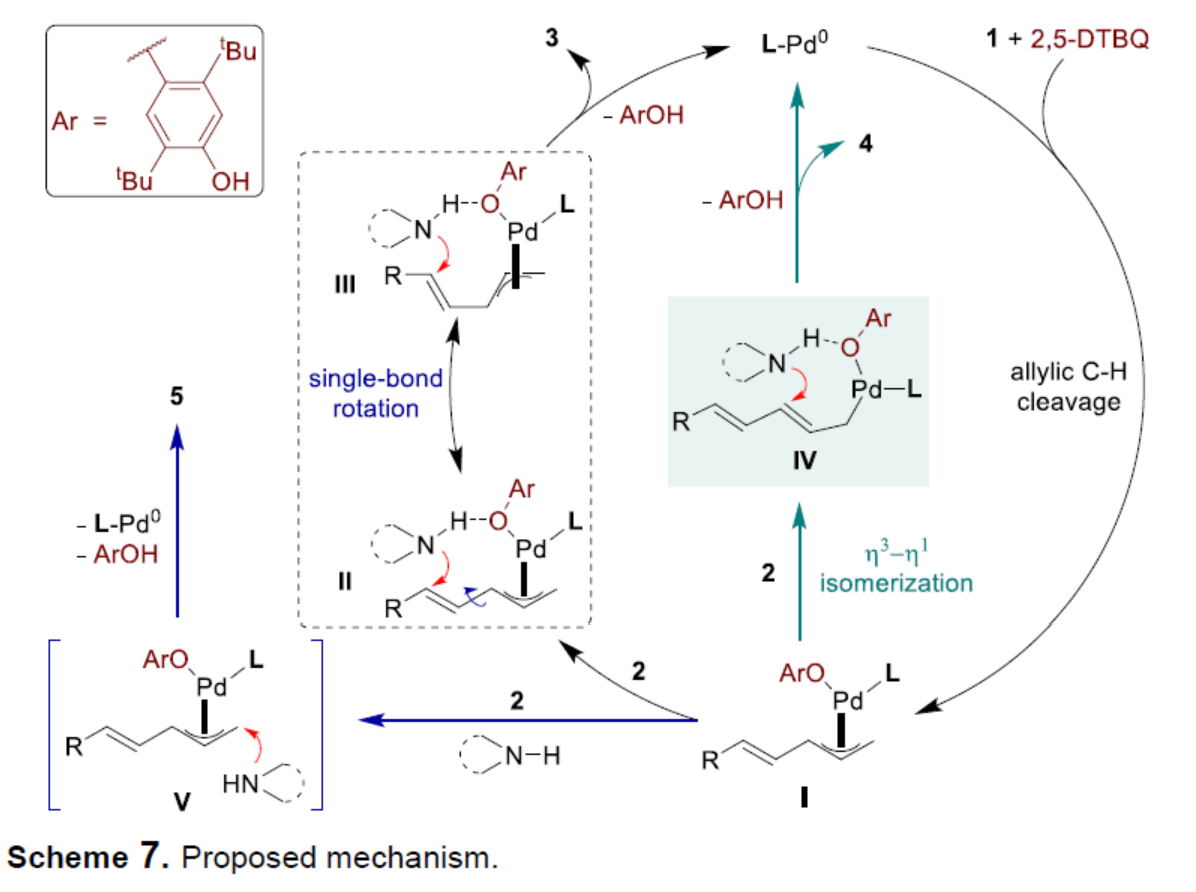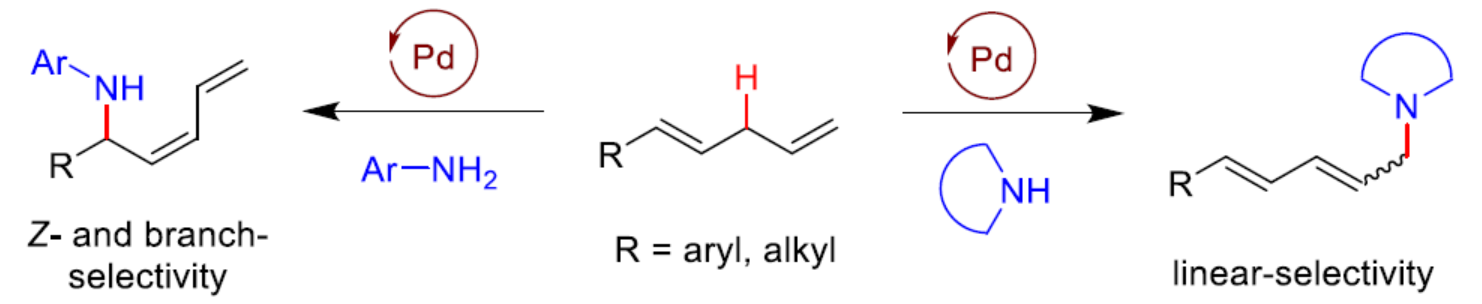
(圖片來源:Angew. Chem. Int. Ed.)烯丙基胺是一種具有重要合成意義且用途廣泛的砌塊,可合成多種生物活性化合物。其中,熱力學不穩定的Z-烯丙基胺是一些生物活性分子的關鍵結構單元,如Rhizocticin A、Plumbemycin A以及Pim-1/2等(Scheme 1a)。在過去幾十年中,化學家們已開發了多種合成烯丙基胺的方法,但通常依賴于烯丙基化試劑和氮親核試劑的交叉偶聯。過渡金屬催化的烯丙基胺化反應,可將烯丙基化底物轉化為π-烯丙基金屬配合物以構建C-N鍵,并實現相應的區域和立體選擇性控制,從而更受關注。最近,過渡金屬催化α-烯烴的烯丙基C-H胺化反應已取得重要進展,成為合成烯丙基胺的重要方法(Scheme 1b),其中通過吸電子基修飾的氮親核試劑對于C-N鍵的形成至關重要。例如,White和劉國生課題組分別報道了鈀催化磺酰胺親核試劑與α-烯烴的直鏈選擇性烯丙基C-H胺化反應。隨后,Rovis、Glorius和Blakey課題組通過Ir-或Rh-催化α-烯烴和二噁唑酮的偶聯,發展了支鏈選擇性的烯丙基C-H胺化反應。然而,烯丙基C-H鍵和胺類化合物之間的立體和區域選擇性直接胺化反應,卻較少有相關的報道。實現該類反應的難點是胺具有Lewis堿性,可以與配體或底物和金屬催化劑競爭配位,從而導致金屬催化劑中毒和失活(Scheme 1c)。另外,胺對醌的親核加成反應會消耗一些胺親核試劑和醌類氧化劑。最近,White課題組通過添加Lewis酸與胺親核試劑形成配合物,弱化胺的親核活性,從而有效地抑制了上述副反應和催化劑毒化,實現了烯丙基碳氫的胺化反應。基于前期關于鈀催化烯丙基C-H官能團化反應的研究進展(Acc. Chem. Res. 2020, 53, 2841; Angew. Chem. Int. Ed. 2017, 56, 16032; Angew. Chem. 2017, 129, 16248.),作者認為弱堿性胺(如芳香胺)可能與鈀催化劑形成較弱的配位相互作用,不會導致催化劑中毒和失活,也難以與醌基氧化劑反應。此外,芳香胺與π-烯丙基鈀中間體抗衡離子之間的氫鍵相互作用,可以促使反應通過內球過渡態(TS-1)發生,生成支鏈選擇性的烯丙基胺。近日,中科大龔流柱課題組報道了鈀催化的1,4-二烯與胺類化合物的烯丙基C-H胺化反應,獲得了一系列熱力學不穩定的Z-烯丙基胺。(圖片來源:Angew. Chem. Int. Ed.)首先,作者以1,4-二烯1a與苯胺2a作為模型底物,進行了反應條件的篩選(Table 1)。當以Pd2(dba)3作為催化劑,L1作為配體,2,5-DTBQ(2,5-二叔丁基-1,4-苯醌)作為氧化劑,在THF溶劑中25 oC反應20 h時,可以99%的收率,b/l > 20:1和Z/E > 20:1的區域和順反選擇性得到產物3a。(圖片來源:Angew. Chem. Int. Ed.)在獲得最佳反應條件后,作者對芳香胺底物2的范圍進行了擴展(Scheme 2)。一系列不同電性的取代苯胺,均可與1a順利反應,獲得相應的產物3b-3m,收率為80-99%。雜芳基胺也發生反應,獲得相應的產物3n-3o,收率為90%。此外,環狀二級芳香胺也是很好的親核試劑,獲得相應的產物3p-3q,收率為66-98%。然而,對于非環狀二級芳香胺,反應的Z/E-和區域選擇性均較差,如3r。(圖片來源:Angew. Chem. Int. Ed.)隨后作者對1,4-二烯底物1的范圍進行了擴展(Scheme 3)。當底物1中的R1為不同電性的取代芳基時,均可與苯胺2a順利反應,獲得相應的產物3s-3v,收率為62-75%。烷基取代的1,4-戊二烯也是合適的底物,獲得相應的產物3w-3x,收率為41-65%。另外,含有苯酚醚、羧酸酯以及酰胺基等官能團的底物均能順利發生烯丙基碳氫的胺化反應,得到相應的產物3y-3af,收率為42-98%。此外,(E)-(2-甲基戊基-1,4-二烯-1-基)苯以及(E)-(3-甲基戊基-1,4-二烯-1-基)苯也能參與反應,獲得相應的產物3ag-3ah,收率為73-95%。(圖片來源:Angew. Chem. Int. Ed.)1,4-二烯和脂環胺也能發生烯丙基碳氫胺化反應,但優先形成直鏈選擇性的產物(Scheme 4)。例如,以脂環胺2s-2u和1a為底物,可獲得相應的烯丙基胺產物5a-5c,收率為51-75%,l/b為7:1->20:1,E/Z為3:1。然而,非環狀二級脂肪胺親核試劑(2v和2w)未能發生反應。(圖片來源:Angew. Chem. Int. Ed.)當使用手性亞膦酰胺配體時,1a和2c發生不對稱烯丙基C-H胺化反應,但只得到中等對映選擇性的手性產物3c(Scheme 5)。(圖片來源:Angew. Chem. Int. Ed.)隨后,作者對反應的實用性進行了研究(Scheme 6)。1a和2c的克級規模反應能夠以95%收率得到產物3c,b/l > 20:1,Z/E > 20:1。3c可以進一步轉化,例如,與(E)-3-(氯甲酰基)丙烯酸乙酯6反應生成化合物7,收率為94%。7可在180oC發生立體專一性的Diels-Alder反應,以74%的收率得到雙環化合物8,dr > 20:1。(圖片來源:Angew. Chem. Int. Ed.)最后,作者提出了可能的反應機理(Scheme 7)。首先,Pd催化劑、1,4-二烯1與2,5-DTBQ經協同質子和雙電子轉移過程斷裂烯丙基C-H鍵,生成π-烯丙基鈀中間體I。其中,酚氧離子(aryloxide counterion)與芳香胺之間的氫鍵相互作用使胺親核試劑經內球過渡態II和III與π-烯丙基鈀發生SN2’-型反應。由于s-trans和s-cis二烯基構象(II與III)之間很容易通過單鍵旋轉相互轉化,且過渡態III能量上更為有利,因此獲得支鏈-和Z-選擇性產物3。π-烯丙基鈀中間體I與脂環胺之間的相互作用,可能促進了烯丙基鈀的η3至η1的異構化,經過渡態IV發生[3,3']-還原消除,得到C3-支鏈選擇性烯丙基胺4。此外,胺可經外球過渡態V與π-烯丙基鈀發生烯丙基取代反應,形成直鏈選擇性產物5。(圖片來源:Angew. Chem. Int. Ed.)中科大龔流柱/汪普生團隊發展了一類鈀催化的1,4-二烯與胺類化合物的烯丙基C-H胺化反應,獲得了一系列熱力學不穩定的Z-烯丙基胺。通過對N-雜環衍生物的快速構建,進一步證明了反應的實用性。值得注意的是,堿性較強的脂環胺在無需要任何Lewis酸添加劑的條件下,也能夠順利地參與該反應,但優先生成直鏈選擇性的烯丙基胺。此外,使用手性磷酰胺配體,可獲得光學活性的烯丙基胺。