



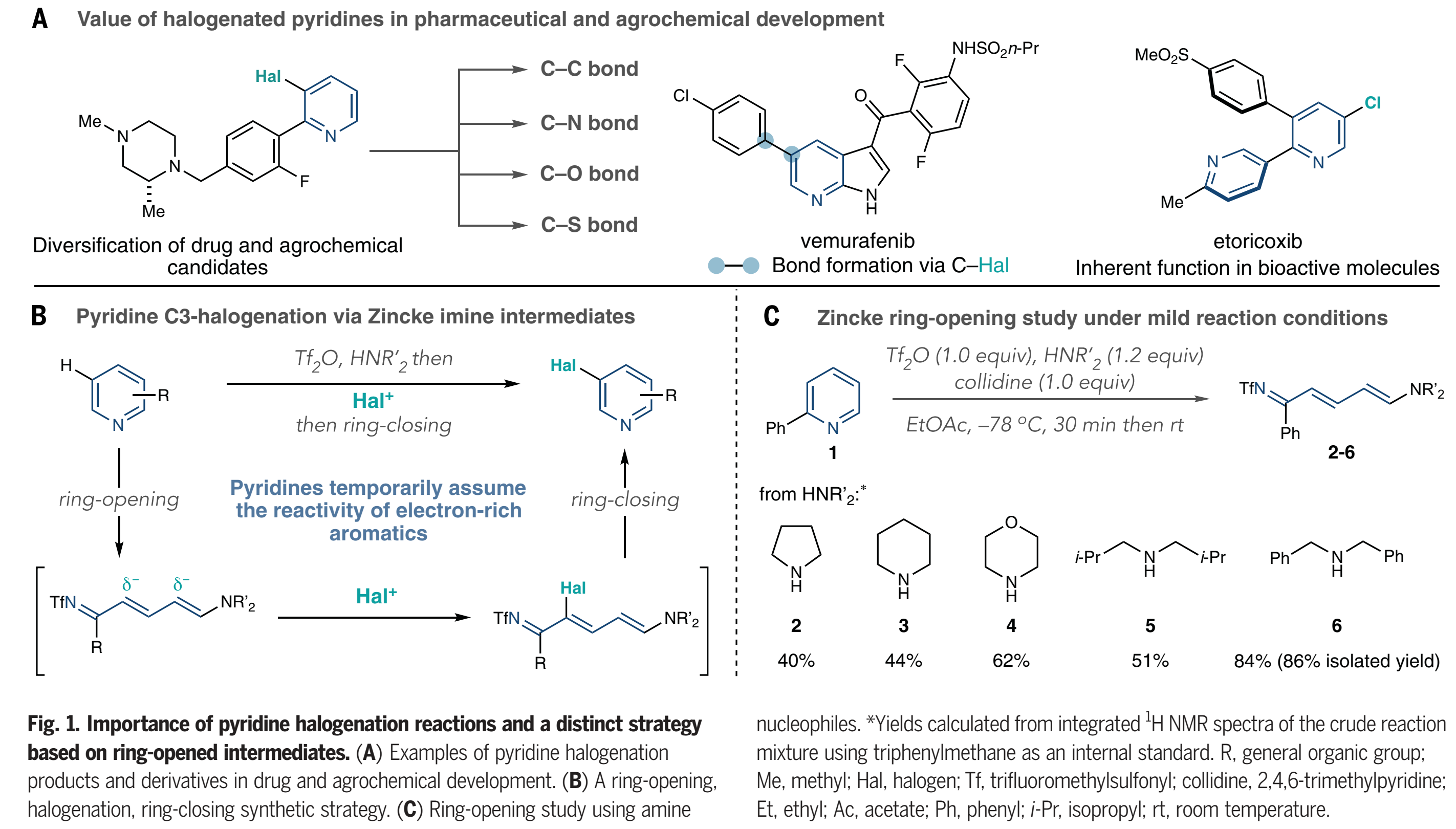
吡啶廣泛存在于具有生物活性的相關分子中,并且它們的優(yōu)勢來自雜環(huán)的內(nèi)在性質(zhì)和取代基的相互作用。因此,吡啶分子的區(qū)域選擇性C-H鹵化反應是至關重要的,因為引入的碳-鹵(C-Hal)鍵可以發(fā)生許多后續(xù)成鍵反應(Fig.1A)。在藥物和農(nóng)業(yè)化學研究中,鹵代吡啶是用于構-效關系研究和靶向合成的候選化合物多樣化的關鍵中間體,并且其在生物活性化合物如艾托考昔中也具有內(nèi)在的價值。然而,盡管早在19世紀晚期就有關于吡啶鹵化反應的報道,但該反應仍然有很大的局限性,尤其是,對于具有生物活性的一些底物中的官能團不兼容。由于電性不匹配的原因,使用親電芳香取代的吡啶鹵化反應往往需要較為苛刻的條件。具體來說,由于使用的最初的鹵源往往具有較強的Br?nsted 或者 Lewis酸性,為了彌補吡啶環(huán)上較差的π 親核性,需要提高溫度來實現(xiàn)鹵化反應,進而縮窄了底物范圍,同時還得到多種區(qū)域選擇性混合物。金屬化-鹵化策略是另外一種吡啶鹵化的方法,但這種方法往往需要導向基團。除了這兩種方法之外,在過去的一個世紀里幾乎沒有什么進展,所以合成界轉(zhuǎn)向其它多功能的官能團來代替鹵化物。值得注意的是,金屬銥催化的硼化或者硅烷基化反應,而該類反應C-3位選擇性往往是通過選擇特定的一類吡啶分子或者配體的調(diào)控。這里,作者提出了吡啶鹵化的替代方法,通過吡啶的開環(huán)、鹵化、閉環(huán)策略(Fig. 1B)。這種“一鍋”方案使用了經(jīng)典的Zincke開環(huán)反應的改進版本,將吡啶轉(zhuǎn)化為氮雜三烯中間體,或“Zincke亞胺”。這種合成策略暫時將吡啶從缺電子的雜環(huán)轉(zhuǎn)化為一系列發(fā)生親電取代反應的極化烯烴,就像富電子的芳烴一樣。
當前的Zincke開環(huán)的方法不能實現(xiàn)Fig 1B中描述的吡啶鹵化的反應過程。吡啶N-活化步驟通常需要特定條件,并且當2-位取代基存在時經(jīng)常失敗。為了解決這些限制,作者著眼于NTf-吡啶鹽的開環(huán)。這些活性中間體很容易在低溫下由吡啶和Tf2O形成,并且包括除2,6-二取代以外的大多數(shù)取代類型。Toscano等人報道了通過Tf2O實現(xiàn)開環(huán),但沒有將這一過程擴展到除吡啶以外的底物,并觀察到開環(huán)產(chǎn)物的混合物。用2-苯基吡啶(1)作為模板底物,作者考查了一系列作為親核試劑的脂肪胺(Fig. 1C)。吡咯烷、哌啶和嗎啉可以得到中等產(chǎn)率的開環(huán)產(chǎn)物,二異丁胺也是如此(2-5)。然而,最后證明二芐胺6是最佳的,并以高產(chǎn)率(86%)得到Zincke亞胺。之后,作者期望能夠直接實現(xiàn)Zincke 鹽的關環(huán)反應,然而,實例通常使用銨鹽或Br?nsted酸來獲得吡啶,這些試劑可能有助于實現(xiàn)Fig 1B中描述的一鍋反應。
(圖片來源:Science)
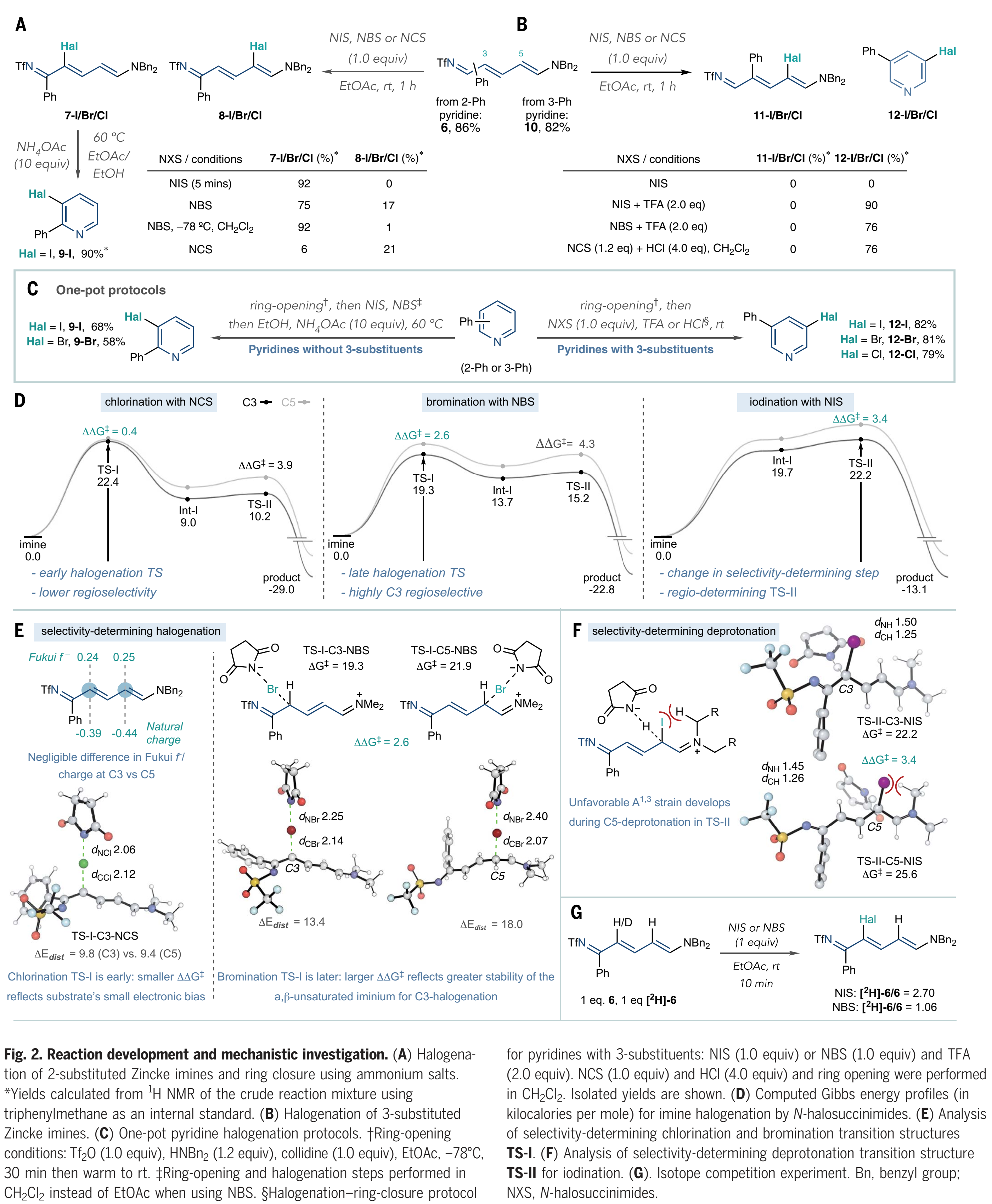
對于反應發(fā)展的下一階段,作者使用鹵素親電試劑測試了Zincke亞胺6 (Fig. 2A)。一開始,作者沒有預料到碳鹵鍵的形成會是選擇性的,因為在6中C3和C5的兩個δ-位點之間沒有明顯的電性差異。Toscano等人確實觀察到了未取代的NTf-Zincke亞胺和吡啶鎓親電試劑之間的3-選擇性反應;然而,他們沒有研究由取代的吡啶衍生的Zincke亞胺。當作者在室溫下將6與N-碘代琥珀酰亞胺(NIS)反應5分鐘時,通過氫譜他們得到92%的7-I產(chǎn)物和 > 20:1的 3-對5-選擇性(8-I)。當使用N-溴代丁二酰亞胺(NBS),作者在室溫下觀察到7-Br和8-Br的比例為4.4:1,而在-78 °C的二氯甲烷中7-Br的產(chǎn)率為92%, 選擇性大于20:1。然而當作者用氯化琥珀酰亞胺(NCS)時,氯化產(chǎn)率較低且選擇性較低(7-Cl和8-Cl ),并且它容易降解6。隨后,作者嘗試了關環(huán)的條件,發(fā)現(xiàn)在60 ℃下,在EtOAc/EtOH溶劑混合物中加入8-I和10當量的乙酸銨可以很好地形成3-碘吡啶9-I。鹵化3-取代的亞胺(Fig 2B)需要不同的條件:3-苯基吡啶開環(huán)得到Zincke亞胺10,但是NIS在室溫下無法與10反應,并且當加熱到50 ℃時分解成未知的副產(chǎn)物。然而,當作者加入兩當量的三氟乙酸(TFA)時,反應可以有效的進行,并高收率得到碘吡啶12-I。作者將這種原位再芳構化歸因于11-I中3-和5-取代基之間的空間相互作用;TFA可以促進烯烴異構化-環(huán)化過程,隨后的二芐胺的消除以及所得NTf-吡啶鹽的N-S鍵的斷裂,最終重新形成吡啶環(huán)。用NBS和TFA (12-Br)溴化可以得到相同的結果,并且使用NCS和HCl在二氯甲烷中氯化10可以有效地生成12-Cl。這些結果(Fig 2,A和B)提供了NTf-Zincke亞胺中間體的兩種鹵化方案,這取決于它們的取代方式。
接下來,作者將開環(huán)、鹵化和關環(huán)步驟合并,并實現(xiàn)一鍋法(Fig. 2C)。對于沒有3-位取代基的吡啶,例如2-苯基吡啶,需要使用二芐胺開環(huán)并用NIS或NBS進行鹵化 (Fig 2A),之后向反應混合物中加入NH4OAc和EtOH,并加熱至60 ℃誘導關環(huán),重新形成吡啶9-I和9-Br。在鹵化步驟后加入1當量的三甲氧基苯可以證明有助于在環(huán)化前淬滅任何殘留的N-鹵代琥珀酰亞胺。當存在3-位取代基時,例如在3-苯基吡啶中,開環(huán),然后加入N-鹵代琥珀酰亞胺和酸,如Fig 2B所示,包括一鍋法(12-I,12-Br和12-Cl)。這些方案不需要中間處理或純化步驟,并且不涉及向同一反應容器中按順序加入試劑。
然后,作者用量子化學在B3LYP-D3(BJ)/de F2-TZVP//ωB97X-D/6-31+G(d, p)理論水平上研究了N-鹵代琥珀酰亞胺鹵化Zincke亞胺的反應機理和區(qū)域選擇性。對于鹵代6(Fig 2D),NBn2部分簡化為NMe2,最有利的途徑由親電加成(TS-I)和隨后的去質(zhì)子化(TS-II)組成。計算表明外球電子轉(zhuǎn)移過程能量不利 (ΔG > 34 kcal mol-1)。親電鹵代反應中的區(qū)域選擇性通常被理解為前線軌道系數(shù)、原子電荷或親核性參數(shù)的差異。然而,Zincke亞胺6的C3和C5位置的電子環(huán)境在Fukui f系數(shù)(0.24 vs 0.25)、自然電荷(–0.39 vs –0.44)和HOMO系數(shù)(均為0.26)方面非常相似,這就為這種轉(zhuǎn)化中的高水平C3選擇性提供了另一種基本原理(Fig 2E)。6與NCS、NBS和NIS反應的計算能量圖(Fig 2D)表明,在每種情況下,總反應的不可逆是由動力學控制的區(qū)域選擇性所調(diào)控,ΔΔG?值與實驗結果一致。打破Zincke亞胺中的延伸共軛以形成帶正電荷的s-絡合物Int-I是吸熱的: C-Cl、C-Br和C-I形成的這種高能中間體的Grel值分別增加(分別為9.0、13.7和19.7 kcal mol-1)。這些差異產(chǎn)生了兩種不同的選擇性決定機制:不可逆的C–Hal鍵形成步驟(TS-I)決定了氯化和溴化的區(qū)域選擇性,而C–I鍵形成是可逆的,第二個去質(zhì)子化步驟(TS-II)決定了區(qū)域選擇性。C3選擇性溴化高于氯化(ΔΔG?分別為2.5和0.4 kcal mol-1),這可以根據(jù)早期和晚期過渡態(tài)的論點來理解。考慮到Zincke亞胺中C3和C5位置之間的電子相似性以及不存在明顯的分子間非共價相互作用,在早期氯化TS中幾乎沒有優(yōu)先的區(qū)域異構體。溴化通過較晚的TS進行,這導致較大的底物扭曲,并強烈傾向于在C3位置(ΔΔEdist = 4.6 kcal mol?1)。這種畸變能的差異反映了在TS-I-C3-NBS中與TS-I-C5-NBS(ΔΔG? = 2.6 kcal mol-1)相比,α,β-不飽和亞胺離子的生成更加穩(wěn)定。相比之下,碘化作用的高區(qū)域選擇性(ΔΔG? = 3.4 kcal mol-1)來自決定速率和選擇性的脫質(zhì)子化作用(TS-II)。恢復TS-II- C5-NIS的平面性導致烯胺碳取代基和碘化物之間的A1,3張力增加(Fig. 2F)。
分子間競爭實驗驗證了這些計算預測(Fig. 2G)。作者分別使用1當量的6和[2H]-6進行反應,直到混合物消耗1當量的NIS。在反應結束時測得的2.70的[2H]-6/6比例,表明6被優(yōu)先消耗,并支持理論預測的決定選擇性的去質(zhì)子化過程(Fig. 2F)。在相同條件下使用NBS,在反應結束時沒有顯示出[2H]-6和6之間的顯著差異,這與決定選擇性C-Br鍵形成一致。
(圖片來源:Science)
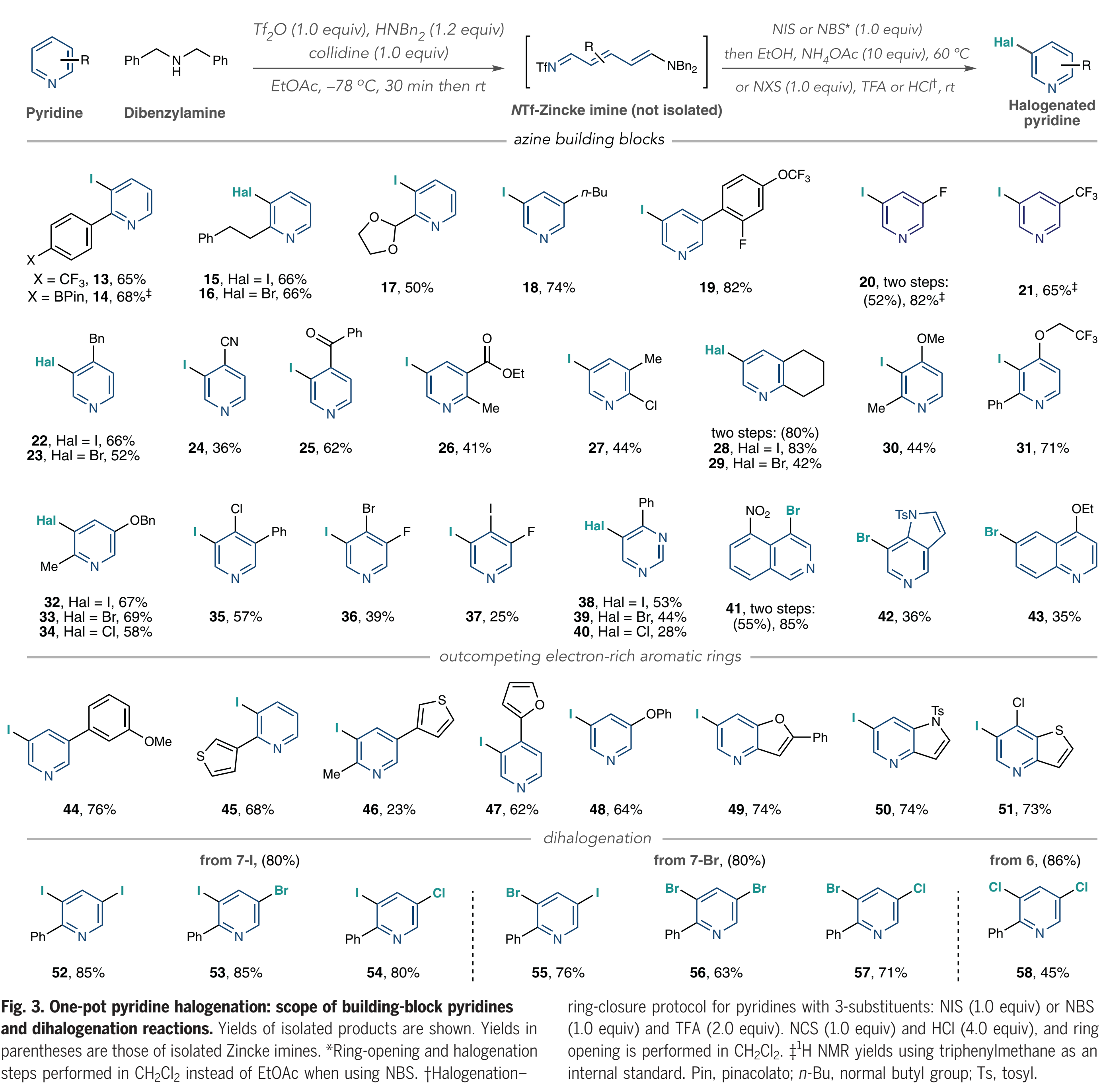
接下來,作者對底物范圍進行考察(Fig. 3)。該方法適用于在2-位具有芳基、烷基和縮醛取代基的吡啶(13-17),并且在酸介導的條件下,一系列吡啶(18-21)也可以很好地轉(zhuǎn)化。在4-位具有芐基、氰基和酮取代基的吡啶也可以有效的兼容(22-25)。然后作者實現(xiàn)了一系列2,3-,2,4-和2,5-二取代吡啶的鹵化(26-34);鹵代吡啶32-34表明Zincke亞胺中間體優(yōu)先發(fā)生并保持了3-位選擇性;作者從3,4-二取代體系(35-37)形成了一組二鹵代和三鹵代吡啶,當使用5-硝基異喹啉作為底物時,作者沒有觀察到開環(huán)產(chǎn)物,而是分離出一種去芳構化的二芐胺加成到NTf-異喹啉鹽的C1上的加合物。將該中間體進行NBS處理,然后進行TFA處理,得到4-溴化產(chǎn)物41;作者使用5-氮雜吲哚作為底物觀察到類似的中間體,得到溴化物42。接下來,作者測試了鹵化Zincke亞胺中間體是否能勝過鄰近的富電子芳環(huán),以及二鹵化過程是否可行。如Fig. 3所示,吡啶被選擇性碘化而非苯甲醚基團(44),除了起始原料之外,在粗1H NMR中僅觀察到痕量的其它化合物證明了這一點;類似地,在噻吩、呋喃和苯氧基存在下,吡啶優(yōu)先被碘化(45到48);此外,稠環(huán)系統(tǒng)中碘化作用選擇性地發(fā)生在吡啶上,如呋喃吡啶、受保護的氮雜吲哚和噻吩并吡啶(49-51)。
(圖片來源:Science)
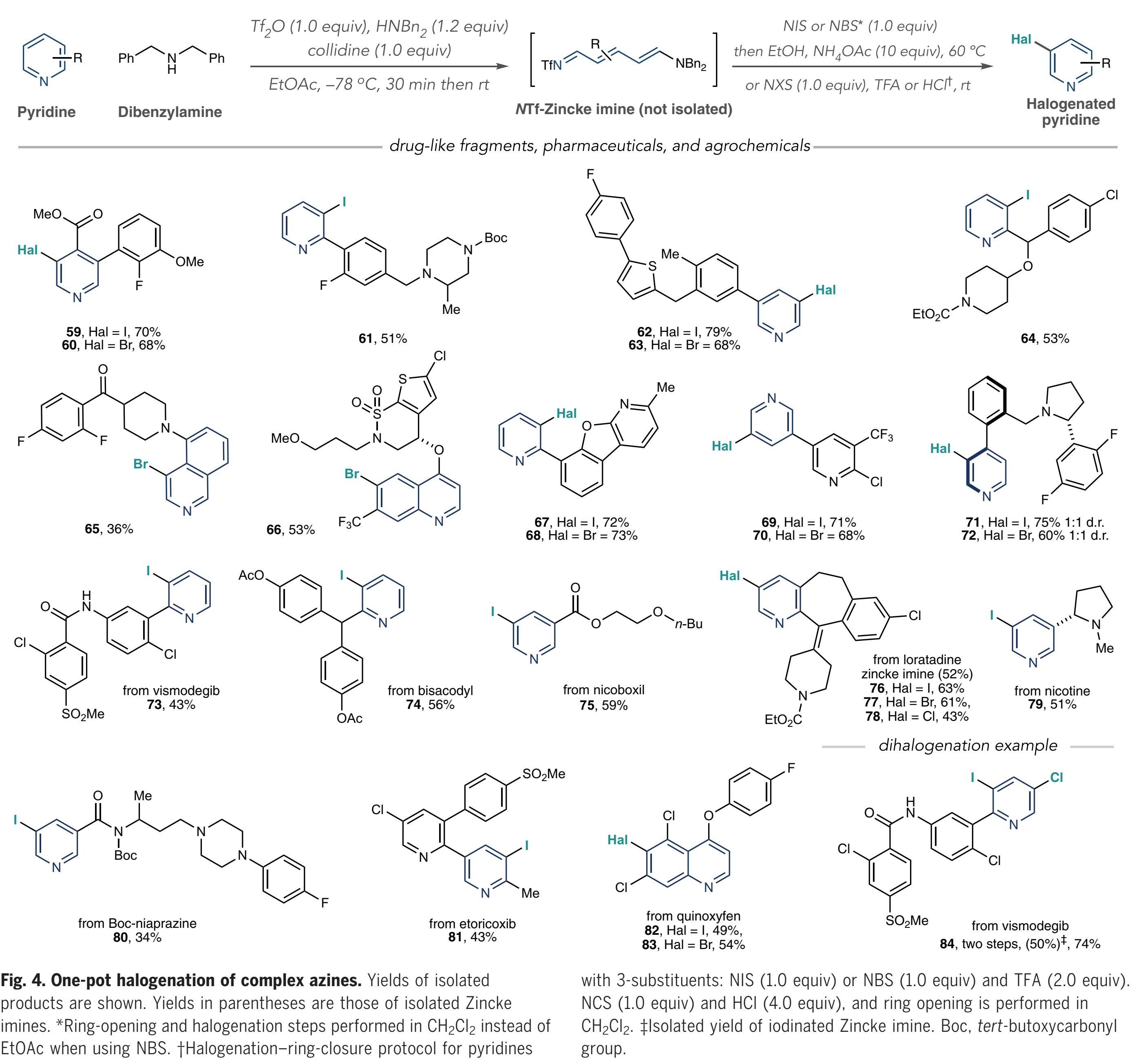
這項研究的最后階段作者側(cè)重于鹵化復雜的類藥物中間體、藥物和農(nóng)用化學品(Fig. 4). 這些結構通常含有多個(雜)芳烴、反應位點和路易斯堿性原子,因此具有一定的挑戰(zhàn)性;作者首先對藥物樣中間體的五種多環(huán)結構進行鹵化并獲得了單一的鹵化產(chǎn)物(59-65);此外,含有環(huán)磺內(nèi)酰胺的取代喹啉在C6位上再次被溴化(66);值得注意的是鹵代吡啶67到70,因為C-Hal鍵的形成發(fā)生在一個吡啶上而不是另一個吡啶上;作者認為,這種選擇性是由于在每種情況下只形成了包含較少位阻雜環(huán)的NTf-吡啶鎓鹽;吡啶71和72在一鍋鹵化過程中形成了阻轉(zhuǎn)異構體,為進一步研究軸手性提供了可能。此外,作者對維莫德吉、比沙可啶等各種藥物進行了后期碘化(73-75);在一鍋法中,氯雷他定的后期修飾具有一定的挑戰(zhàn),但是當作者分離中間體Zincke亞胺(76-78)時,可以合成碘代、溴代和氯代類似物。尼古丁、Boc-保護的尼普拉嗪、依托考昔以及喹氧靈都可以很好地被修飾(79-83)。
(圖片來源:Science)
總結 美國科羅拉多州立大學Andrew McNally和Robert S. Paton課題組通過Zincke亞胺中間體實現(xiàn)了吡啶間位選擇性C–H鹵化。該策略經(jīng)歷了吡啶開環(huán)、鹵化和關環(huán)的反應歷程,為復雜活性分子、藥物以及農(nóng)用化學品的后期修飾提供了新的替代方法。因此,該方法可以廣泛應用于藥物和農(nóng)業(yè)化學研究領域。此外,這種吡啶官能團化的方法也可能適用于其它化學鍵的構建。
聲明:化學加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn