- 首頁
- 資訊
JACS:精氨酸ADP-核糖基化:翻譯后修飾泛素蛋白的化學合成
來源:化學加原創(chuàng) 2022-11-20
導讀:近日,荷蘭萊頓大學醫(yī)學中心Dmitri V. Filippov和Gerbrand J. van der Heden van Noort團隊在JACS上發(fā)表了題為“Arginine ADP-Ribosylation: Chemical Synthesis of Post-Translationally Modified Ubiquitin Proteins”的文章,開發(fā)和優(yōu)化了用腺苷-二磷酸-核糖基(ADPr)基團制備在精氨酸殘基上修飾的肽和蛋白質(zhì)的方法。該方法包括將含有多肽的鳥氨酸與α-連接的異硫脲N-核糖苷反應(yīng),隨后在核糖基部分的5′-羥基處安裝磷酸單酯,然后轉(zhuǎn)化為二磷酸腺苷。作者使用這種方法獲得四種ADP-核糖基化泛素(UbADPr)的區(qū)域異構(gòu)體,實現(xiàn)了在泛素(Ub)蛋白內(nèi)不同精氨酸位置上的ADP-核糖基殘基修飾,是作為完全合成精氨酸連接ADPr修飾蛋白的首例報道。
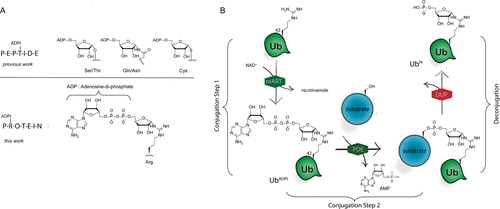
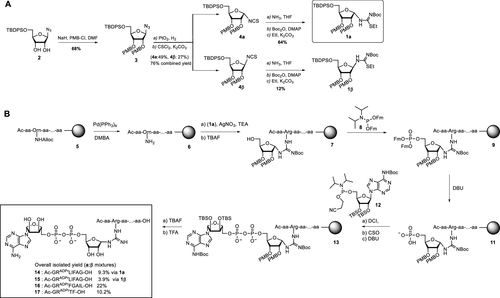
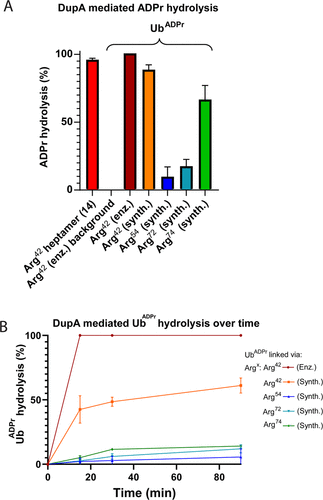
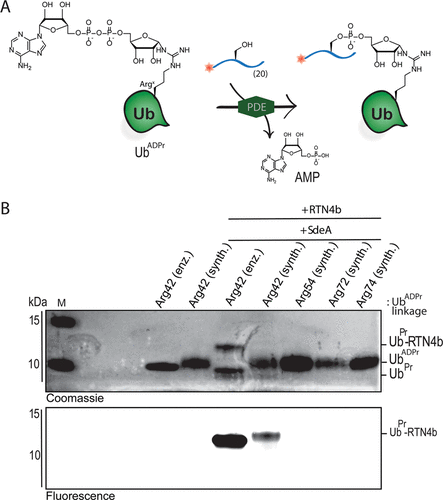
細胞內(nèi)蛋白質(zhì)的翻譯后修飾(PTM)會影響蛋白質(zhì)的功能、定位和廣泛的細胞信號傳導過程。PTM包括相對較小的基團,如磷酸鹽或甲基,但也可能涉及更復雜的分子實體,如(多)糖苷和ADP-核糖(ADPr)部分,甚至整個蛋白質(zhì),如泛素(Ub)。在ADPr的情況下,單ADP-核糖基轉(zhuǎn)移酶(mARTs)通過靶蛋白中的親核氨基酸側(cè)鏈催化煙酰胺從β-NAD中置換,從而通過α-構(gòu)型的核糖鍵有效地將ADP-核糖連接到蛋白質(zhì)。與大多數(shù)PTM一樣,ADP-核糖基化是一個高度動態(tài)的過程,特異性寫入器(mART)和橡皮擦(ADPr-水解酶(ARH))酶可以作用于特定的蛋白質(zhì)或氨基酸。精氨酸殘基的δ-胍基團的ADP-核糖基化通常由ART-C亞家族催化。軍團菌使用SidE蛋白(SdeA、SdeB、SdeC和SidE)劫持真核宿主細胞的泛素途徑,并以非常規(guī)的方式泛素化宿主細胞蛋白。這種多步驟級聯(lián)從軍團菌SidE mART結(jié)構(gòu)域開始。隨后,SidE中的磷酸二酯酶(PDE)結(jié)構(gòu)域催化宿主細胞底物蛋白的絲氨酸與精氨酸連接的Ub之間形成磷酸二酯鍵ADPr同時排出一磷酸腺苷(Fig. 1B)。通過這種方式,細菌效應(yīng)酶通過精氨酸-磷酸核糖鍵有效地將宿主Ub連接到宿主底物蛋白。Fig. 1: (A)本研究提出的進展和(B)嗜肺乳桿菌酶用于(去)泛素化宿主細胞底物蛋白的途徑的示意。(圖片來源:J. Am. Chem. Soc.)作者團隊和其他人之前已經(jīng)報道了ADP-核糖基化肽的合成,其中ADP-核糖連接到Ser、Thr或Cys、和Asn、Gln以及非天然氨基酸(Fig. 1A)。本文中,作者開發(fā)了一種普遍適用于在精氨酸上合成ADP核糖基化肽的方法,并將這種策略擴展到天然連接的ADP-核糖基化蛋白UbADPr的全化學合成。首先,作者進行了異硫脲核糖苷的合成。該化合物的合成始于5-O-((tert-butyl)-diphenylsilyl)-β-d-ribofuranosyl azide 2(Scheme 1A)。經(jīng)過嘗試,在硅藻土墊上過濾除去催化劑后,無需進一步處理或純化所得濾液即連接異硫氰酸酯。最后,分別以64%和12%的產(chǎn)率獲得核糖基異硫脲1α和1β。Scheme 1. 精氨酸連接的ADPr肽的合成方案。(圖片來源:J. Am. Chem. Soc.)得到核糖基異硫脲1α之后,作者在樹脂上進行了模型七肽14(Ac-GRADPrLIFAG-OH)的合成(B)。肽14來源于人Ub蛋白,含有已知在Arg42殘基上被嗜肺乳桿菌效應(yīng)酶ADP核糖基化的氨基酸。Nδ-Alloc保護的鳥氨酸被摻入肽序列中ADP-核糖基化位點上。經(jīng)過Alloc保護和脫保護,使用AgNO3作為路易斯酸將構(gòu)建單元1α對肽6進行胍基化修飾。LC-MS分析顯示完全轉(zhuǎn)化。接下來,對核糖基部分上的5′-OH進行脫硅烷、對伯醇進行磷化和PIII到PV氧化。對肽11的脫保護制備了用于PV到PIII與以TBS和Boc為保護基團的腺苷酰胺12偶聯(lián)。隨后,用DBU去除焦磷酸部分上的氰乙基保護基團,得到受保護的肽-ADPr 13。最后,在DCM中使用10%三氟乙酸(TFA)從樹脂中裂解肽,經(jīng)RP-HPLC純化分離出肽14(總產(chǎn)率為9.3%),這是首個合成Arg連接的ADPr肽的例子。同時,盡管用于胍基化反應(yīng)的異硫脲核糖是純α-構(gòu)型,作者通過1H NMR觀察到異構(gòu)體的混合物比例為6:4(α / β)。接下來,作者的合成方法從肽推斷到蛋白質(zhì)。化學合成Arg42UbADPr使用類似于獲得肽14的方案進行,并通過小樹脂樣品的測試裂解進行監(jiān)測。首先,經(jīng)過脫保護暴露鳥氨酸部分的胺,與1α的樹脂上胍基化反應(yīng)順利進行。隨后的磷酸化、氧化和PV–PIII偶聯(lián)產(chǎn)生完全保護的樹脂結(jié)合Arg42UbADPr。作者通過孵育UbADPr證實了這種酸在TFA(90.5%)中1.5小時的穩(wěn)定性(和庚聚體14)。使用這些條件,從樹脂中完全裂解和整體脫保護,然后進行HPLC純化,得到合成的Arg42UbADPr18的總收率為1.8%。通過在SPPS期間將Nδ-Alloc保護的鳥氨酸結(jié)合在蛋白質(zhì)的另一位置,可以直接將ADPr基團引入到Ub中的其它精氨酸殘基。作者成功地在Ub的Arg54、Arg72或Arg74上引入了UbADPr,獲得共軛物19–21,總分離產(chǎn)率分別為1.8%、1.2%和1.7%。為了研究軍團菌效應(yīng)酶(DUPs)是否能夠水解所合成的ADPr肽中的焦磷酸鹽,作者將Ub衍生的Arg-ADPr七肽14與DupA孵育,并使用1H NMR進行了表征。結(jié)果證實了合成的Arg-ADPr肽被酶的催化活性識別和加工。此外,DupA似乎更喜歡α而不是β,水解α-構(gòu)型的Arg-ADPr肽14(大約1.5 ×)比其β-異構(gòu)體更快。這也與之前的報道相一致。受到DupA處理合成ADPr肽這一事實的鼓舞,作者接下來著手比較水解速率與酶促產(chǎn)生Arg42UbADPr的水解速率。將合成的ADPr肽在緩沖溶液中在DupA存在下進行孵育,并在指定時間使用高分辨率質(zhì)譜分析(Fig. 2C)。在該水解測定中,酶Arg42UbADPr在30分鐘內(nèi)被DupA完全水解至Arg42UbPr。泛素衍生的庚聚體14和15的速率低于Arg42UbADPr,90分鐘后分別顯示48%和52%的水解。接下來,作者通過DupA孵育各自的UbADPr類似物,研究了所合成的4個UbADPr蛋白18?21的識別和水解情況,并與酶制備的Arg42UbADPr進行了比較。Arg42UbADPr在沒有DupA的緩沖液中,長時間內(nèi)不會導致水解。合成的Arg42UbADPr18和Arg42衍生的UbADPr庚聚體14幾乎完全加工,酶Arg42UbADPr也是如此。盡管Arg74UbADPr低于Arg42UbADPr,但Arg74UbADPr的水解程度明顯高于Arg54UbADPr和Arg72UbADPr。執(zhí)行類似的測定并分析較早時間點(15-90分鐘)的轉(zhuǎn)換顯示酶Arg42UbADPr15分鐘后完全水解。Arg42UbADPr在這段時間內(nèi)水解不太明顯(30分鐘后為52%)和(90分鐘后為65%)(Fig. 3B),而其它三個UbADPr通過Arg72,Arg74和Arg54連接的DupA水解明顯較少,佐證了DupA對Arg42的偏好。Arg42UbADPr可能是以與酶Arg42UbADPr相當?shù)乃俣忍幚恙?異構(gòu)體。Fig.3. DupA介導的UbADPr水解成UbPr。(圖片來源:J. Am. Chem. Soc.)作者的下一個目標是研究軍團病發(fā)病的關(guān)鍵生物過程SdeA介導的底物ER蛋白與Ub ADPr的連接。作者合成了一種20聚體肽,來源于已知是SidE效應(yīng)子底物的ER重塑RTN4b蛋白(23),在N-末端連接羅丹明熒光團。正如已經(jīng)報道的那樣,SdeA偶連Arg42UbADPr到肽23形成磷酸核糖連接Arg42Ub-RTN4b產(chǎn)物(Fig. 4A)并顯示焦磷酸鍵的部分水解至Arg42UbPr。這證實了肽23是誘導PDE介導的連接Arg42UbADPr的合適底物,并且四種合成泛素18-21也可以參與這一過程。Fig.4. SdeA介導的UbADPr連接熒光RTN4b 20-聚體片段23。(圖片來源:J. Am. Chem. Soc.)荷蘭萊頓大學醫(yī)學中心Dmitri V. Filippov和Gerbrand J. van der Heden van Noort團隊開發(fā)了在精氨酸連接ADPr肽和蛋白質(zhì)UbADPr的方法,是攜帶天然精氨酸鍵的ADP核糖基化蛋白質(zhì)的首次全化學合成。ADPr肽和ADPr泛素區(qū)域異構(gòu)體在水解和連接測定中能夠被軍團菌效應(yīng)子(DupA和SdeA)識別。在精氨酸殘基上進行定點引入ADPr的能力可以獲得生化方法無法的得到的明確定義材料,并且在水解測定中,軍團菌效應(yīng)子DupA和SdeA有利于Arg42UbADPr聯(lián)動。毫無疑問,該方法為肽和蛋白質(zhì)提供天然ADPr氨基酸連接,用于分析參與安裝和去除ADPr修飾的酶的位點特異性。
聲明:化學加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn