

(圖片來源:Nat. Chem.)
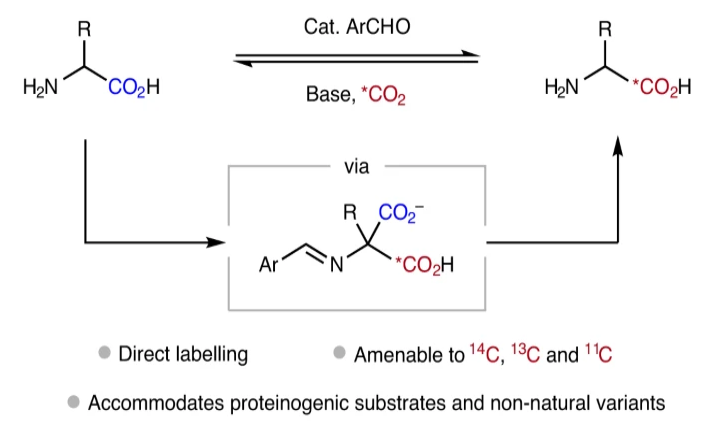
α-氨基酸是構成生命體的基本化學物質之一。同位素標記的α-氨基酸及其衍生物廣泛應用于生物化學、定量蛋白質組學、吸收分布代謝和排泄(ADME)分析中。此外,其還可以作為正電子發射斷層掃描(PET)技術的顯像劑。因此,發展簡潔高效的同位素標記方法來快速實現α-氨基酸的標記具有重要意義。而在同位素標記中,通常會更傾向于使用碳同位素標記而不是氫同位素(2H或3H),因為碳同位素不容易消除,也不會引起代謝轉移。此外,碳同位素標記分子的固有結構也不會像18F標記那樣發生改變。盡管經過了70多年的研究,含有碳同位素α-氨基酸的合成仍然具有很大的挑戰性。其通常涉及將*C引入到分子前體中,然后進行多步合成來實現(Fig. 1a)。
二氧化碳是所有碳同位素標記試劑的主要來源。目前由于缺乏有效的*CO2捕獲方法,因此現階段很難在分子后期標記應用過程中使用*CO2來進行標記。
自然界通常利用脫羧酶來促使α-氨基酸釋放CO2,其通過與磷酸吡哆醛縮合可以將氨基酸轉化為希夫堿(亞胺)(Fig. 1b)。而利用小分子催化α-氨基酸的脫羧過程也是可以進行的,但其通常僅在高溫(150 °C)下發生,因此制約了其與*CO2的羧基交換反應的發展。因此,發展在溫和條件下,利用*CO2實現α-氨基酸的C1標記具有重要意義。
基于由α-氨基酸衍生的亞氨基羧酸會在D2O存在時傾向發生α-H/D交換過程,以及在多種情況下會發生可逆的脫羧過程。最近,加拿大渥太華大學(University of Ottawa)Benjamin H. Rotstein和阿爾伯塔大學(University of Alberta)Rylan J. Lundgren課題組發展了在簡單的芳基醛催化下,利用*CO2實現了α-氨基酸的C1標記過程。反應對大多數蛋白質氨基酸以及非天然氨基酸底物均可兼容。值得注意的是,利用此方法可以有效實現14C,13C或11C的標記(Fig. 1c)。
(圖片來源:Nat. Chem.)
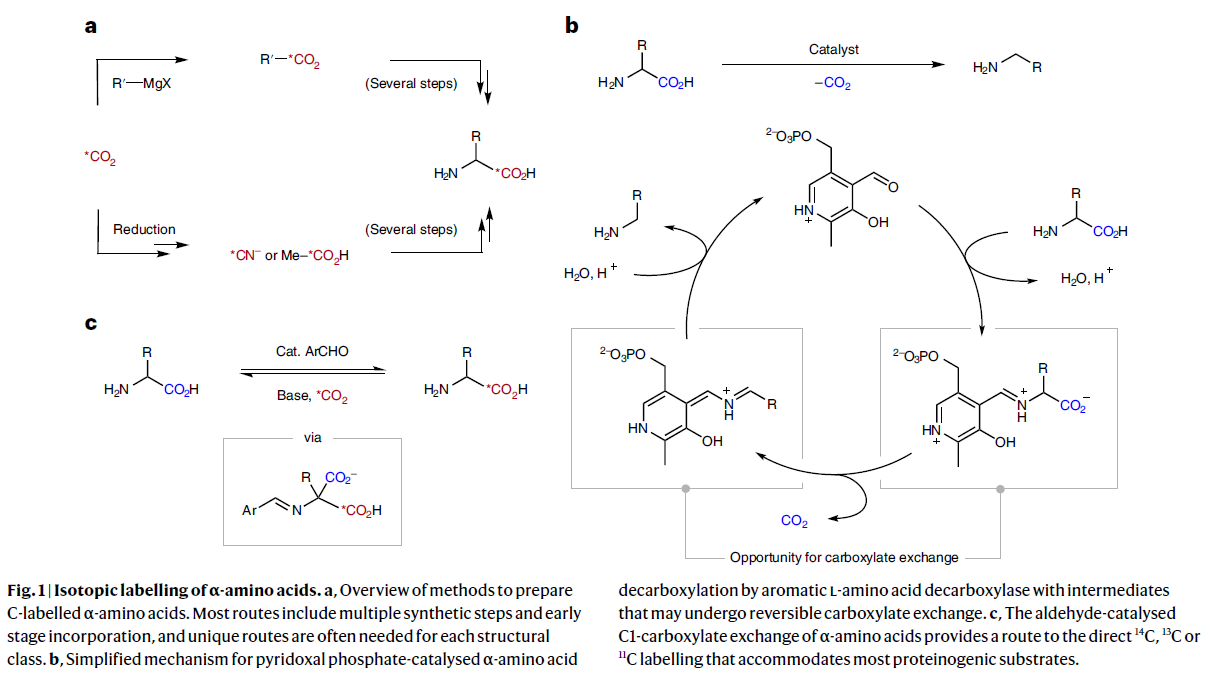
作者首先利用(±)-苯丙氨酸1作為模板底物進行反應嘗試,通過對催化劑、溶劑、堿、溫度等一系列參數進行篩選,作者發現當使用4-甲氧基苯甲醛(20 mol%),Cs2CO3(40 mol%),13CO2(1 atm,8 equiv),在DMSO中,70 ℃下反應24 h可以以84 %的分離產率實現13C標記的(±)-苯丙氨酸產物[13C]1的合成,且13C的標記比例可以達到75%(Fig. 2a)。此外,作者對不同醛催化劑實現氨基酸羧基交換過程進行動力學分析。實驗結果表明富電子或中性的芳基醛催化劑隨著時間的推移展現出更好的穩定性,從而可以更好的實現羧基交換過程,而缺電子芳基醛催化劑雖然可以快速催化羧基交換過程,但其分解更快(Fig. 2b)。
值得注意的是,作者利用此方法還可以實現14C標記過程,選用Ba[14C]CO3在標準條件下原位生成[14C]CO2,從而實現了14C標記的(±)-苯丙氨酸產物[14C]1的合成(Fig. 2c)。
(圖片來源:Nat. Chem.)
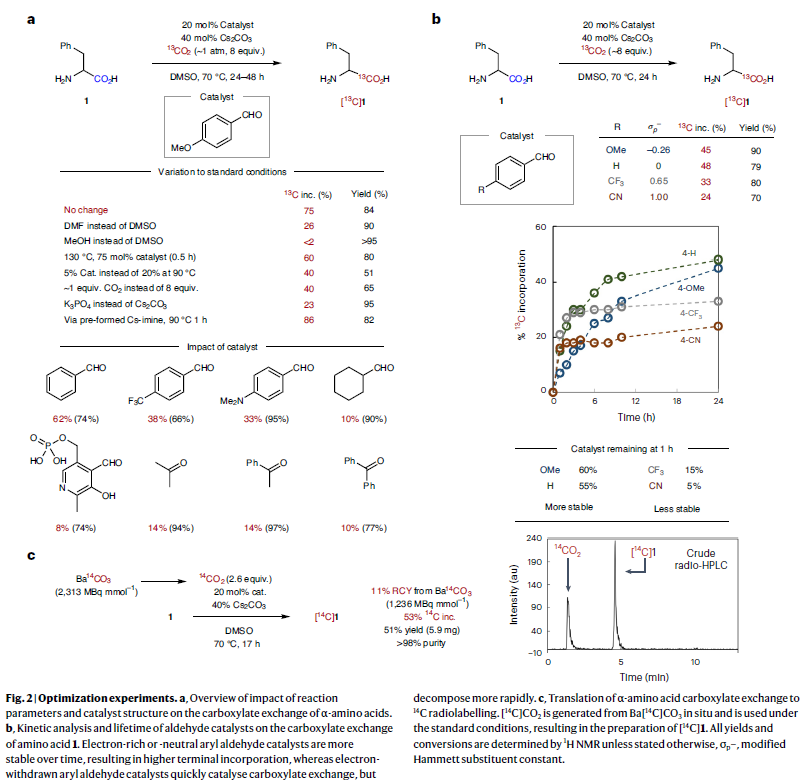
接下來,作者對此轉化的底物范圍進行了考察(Table 1)。整體來講,利用此方法可以有效實現一系列蛋白質氨基酸以及非天然氨基酸的13C標記(1-37)。例如,烷基或芳基取代的α-氨基酸(苯丙氨酸,丙氨酸,亮氨酸,甘氨酸,酪氨酸,色氨酸,蛋氨酸)均可以以>50%的產率,31-75% 13C-標記率實現13C標記產物的合成(1-3, 6-9)。具有酸性或堿性側鏈取代的底物同樣可以順利實現轉化,以23-68%的13C-標記率實現產物(12-14, 16-17)的合成。值得注意的是,利用此方法可以方便的實現藥物ADME研究過程中同位素分子的合成。此外,該反應具有良好的官能團兼容性,包括鹵素(21-23),疊氮基(24),硝基(25),硼酸(26)等官能團均可兼容,且芳基鹵化物的兼容性為后續的官能團轉化提供了多種可能性。
(圖片來源:Nat. Chem.)
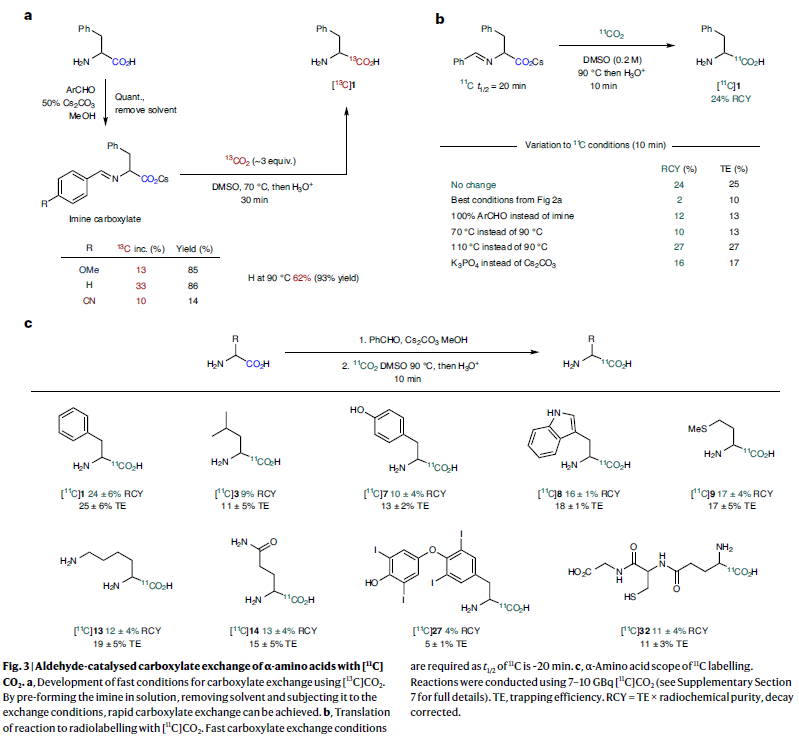
接下來,作者通過稍微改變反應條件,可以利用此策略,通過使用[11C]CO2直接實現α-氨基酸的11C標記(Fig. 3)。由于11C原子的半衰期僅為20分鐘,因此需要在合成過程中事先生成亞胺羧酸鹽來實現11C的同位素標記過程。利用此方法可以有效實現烷基、芳基以及含有極性側鏈取代的α-氨基酸((±)酪氨酸,
色氨酸,亮氨酸,蛋氨酸,賴氨酸和谷氨酰胺,以及(±)-甲狀腺素和谷胱甘肽)的11C標記過程。
(圖片來源:Nat. Chem.)
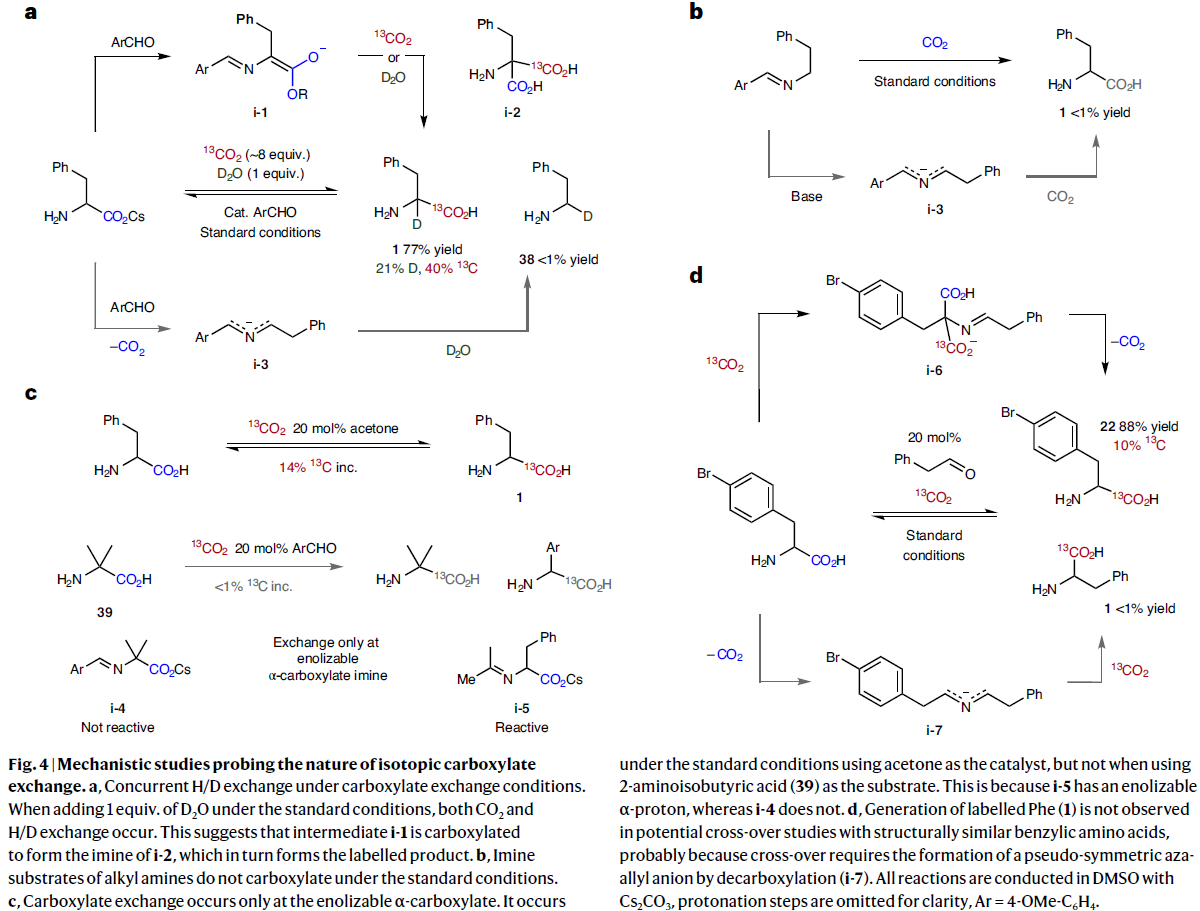
為了深入理解反應機理,作者進行了一系列控制實驗(Fig. 4)。首先,作者在H/D交換與羧基交換共存的條件下發現兩個過程均可發生。由此表明中間體i-1通過羧基化形成i-2的亞胺結構,而i-2則會形成標記產物(Fig. 4a)。隨后,作者發現烷基胺的亞胺底物在標準條件下是不能發生羧酸化過程的(Fig. 4b)。接下來,作者證實了羧酸的交換只能在可烯醇化的α-羧酸上發生(Fig. 4c)。最后,作者在4-溴苯丙氨酸22與苯乙醛縮合后的羧基交換過程中觀察到了[13C]22而未觀察到1。由此表明反應中形成了丙二酸鹽中間體i-6而非氮雜烯丙基中間體i-7(Fig. 4d)。
(圖片來源:Nat. Chem.)
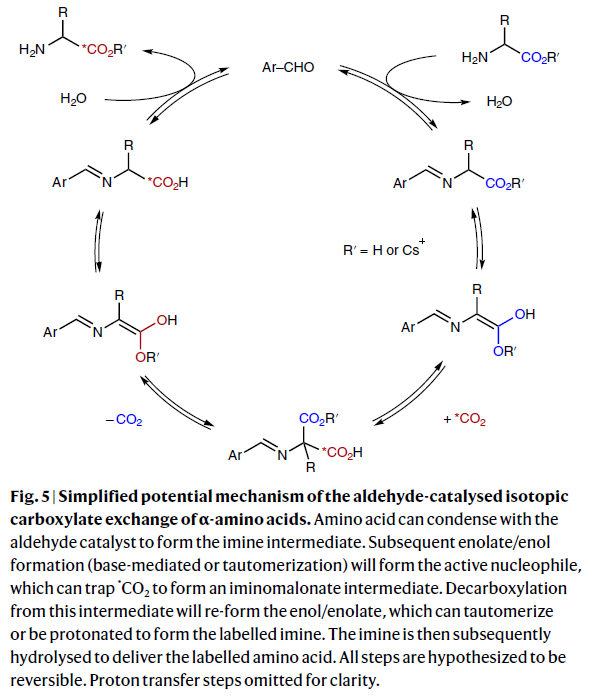
基于上述實驗結果,作者提出了此轉化可能的反應機理(Fig. 5)。首先,氨基酸可與醛催化劑縮合形成亞胺中間體。隨后通過堿促進或互變異構形成烯醇從而形成活性親核試劑,其可捕獲*CO2形成亞氨基戊酸酯中間體。此中間體可以通過脫羧重新形成烯醇中間體,其可以通過互變異構或質子化形成同位素標記的亞胺。最后,亞胺可以被水解從而得到標記的氨基酸產物。此外,作者認為在整個催化循環中每個步驟均具有可逆性,因此與*CO2的交換效率應該是熱力學控制的。而如果催化劑分解的速率比羧基交換的速率低的時候則會發生同位素標記率低的現象。
(圖片來源:Nat. Chem.)
總結
加拿大渥太華大學Benjamin H. Rotstein和阿爾伯塔大學Rylan J. Lundgren課題組發展了在簡單的芳基醛催化下,利用*CO2實現了α-氨基酸的14C,13C或11C標記過程。反應對大多數蛋白質氨基酸以及非天然氨基酸底物均可兼容。利用此方法,無需對羧酸進行預活化或在分子上預先安裝官能團,即可實現α-氨基酸碳同位素標記,這在藥物研發和醫療領域中具有重要的應用價值。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn