

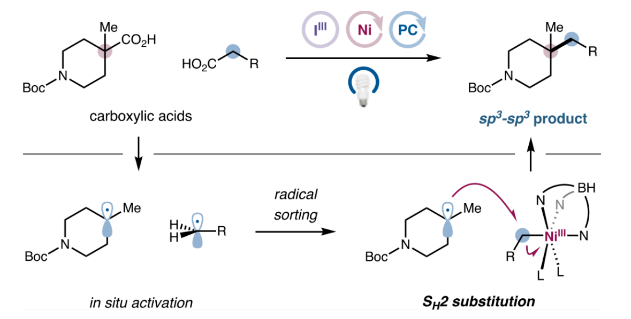
圖1. 光/鎳催化雙分子均裂取代(SH2)交叉脫羧偶(圖片來源:J. Am. Chem. Soc.)
過渡金屬催化的交叉偶聯反應使得人們可以通過簡單分子砌塊的組裝實現復雜化合物的構建。傳統的交叉偶聯反應主要涉及經典有機親電試劑和有機金屬親核試劑之間的偶聯,近年來光氧化還原催化的出現,使得偶聯策略可以擴展至更多含普通天然官能團的底物片段,如氯代物、醇、羧酸、以及C-H鍵等。在這些偶聯砌塊中,羧酸由于商業易得、結構多樣以及穩定無毒等優點得到了廣泛關注。目前已有眾多涉及脂肪族羧酸脫羧的光氧化還原反應被報道,包括烷基化、芳基化、胺化和三氟甲基化等。然而對于兩種不同羧酸之間的高選擇性交叉脫羧C(sp3)-C(sp3)偶聯依然難以實現。
傳統的過渡金屬催化C(sp3)-C(sp3)偶聯主要通過形成二烷基金屬絡合物來實現,然而這種雙烷基金屬中間體還原消除的速率通常較慢且易發生β-H消除、碳-金屬鍵斷裂以及富電子烷基被氧化為碳正離子等副反應。自由基交叉偶聯作為傳統金屬催化偶聯反應的理想替代方法,近年來逐漸被人們關注。然而由于自由基之間的反應一般是由擴散控制的,當兩種自由基具有相似的壽命且能以相近速率生成時,會得到自偶聯和交叉偶聯的混合物(圖2A)。基于上述問題,作者提出了一種雙分子均裂取代(SH2)策略,通過金屬與自由基選擇性結合生成金屬烷基物種再與另一自由基反應實現交叉偶聯,其中金屬與自由基的選擇性結合可以由烷基自由基本身的取代度和反應活性來控制(圖2B)。根據此設計原理,作者成功開發了一種鐵卟啉催化烷基溴代物與氧化還原活性酯之間的交叉偶聯反應,在此基礎上,作者期望開發一種兩種羧酸底物間的選擇性交叉偶聯(圖2C)。
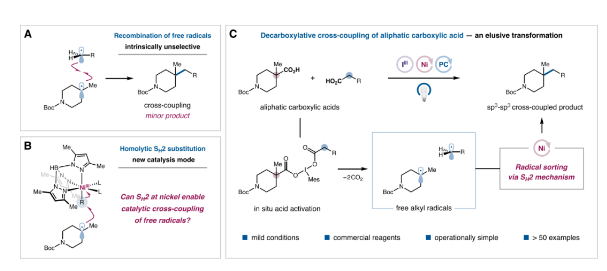
圖2. 研究背景與反應設計思路(圖片來源:J. Am. Chem. Soc.)
首先,作者提出了該雙脫羧交叉偶聯反應的設計思路與相應的機理(圖3B)。羧酸1首先與高價碘2上的羧酸配體發生交換,生成相應的三價碘物種3。隨后激發態光敏劑(4CzIPN或TXO)與高價碘物種發生能量轉移,斷裂兩個I-O鍵后發生脫羧得到烷基自由基4和5,在此階段,Ni(II)配合物6可能會選擇性地捕獲較少取代的烷基4,生成Ni(III)烷基配合物7。最后與自由基5發生SH2反應得到交叉偶聯產物8并完成催化循環。
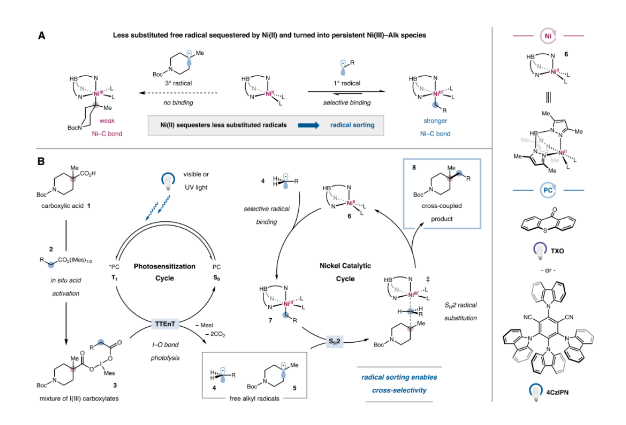
圖3. 雙脫羧交叉偶聯反應體系設計(圖片來源:J. Am. Chem. Soc.)
隨后作者以N-對甲苯磺酰基哌啶酸和2,4,6-三甲基碘苯二乙酸MesI(OAc)2為模板底物對反應條件進行了詳細篩選(圖4)。使用Ni(acac)2為金屬源,三(3,5-二甲基-1-吡唑基)硼氫化鉀(K[Tp*])為配體的組合能有效催化該反應。對于光催化條件,作者探索出了兩種催化方案,即365 nm紫外光與TXO組合以及450 nm藍光與4CzIPN組合,相對于前者,可見光條件對于一些在紫外光下穩定性差的底物更加適用。最后,通過優化溶劑、溫度以及反應時間等條件,最終能以85%收率獲得目標脫羧偶聯產物。
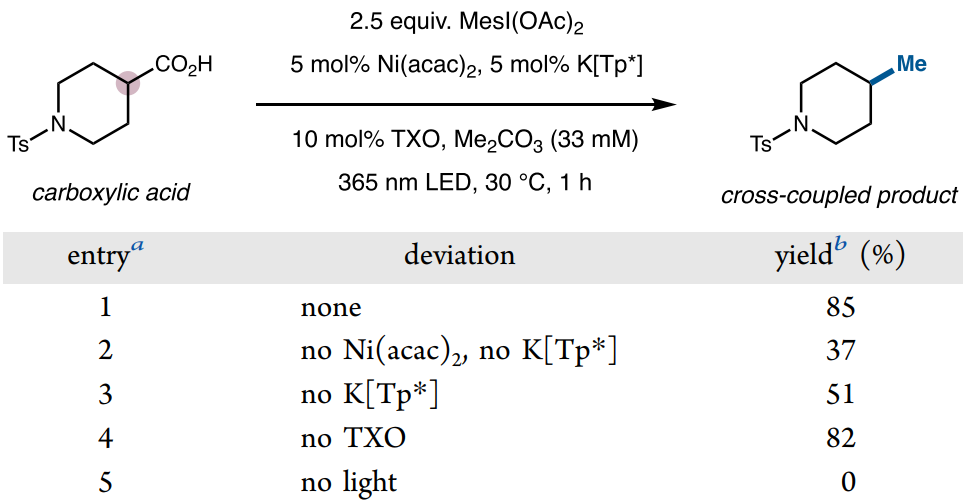
圖4. 反應條件優化(圖片來源:J. Am. Chem. Soc.)
在最優反應條件下,作者考察了該脫羧甲基化反應的底物適用范圍。如圖5所示,該反應表現出優異的官能團兼容性。含雜環的伯烷基羧酸,如吡啶、苯并三唑和1,2,4-噁二唑,能以良好的產率得到甲基化產物9和10。眾多仲烷基羧酸均能順利完成該反應(11-20),其中β-內酰胺以及受保護和未保護的醇羥基具有良好的耐受性(11, 12, 18),證明其在藥物化學中具有一定的應用潛力。對于環狀羧酸,包括氮雜螺[3.3]庚烷(14),、環戊烷(15)、吡咯烷(16)、哌啶(17-19)以及去甲托烷(20)均表現出優異的反應性。對于具有挑戰性的叔烷基羧酸,該催化體系表現出了強大的適用性,成功實現了一系列含季碳中心產物的構建(21-29)。隨后,作者又考察了生物活性分子中廣泛存在的α-氨基酸和α-氧酸結構單元的反應性,將這類底物置于標準反應條件下,能以良好的收率得到脫羧甲基化產物30-33,這表明富電子的親核型自由基也能與該體系兼容。最后,作者考察了復雜藥物和天然產物的適用性,含過氧鍵和縮酮骨架的青蒿琥酯和含兩個未保護烯丙醇基團的赤霉素A3能以中等至良好的收率得到甲基化產物(34, 38)。含α-二苯基片段的藥物分子安立生坦能順利完成脫羧甲基化,表明該反應能適用于高度空間擁擠的底物環境(36)。
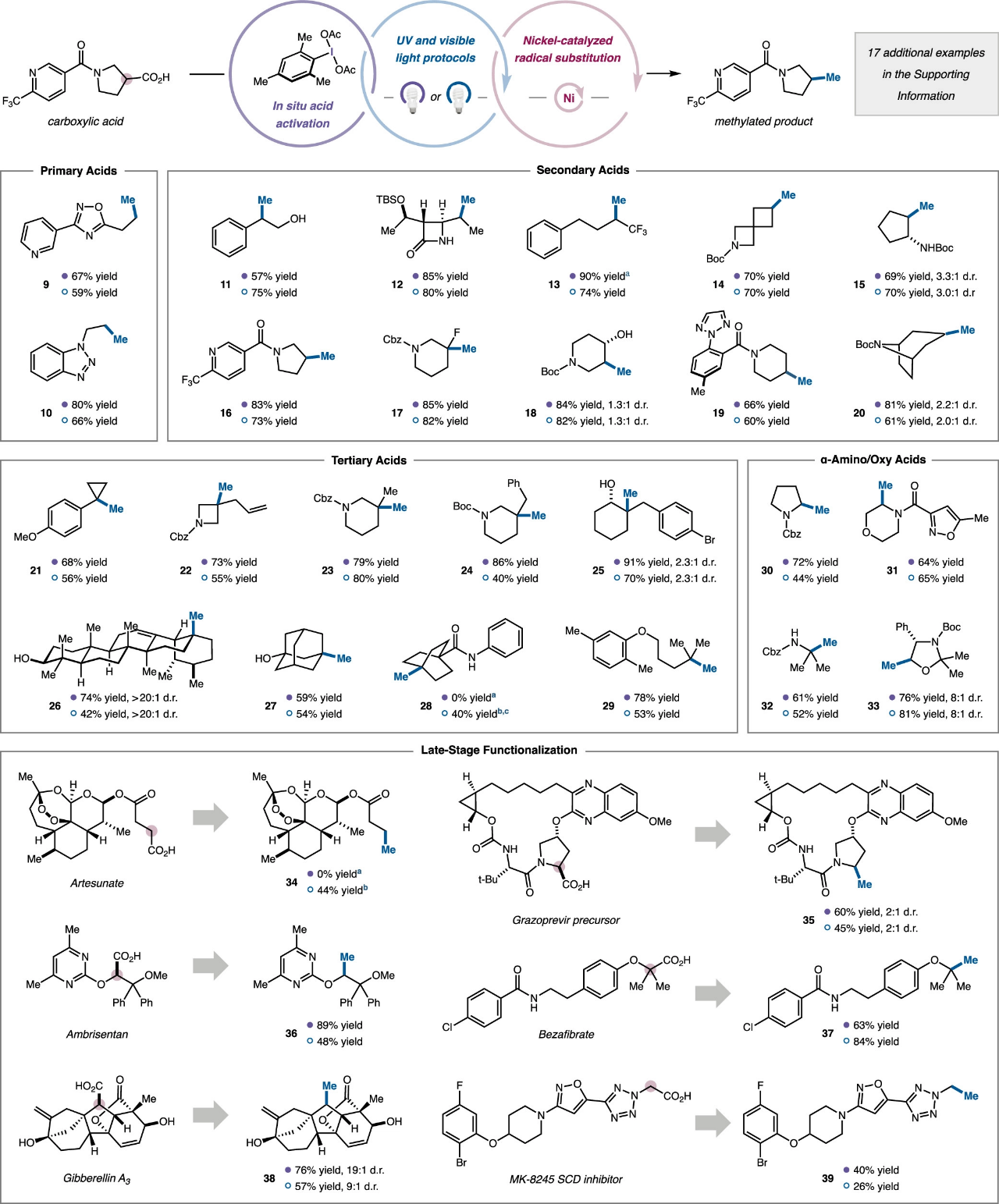
圖5. 脫羧甲基化反應底物拓展(圖片來源:J. Am. Chem. Soc.)
在完成以碘苯二乙酸作為甲基源的脫羧甲基化反應后,作者考察了其它雙羧酸碘苯的反應性,這些三價碘底物可以由MesIO與相應羧酸反應獲得(圖6)。結果表明,同位素標記的CD3、13C-甲基均能適用于該脫羧偶聯反應(40, 41)。多取代乙酸(42-44)和丙酸(45-46)能以中等至良好的收率完成相應烷基化反應。最后作者利用此反應也成功實現了一些季碳中心產物的構建(47-49)。
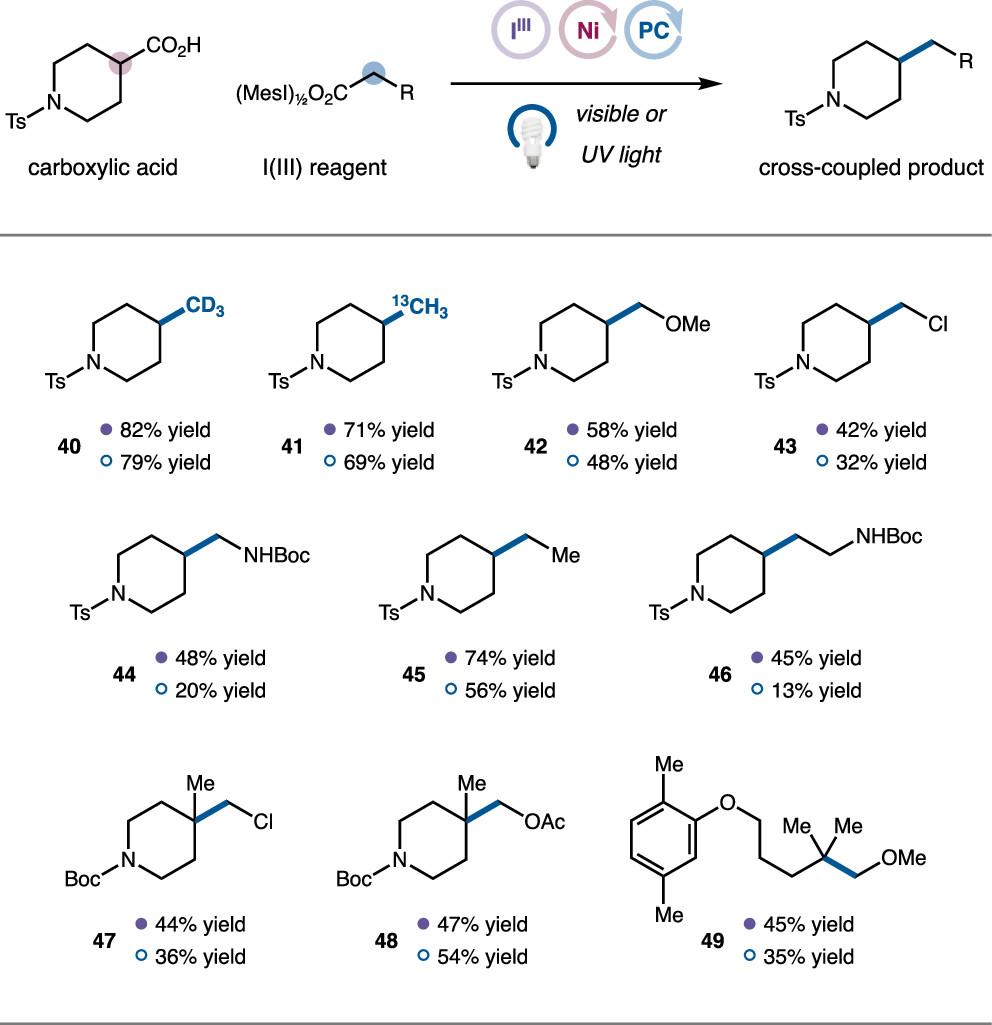
圖6. 羧酸底物拓展(圖片來源:J. Am. Chem. Soc.)
隨后,作者研究了該體系中鎳催化循環的機理。首先通過動力學分析表明在紫外光條件下,高價碘物種的光敏化為該反應的決速步,且反應速率與鎳催化劑的濃度無關。對于該轉化的立體化學過程,作者將底物β-氨基酸50置于各種甲基化反應條件下,研究其反式與順式產物15的比例規律(圖7A)。結果表明在不添加鎳催化劑時能以34%的產率和1.5:1的d.r.值得到交叉偶聯產物,這可能是通過受擴散控制的經典自由基偶聯生成。通過添加Ni(acac)2和配體K[Tp]能將產率和d.r.值分別提高至63%和2.4:1。使用最優配體K[Tp*]最終能以81%的產率和3.0:1的d.r.值得到產物。這些結果都表明Ni物種直接參與了該C-C鍵的形成過程。一般而言,鎳參與的金屬有機反應通常涉及低價Ni(0)或Ni(I)物種,然而循環伏安實驗表明在該體系下,過量的MesI(OAc)2能有效地將Ni(I)物種氧化為Ni(II)。為了進一步證實該催化轉化中不涉及活性低價鎳物種,作者還通過添加易與低價鎳氧化加成的芳基鹵代物進行控制實驗,結果表明鹵代物的添加沒有抑制該雙脫羧偶聯反應且芳基鹵代物可以定量回收(圖7B)。作者進一步利用EPR實驗表征該體系中Ni物種的存在形式(圖7C)。對于MesI(OAc)2、Tp*Ni(OAc)絡合物55和TXO的混合溶液,在無光照條件下未監測到EPR信號,表明在熱化學條件下高價碘無法氧化Ni(II)絡合物。當使用365 nm的紫外光照射時,出現了g值為2.17的EPR信號,其來源于以過渡金屬原子為中心的自旋體系。對照實驗表明在無TXO的條件下也能檢測到一定強度的該信號,且關閉光源后該信號會在幾秒鐘內消失。這些結果表明MesI(OAc)2會在365 nm光照下生成甲基自由基,其被Tp*Ni(OAc)捕獲得到低自旋d7Ni(III)-Me絡合物56a。最后,作者對一系列碘苯二羧酸進行了相同的光激發EPR實驗(圖7D)。除MesI(OAc)2外,只有MesI(O2CEt)2能產生顯著的EPR信號(g=2.19),異丙基和叔丁基無法得到相應Ni-烷基物種,這與DFT計算出的Ni-C鍵解離能順序相一致。
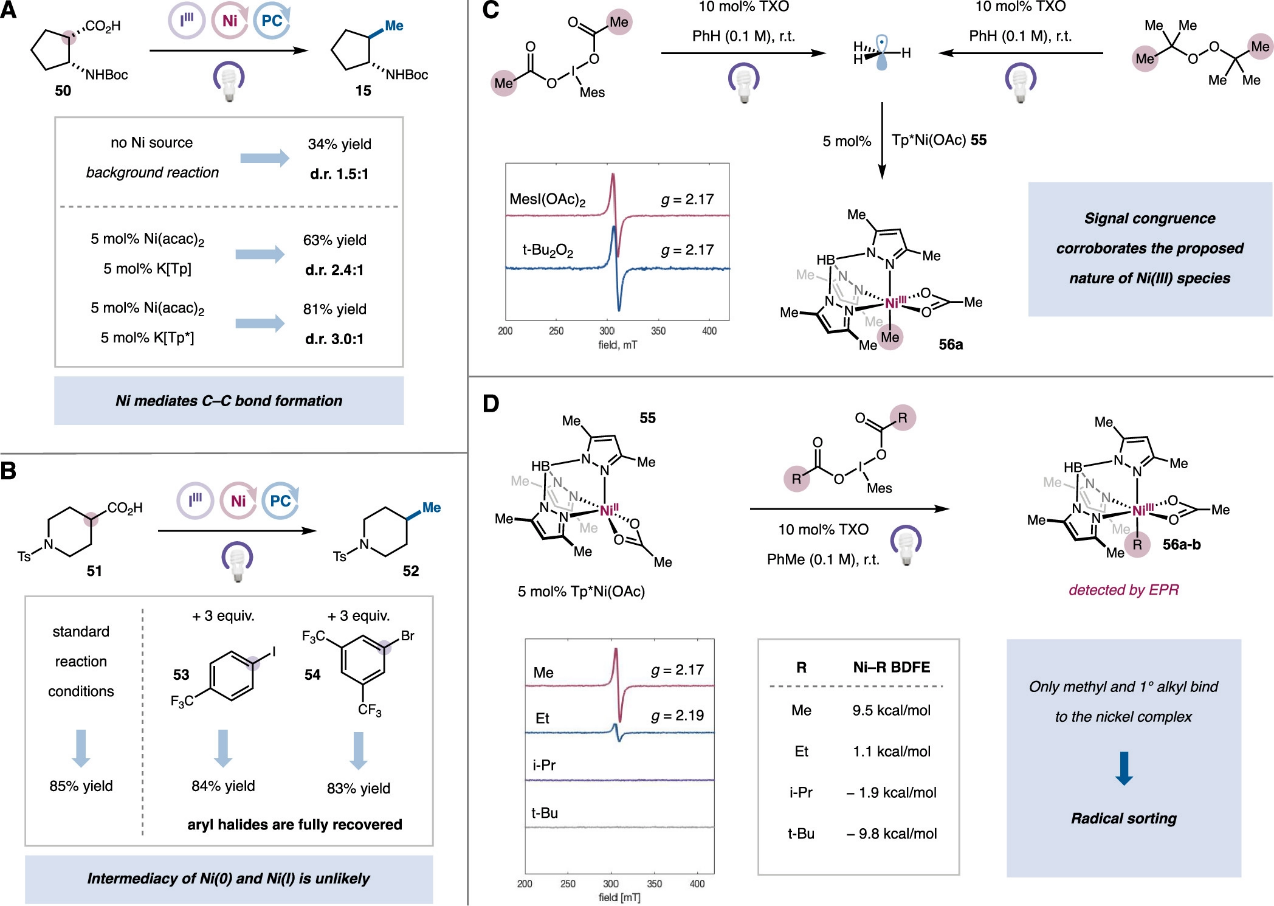
圖7. 反應機理研究(圖片來源:J. Am. Chem. Soc.)
總結 David W. C. MacMillan課題組報道了一種基于雙分子均裂取代(SH2)策略的脂肪族羧酸雙脫羧交叉偶聯反應。在該反應中,高價碘光敏化產生的烷基自由基首先被Ni(II)物種捕獲,進一步與另一自由基發生SH2反應,實現該脫羧偶聯的選擇性。該催化體系具有優異的官能團兼容性且能用于傳統金屬有機反應難以得到的季碳中心化合物的構建。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn