

(圖片來源:J. Am. Chem. Soc.)
在過去的十年里,將三維骨架引入藥物分子中通常會增強生物活性、物理化學性質和代謝特征。因此,化學家們對其合成引起了極大的興趣。其中,雙環[1.1.1]戊烷(BCP)骨架由于其潛在的苯基生物等排性(bioisosterism)而成為深入研究的主題。雖然此類化合物大多數集中于單取代或橋頭二取代(C1和C3)BCPs的合成研究上,但秦天課題組開發了一種分子內偶聯方法,可用于合成多取代(C1、C2和C3)BCPs,其被認為是備受追捧的鄰/間取代苯模擬物(Scheme 1a)。值得注意的是,最近的研究表明,與相應的苯或BCP類似物相比,2-氧雜雙環[2.1.1]己烷(2-oxa-BCHs)表現出更高的水溶性、改善的代謝穩定性和降低的親脂性。因此,2-氧雜雙環[2.1.1]己烷衍生物的合成引起了化學家的極大關注。盡管如此,目前大多數的方法主要集中于單/雙取代2-oxa-BCHs的合成,對于多取代2-oxa-BCHs的合成則具有挑戰。
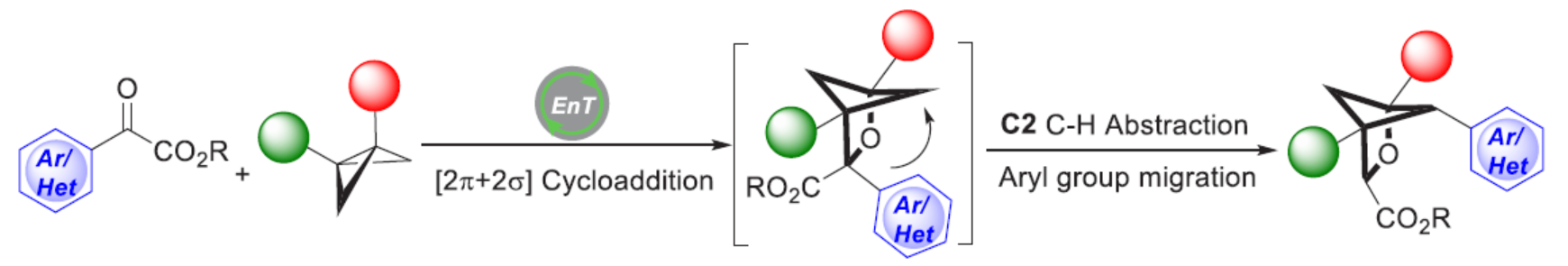
近年來,[2+2]光環加成是有機合成中最基本的轉化之一,可直接且以原子經濟的方式構建環狀骨架。在這一領域,可見光誘導的能量轉移催化由于其溫和的反應條件以及出色的選擇性,而備受關注。底物在三重激發態下的反應性為有機合成提供了多種機會。雖然化學家已對[2π+2π]光環加成反應進行了很好的研究,但可見光誘導的[2π+2σ]環加成卻較少有相關的研究。最近,Glorius課題組報道了一種雜環烯烴與雙環[1.1.0]-丁烷(BCBs)的[2π+2σ]光環加成反應,合成了一系列多取代雙環[2.1.1]-己烷(BCHs)(Scheme 1b)。近日,德國明斯特大學Frank Glorius課題組開發了一種苯甲酰甲酸酯與BCBs的形式[2π+2σ]光環加成反應,合成了一系列多取代2-oxa-BCHs,涉及三重態能量轉移、攫氫反應以及芳基遷移的串聯過程(Scheme 1c)。

(圖片來源:J. Am. Chem. Soc.)
首先,作者以苯甲酰甲酸甲酯1a與BCB 2a作為模型底物,進行了相關反應條件的篩選(Table 1)。當以[Ir(dF(CF3)ppy)2(dtbbpy)]PF6([IrF])作為光催化劑,在MeCN溶劑中于藍色LEDs(λmax = 450 nm)照射下室溫反應16 h,可以56%的收率得到產物3a。
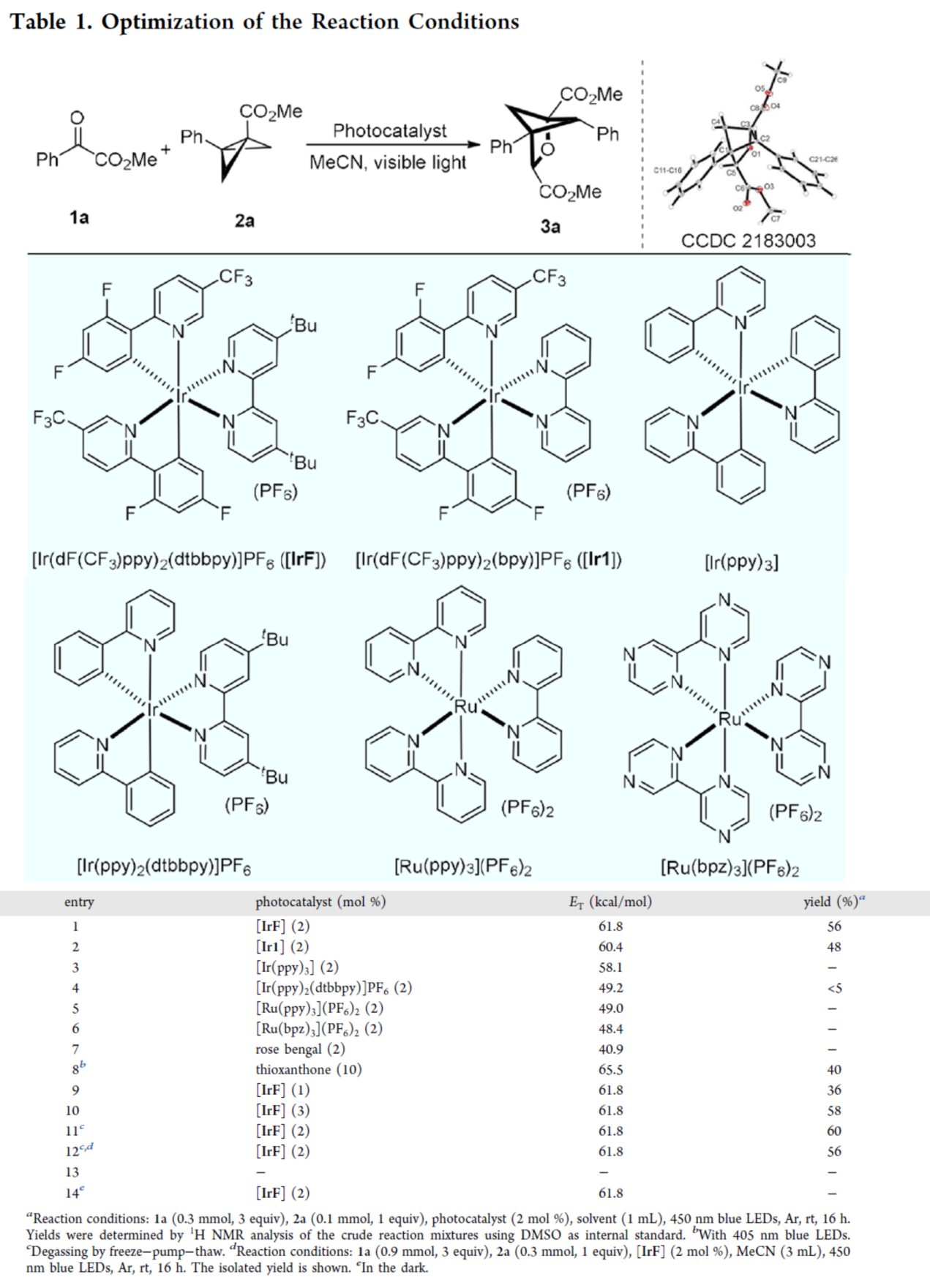
(圖片來源:J. Am. Chem. Soc.)
在獲得上述最佳反應條件后,作者對底物范圍進行了擴展(Table 2)。首先,當底物1中的R為不同的烷基時,均可順利進行反應,獲得相應的產物3a-3f,收率為33-56%。當底物1中的α-取代為不同電性的芳基(除鄰位含有甲基取代的芳基)以及吡啶基時,均與體系兼容,獲得相應的產物3g-3v,收率為38-56%。其次,當底物2中的-CO2Me改為-CO2tBu與-CO2Bn時,可獲得相應的產物3w-3x,收率為49-53%。此外,當底物2中含有不同電性的芳基時,也能夠順利進行反應,獲得相應的產物3y-3ac,收率為38-46%
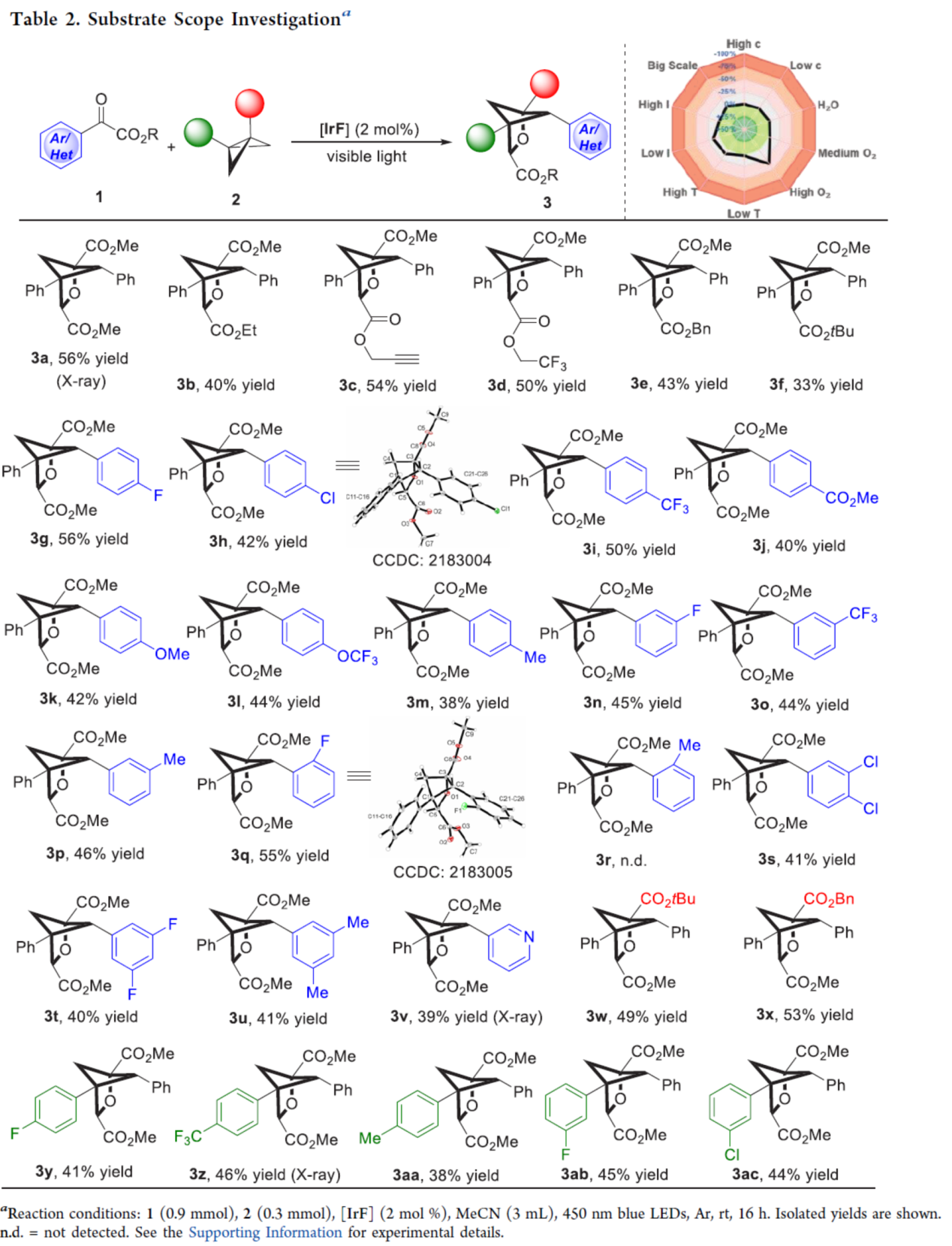
(圖片來源:J. Am. Chem. Soc.)
緊接著,作者對反應的實用性進行了研究(Scheme 2)。首先,3a在LiAlH4條件下進行還原反應,可以88%的收率得到二醇化合物4。其次,3a在使用四當量的LiOH·H2O進行水解反應后,可以91%的收率得到二羧酸化合物5。同時,3a在使用一當量的LiOH·H2O進行水解反應時,可以88%的收率得到羧酸化合物6。
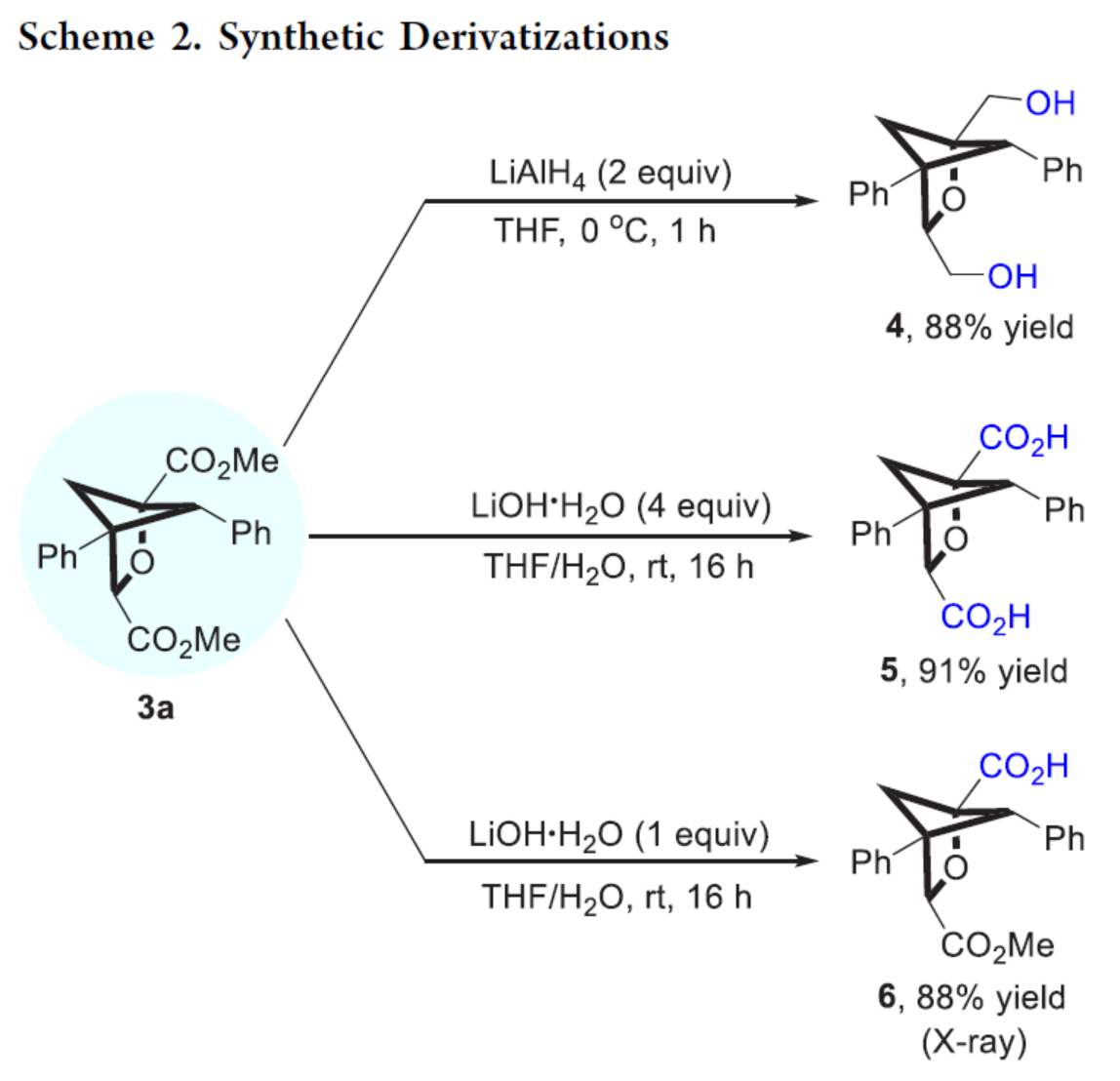
(圖片來源:J. Am. Chem. Soc.)
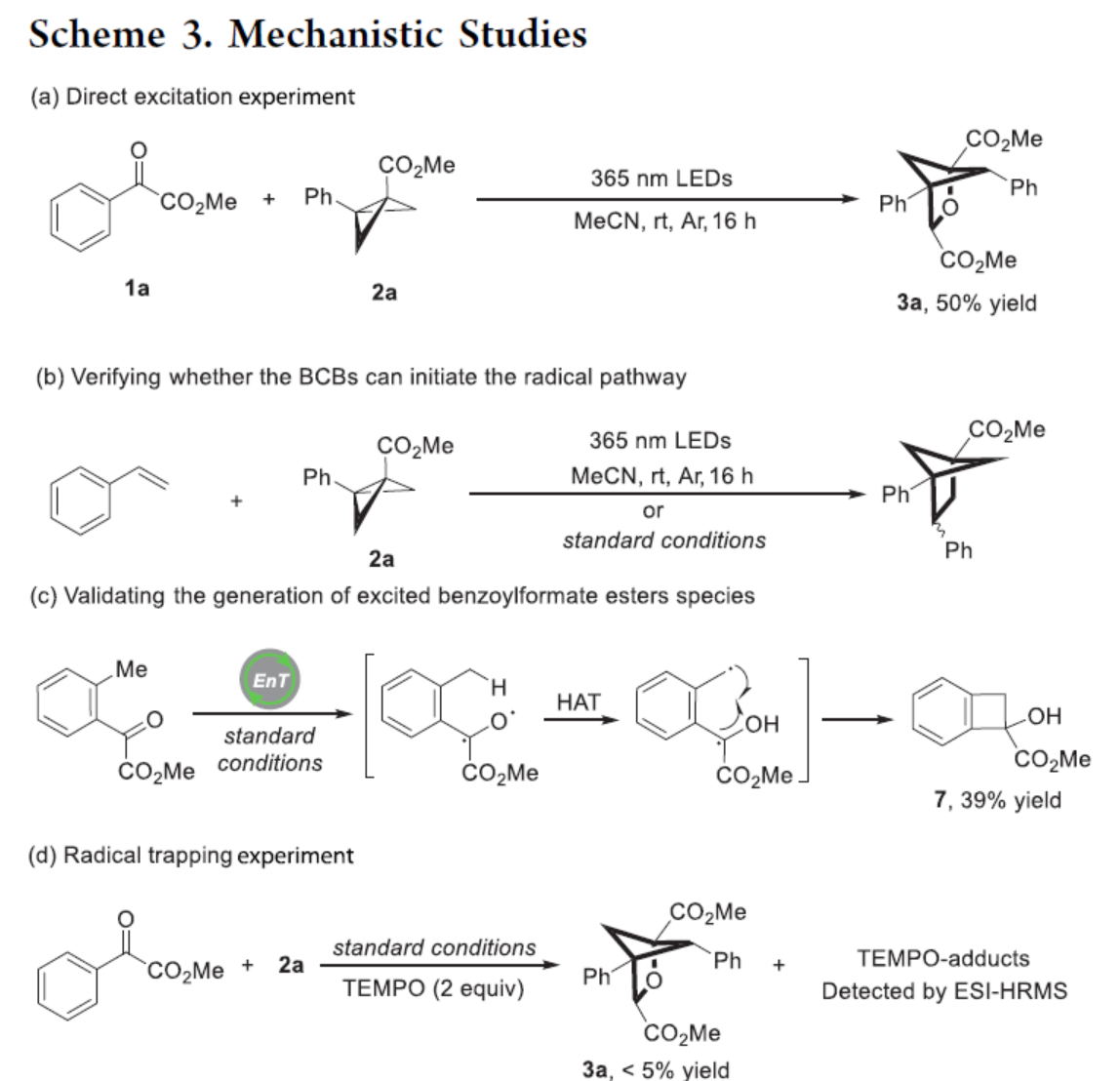
緊接著,作者對反應機理進行了進一步的研究(Scheme 3)。首先,Stern-Volmer淬滅實驗表明,兩種底物可以相似的速率淬滅激發態光催化劑。CV實驗可排除單電子轉移過程,因為兩種底物的氧化還原電位都超出了激發態光催化劑的范圍。UV/vis檢測表明,1a和2a之間并未形成電子供體?受體配合物。由于淬滅表明底物和激發態光催化劑之間的相互作用,上述結果支持能量轉移機理,并表明兩種底物都可以敏化為三重態。其次,1a與2a在365 nm LEDs照射下進行直接激發實驗,可以50%的收率得到產物3a(Scheme 3a)。同時,苯乙烯與2a在標準條件下,未能發生反應(Scheme 3b)。上述結果表明,2a可能無法通過自由基途徑引發反應。此外,含有鄰甲基取代的底物在標準條件下反應時,可以39%的收率得到Norrish II型產物7,從而表明在反應過程中生成激發的苯甲酰甲酸酯(Scheme 3c)。上述這些結果表明,激發的苯甲酰基甲酸酯最有可能啟動[2π+2σ]環加成步驟。同時,在1a和2a的標準反應體系中,加入TEMPO時,反應完全被抑制,從而表明反應涉及自由基的歷程(Scheme 3d)。
(圖片來源:J. Am. Chem. Soc.)
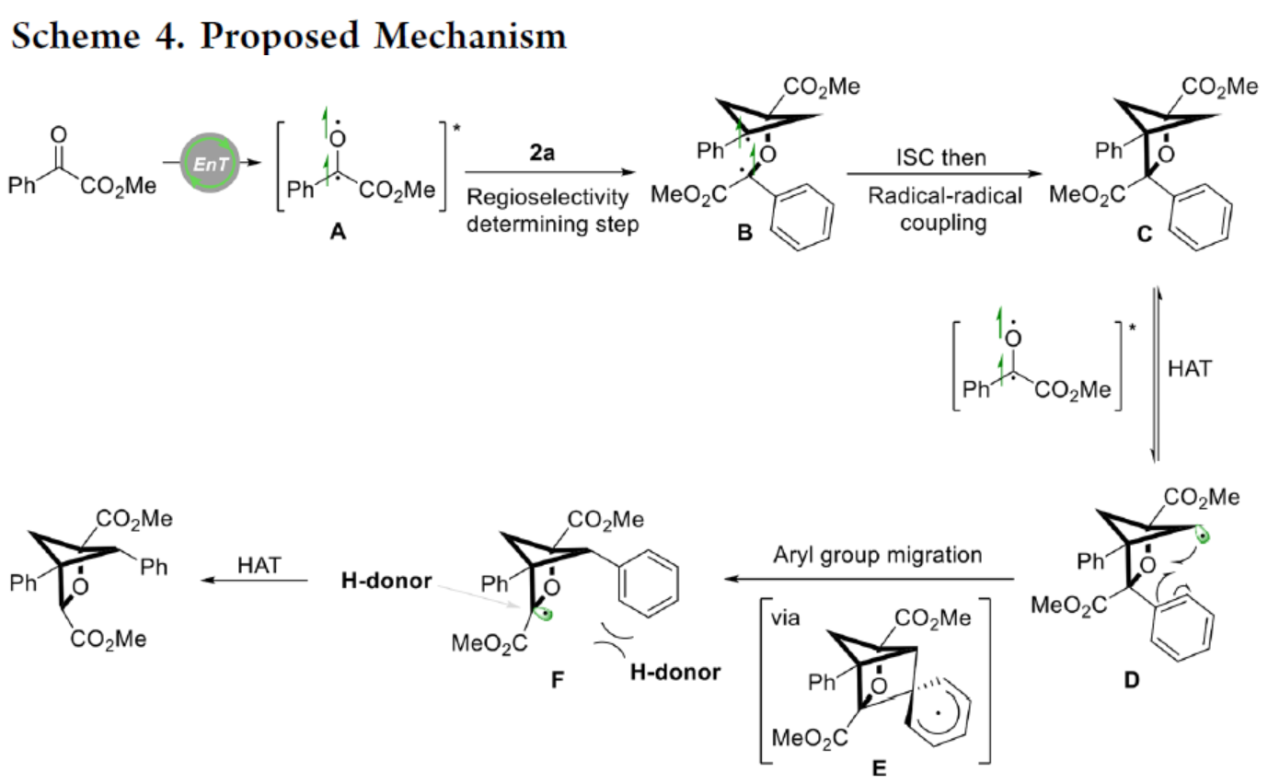
最后,作者提出了一種合理的反應機理(Scheme 4)。首先,從激發態光催化劑*[IrIII]到苯甲酰甲酸酯的能量轉移生成配合物A,A與2a反應生成更穩定的雙自由基配合物B,作為區域選擇性決定步驟。隨后,B經系間竄越(Intersystem crossing)與自由基-自由基偶聯,生成中間體C。C與激發配合物A通過HAT過程,生成自由基中間體D。D經芳基遷移,可生成更穩定的自由基配合物F,涉及中間體E的形成。最后,由于芳基在骨架位置的空間效應,氫供體可以從空間位阻較小的位置進攻配合物F,從而獲得最終的產物。
(圖片來源:J. Am. Chem. Soc.)
總結 德國明斯特大學Frank Glorius課題組開發了一種可見光誘導三重態能量轉移的催化策略,通過易得的苯甲酰甲酸酯與雙環[1.1.0]丁烷一步合成了一系列多取代2-氧雜雙環[2.1.1]己烷衍生物。同時,該策略涉及形式的[2π+2σ]光環加成/攫氫反應/芳基遷移的串聯過程。其次,該反應具有反應條件溫和、底物范圍廣泛、官能團兼容性高等特點。此外,通過后期的衍生化實驗,可分別獲得二醇、二羧酸和單羧酸修飾的2-oxa-BCH砌塊,從而進一步證明了反應的實用性。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn