



(圖片來源:Angew. Chem. Int. Ed.)
近年來,C(sp3)-H官能團(tuán)化的研究在有機(jī)合成領(lǐng)域經(jīng)歷了驚人的發(fā)展。這些轉(zhuǎn)化的一個關(guān)鍵優(yōu)勢在于它們的高原子經(jīng)濟(jì)性,這源于省略了預(yù)官能化步驟以形成新的C-C或C-X(X = N、O或鹵素)鍵。它們在串聯(lián)過程中的整合對于構(gòu)建復(fù)雜分子具有很高的合成價值。盡管涉及氫原子轉(zhuǎn)移或卡賓/氮賓插入串聯(lián)反應(yīng)的發(fā)展取得了長足的進(jìn)步,但在內(nèi)部氧化還原過程中通過氫提取的功能化卻發(fā)展相對緩慢。
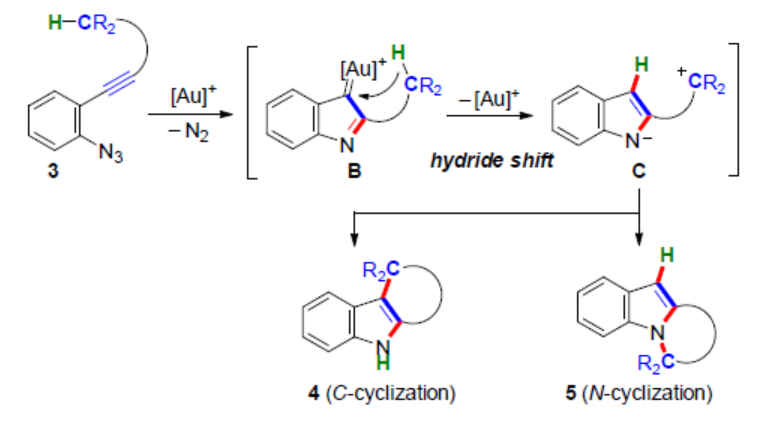
目前,涉及金催化C(sp3)-H官能團(tuán)化的串聯(lián)反應(yīng)備受關(guān)注。由于金的高π-酸性具有非凡的選擇性,可用于不同親核加成反應(yīng)中炔烴的活化過程,金參與電子反饋(electron back-donation)以穩(wěn)定陽離子中間體的能力導(dǎo)致其具有雙重反應(yīng)模式。2005年,Toste課題組報道了一種金催化高炔丙基疊氮化物的反應(yīng),通過1,2-氫轉(zhuǎn)移合成了一系列取代的吡咯衍生物,涉及形成α-亞氨基金卡賓。隨后,化學(xué)家們還將這一概念進(jìn)一步擴(kuò)展到串聯(lián)環(huán)化反應(yīng)中,合成了一系列多環(huán)吲哚衍生物(Scheme 1A)。然而,涉及1,5-遷移到金卡賓中心的反應(yīng),卻少有報道。
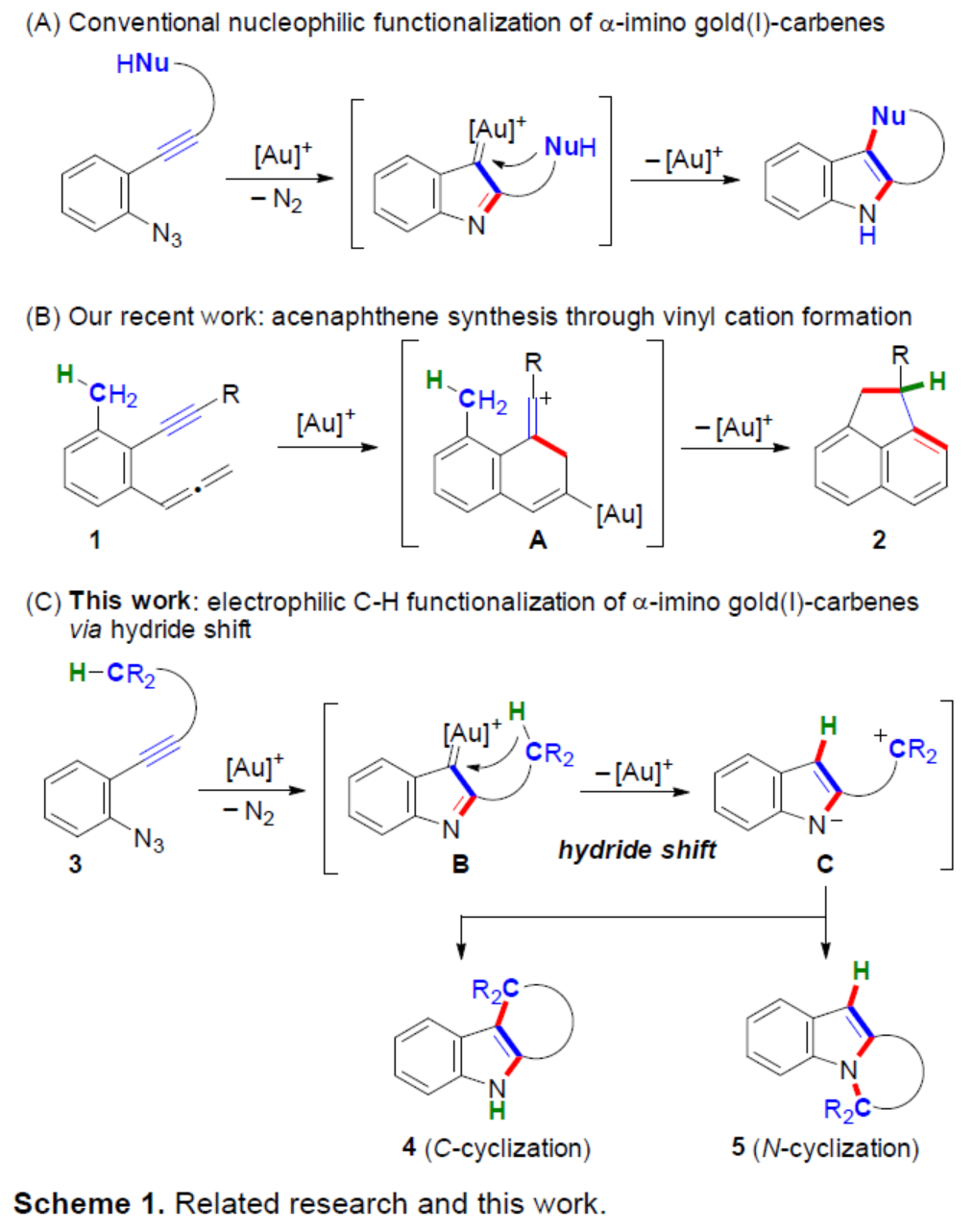
前期(Angew. Chem. Int. Ed. 2019, 58,7792.和Angew. Chem. Int. Ed. 2021, 60, 27019.),Hiroaki Ohno課題組報道了一種金催化聯(lián)烯基苯乙炔衍生物(allenynes)1合成acenaphthenes 2的方法,涉及形成乙烯基陽離子金配合物A的過程(Scheme 1B)。近日,日本京都大學(xué)Hiroaki Ohno課題組報道了一種金催化疊氮炔衍生物的芐基sp3(C-H)官能團(tuán)化反應(yīng),通過發(fā)散性N-或C-環(huán)化合成了一系列吲哚稠合的四環(huán)或五環(huán)化合物(Scheme 1C)。
(圖片來源:Angew. Chem. Int. Ed.)
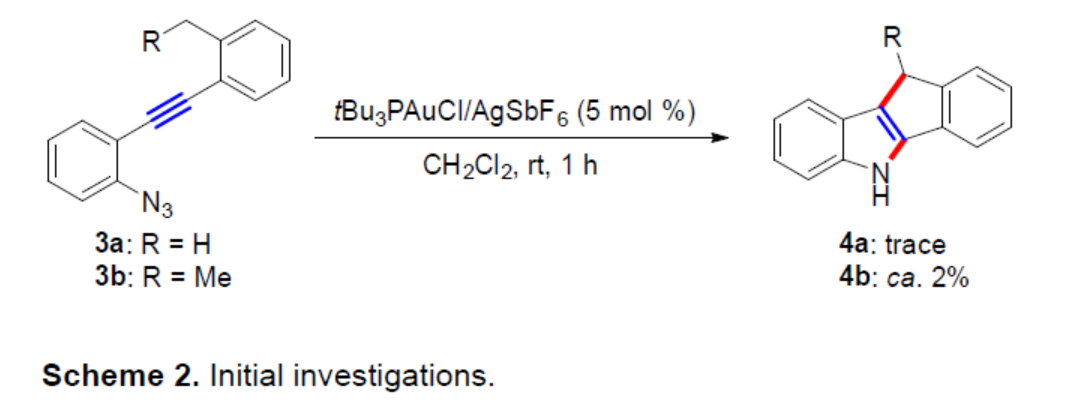
最初,作者選擇了tBu3PAuCl/AgSbF6作為催化體系,當(dāng)以3a作為底物時,僅獲得微量的目標(biāo)產(chǎn)物4a。為了提高氫化物供體的反應(yīng)性,作者引入一個額外的甲基(3b)用于穩(wěn)定相應(yīng)的芐基陽離子,可以2%的收率得到所需產(chǎn)物4b(Scheme 2)。
(圖片來源:Angew. Chem. Int. Ed.)
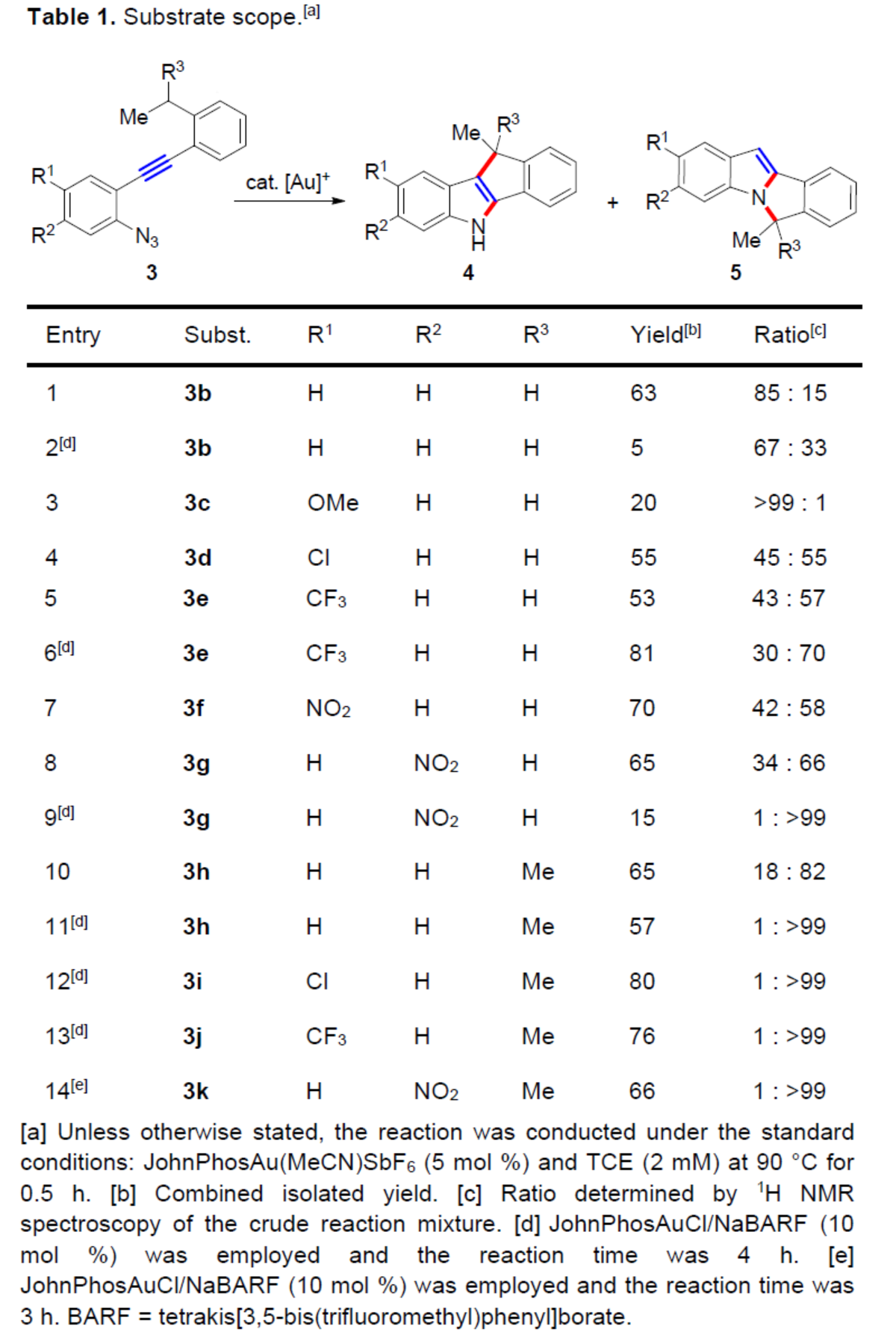
緊接著,作者對底物范圍進(jìn)行了擴(kuò)展(Table 1)。首先,在JohnPhosAu(MeCN)SbF6催化體系中,底物3b-3h,均可順利進(jìn)行C-環(huán)化反應(yīng),合成了一系列吲哚稠合的四環(huán)產(chǎn)物,收率為20-81%,C-環(huán)化/N-環(huán)化為18:82->99:1。其次,在JohnPhosAuCl/NaBARF催化體系中,底物3b、3e、3g和3h-3k,可選擇性進(jìn)行N-環(huán)化反應(yīng),收率為5-80%,C-環(huán)化/N-環(huán)化為67:33-1:>99。此外,芳基單元的吸電子基團(tuán)、弱配位平衡陰離子和碳陽離子誘導(dǎo)的穩(wěn)定性,對于選擇性N-環(huán)化具有一定的影響。
(圖片來源:Angew. Chem. Int. Ed.)
(圖片來源:Angew. Chem. Int. Ed.)
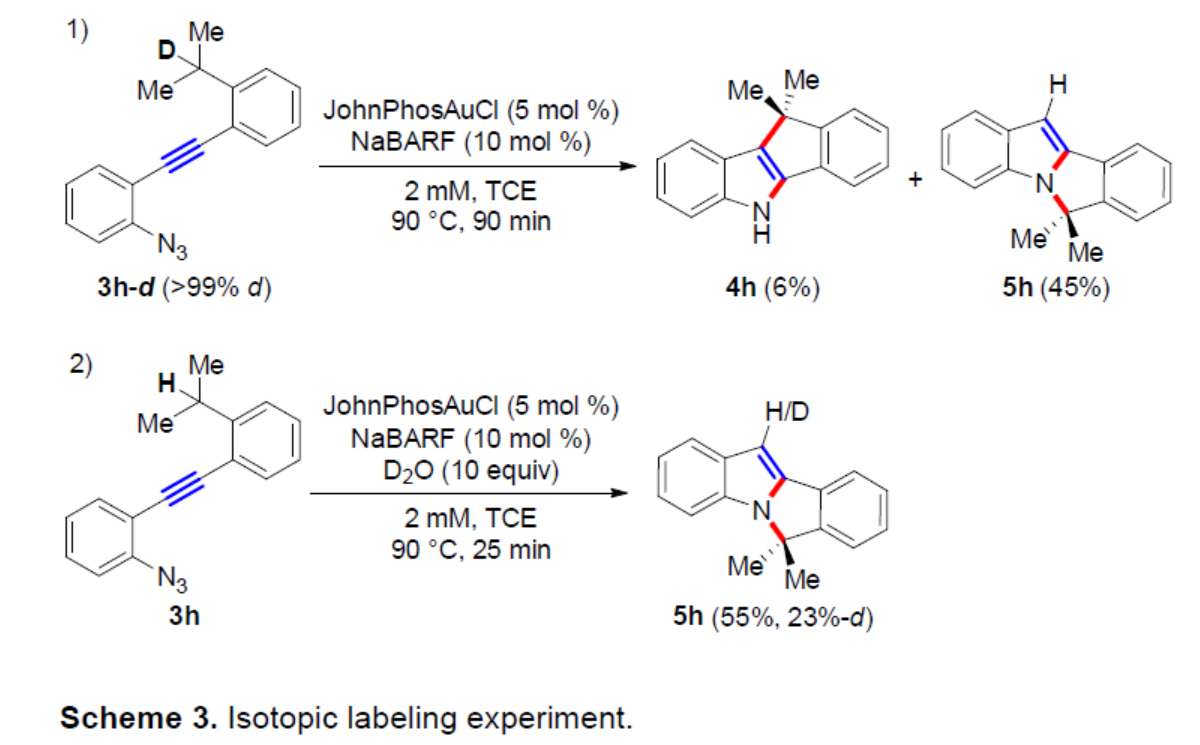
為了進(jìn)一步了解芐基C(sp3)-H官能團(tuán)化反應(yīng)的機(jī)理,作者進(jìn)行了同位素標(biāo)記實(shí)驗(yàn)(Scheme 3)。首先,當(dāng)以3h-d(>99% d)作為底物,在金催化的串聯(lián)環(huán)化反應(yīng)中,氘標(biāo)記的完全消失,獲得6%收率的產(chǎn)物4h和45%收率的產(chǎn)物5h,從而表明D/H置換涉及串聯(lián)反應(yīng)序列中的基本步驟之一。其次,當(dāng)使用D2O作為氘源,3h進(jìn)行反應(yīng)時,可以55%的收率得到5h-d(23%-d),從而表明在反應(yīng)混合物中存在D2O、HDO或H2O時,吲哚3-位的H/D可以置換為D/H。
(圖片來源:Angew. Chem. Int. Ed.)
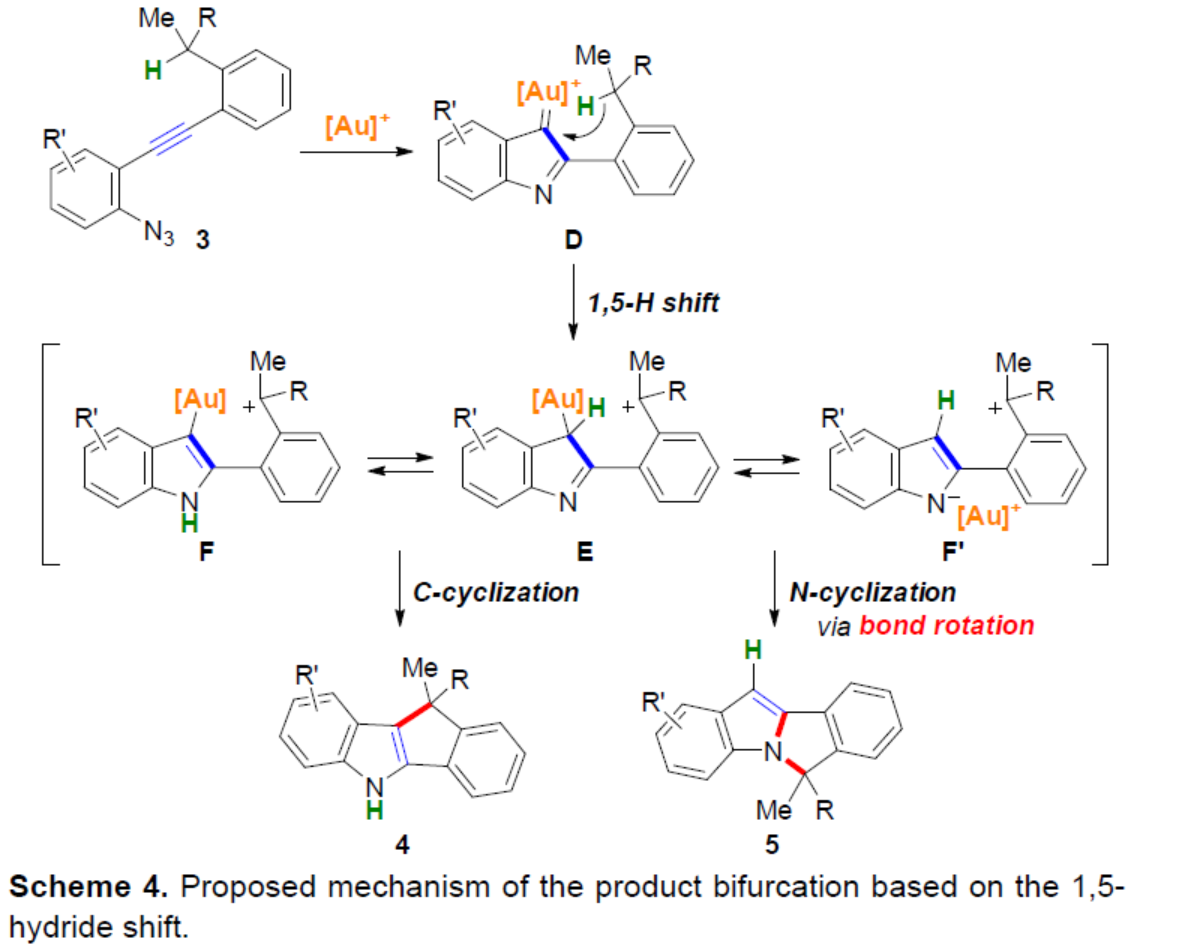
基于上述的研究,作者提出了一種合理的催化循環(huán)過程(Scheme 4)。首先,金催化底物中炔基的Schmidt反應(yīng),生成α-亞氨基-金卡賓D。隨后,D經(jīng)1,5-氫轉(zhuǎn)移生成相應(yīng)的碳陽離子中間體E,其處于芳構(gòu)化中間體F和F’之間的平衡狀態(tài)。緊接著,通過去金化碳-碳鍵的形成,可獲得C-環(huán)化產(chǎn)物4。同時,通過鍵旋轉(zhuǎn)和C-N鍵形成,可獲得N-環(huán)化產(chǎn)物5。
(圖片來源:Angew. Chem. Int. Ed.)
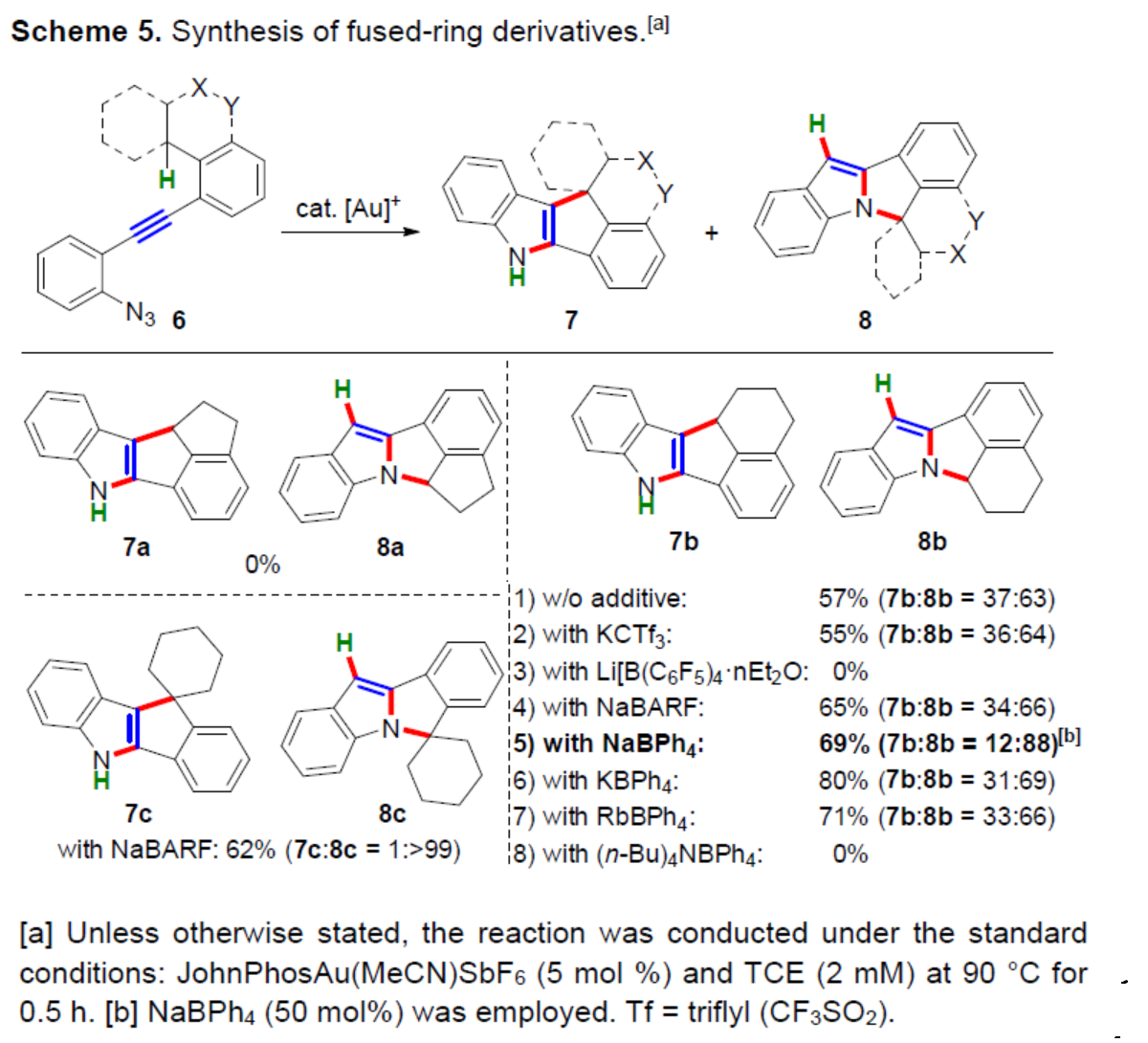
緊接著,作者對碳環(huán)底物6的底物范圍進(jìn)行了進(jìn)一步的擴(kuò)展(Scheme 5)。當(dāng)使用茚烷衍生物6a時,聚合是觀察到的唯一反應(yīng),未檢測到所需產(chǎn)物7a和8a。考慮到與7a和8a中五元環(huán)稠合的三環(huán)茚環(huán)的高張力,作者隨后考察了四氫萘衍生物6b的反應(yīng)性。在無添加劑時,可以57%的收率得到吲哚稠合五環(huán)產(chǎn)物7b和8b(7b:8b=37:63)。通過對反應(yīng)條件的簡要調(diào)查后發(fā)現(xiàn),使用NaBPh4可顯著提高了N-環(huán)化的選擇性(7b:8b=12:88),而添加KCTf3、LiB(C6F5)4、NaBARF、KBPh4、RbBPh4和(nBu)4NBPh4的效果較差。同時,四苯基硼酸鹽的分解在這一過程中可能起到重要的作用,但也可能產(chǎn)生平衡陰離子效應(yīng),從而影響吲哚骨架的離子特性。當(dāng)使用NaBARF時,可以62%的收率得到螺稠五環(huán)化合物8c。
(圖片來源:Angew. Chem. Int. Ed.)
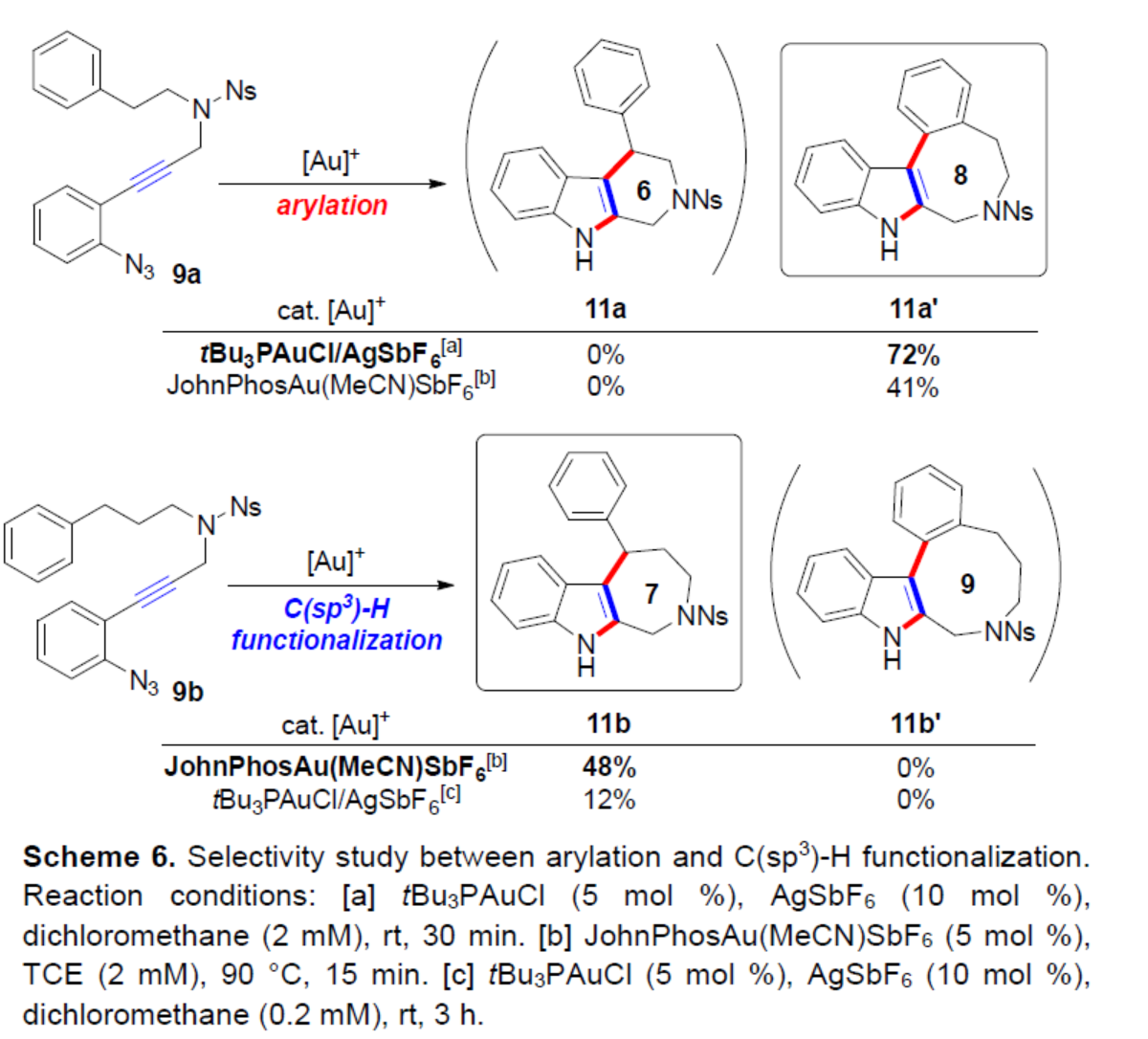
最后,作者對芳基化與C(sp3)-H官能團(tuán)化的選擇性進(jìn)行了研究(Scheme 6)。當(dāng)以六元環(huán)前體9a為底物,在兩種不同的金催化體系中反應(yīng),可以41-72%的收率得到八元環(huán)芳基化產(chǎn)物11a’,從而表明反應(yīng)更有利于芳基化,可能是由于七元ipso-環(huán)化途徑導(dǎo)致。相比之下,當(dāng)以亞甲基同源物9b作為底物,在JohnPhosAu(MeCN)SbF6催化體系中反應(yīng),通過遠(yuǎn)端芐基的官能團(tuán)化,可以48%的收率得到七元環(huán)吲哚稠合產(chǎn)物11b,而不是九元環(huán)芳基化產(chǎn)物11b’。上述結(jié)果表明,與通過芐基C(sp3)-H途徑進(jìn)行C-環(huán)化反應(yīng)相比,直接芳基化對高張力產(chǎn)物(如九元環(huán))的影響較小。
(圖片來源:Angew. Chem. Int. Ed.)
總結(jié)
日本京都大學(xué)Hiroaki Ohno課題組報道了一種金催化疊氮炔衍生物的芐基sp3(C-H)官能團(tuán)化反應(yīng),通過發(fā)散性N-或C-環(huán)化合成了一系列吲哚稠合的四環(huán)或五環(huán)化合物。其中,該反應(yīng)需在稀釋條件下使用非配位TCE和陽離子JohnPhosAu(MeCN)SbF6。此外,通過對乙基和異丙基底物的研究表明,可以通過C-環(huán)化或N-環(huán)化形成兩種異構(gòu)體。化學(xué)選擇性可通過調(diào)整疊氮取代的芳基單元的電子密度和芐基碳陽離子的穩(wěn)定性以及調(diào)節(jié)平衡陰離子效應(yīng)來控制。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn