

正文
(圖片來源:Nature Synthesis)
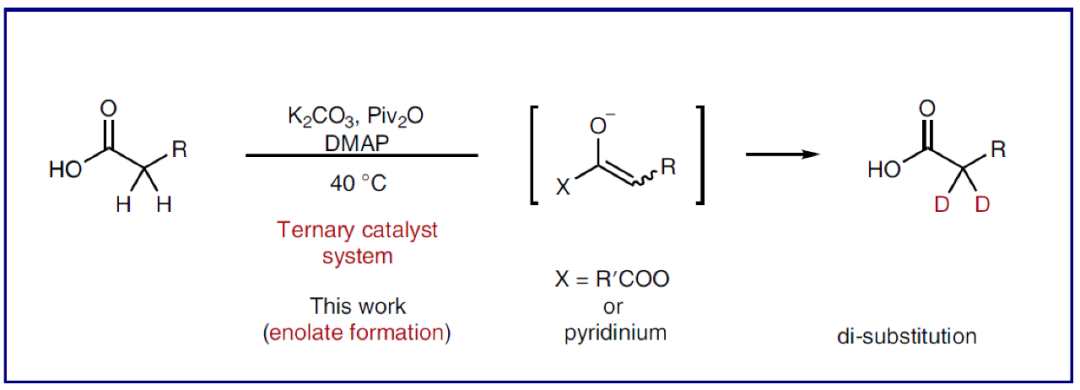
選擇性氘原子標記可以大大增強藥物的化學穩定性和耐受性,而對其功能的影響卻非常小(Fig. 1a)。因此,對氘標記分子的探索可以為多個科學領域功能分子的創新和發現提供新的途徑。羧酸是普遍存在于藥物(如非甾體抗炎藥)和天然產物中的重要結構單元。利用羧酸中羧基官能團的多樣合成轉化(如通過縮合生成酯和酰胺,通過氫化還原生成醇,通過Curtius重排生成胺)可以有效實現分子結構的多樣性,從而增強分子的功能性。此外,羧酸還可以烷基自由基或陽離子前體,應用于過渡金屬催化以及光催化反應中。因此,氘原子標記的羧酸可以作為一類有價值的氘化合成子應用于有機合成中。且發展溫和的、高選擇性的羧酸α-氘化方法具有重要意義(Fig. 1b)。盡管目前化學家們已經發展出一系列羧酸的氘標記方法,但發展一種溫和的,且可以應用于含羧酸骨架的藥物和天然產物中的高效氘化方法,仍然具有很大的挑戰。目前,利用強堿(如LDA)和氘化試劑可以實現單氘化過程。而若想實現雙氘化過程則需要更苛刻的反應條件,如更強的堿性條件和高溫等(Fig. 1c, left)。目前最先進的催化方法仍需要高溫條件且需要貴金屬參與(Fig. 1c, right)。雖然貴金屬可以催化實現脂肪酸的氘化,但目前還沒有發展出在溫和條件下高選擇性的實現羧酸α-氘化的方法。由于羧酸固有的Br?nsted酸性以及其α-位的弱酸性,因此通常需要兩當量以上的強Br?nsted堿才可以使羧酸形成烯二醇化物(Fig. 1d, left)。最近,日本九州大學R. Yazaki 和T. Ohshima課題組發展了一種三重催化體系(K2CO3, Piv2O, DMAP),在溫和條件下,高化學選擇性的實現了羧酸α-位的氘化反應。反應具有良好的官能團兼容性和底物適用性,并可以兼容眾多天然產物和藥物等結構復雜分子,具有良好的實用性(Fig. 1d, right)。
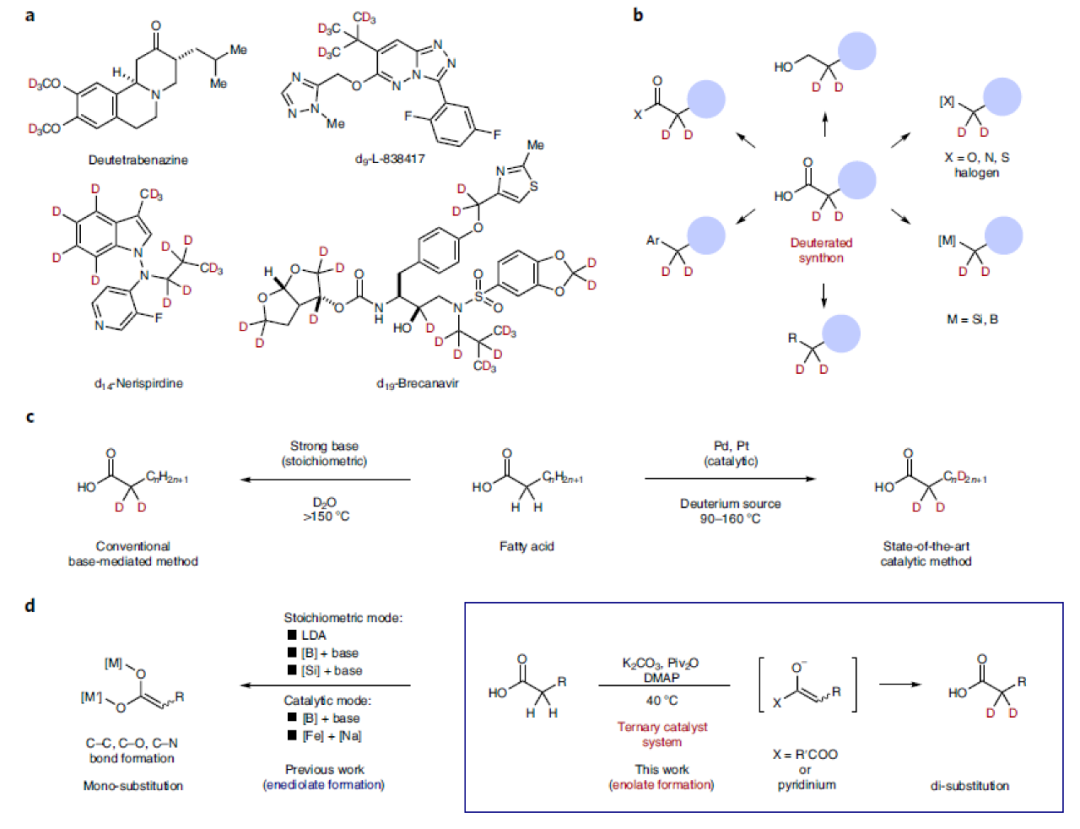

(圖片來源:Nature Synthesis)
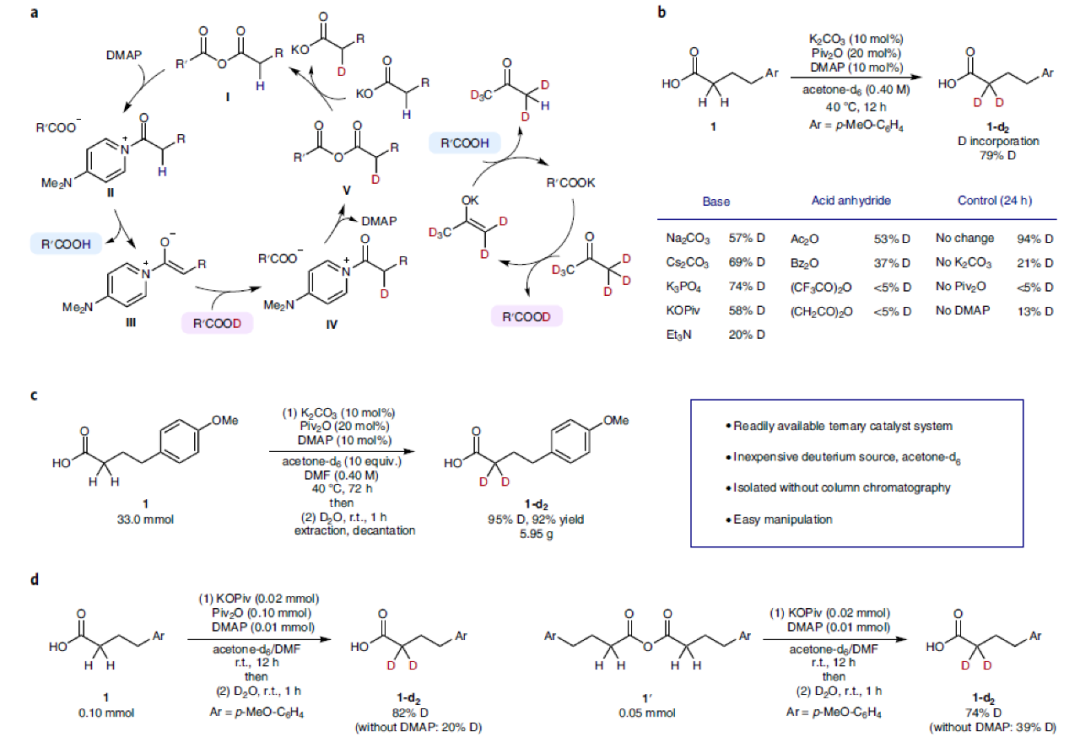
為了發展此策略,作者聚焦于α-H具有較強酸性的混合酸酐,其可以很容易的利用相應的羧酸制備。經典的Perkin反應表明,混合酸酐可以在弱Br?nsted堿的存在下有效脫質子,形成穩定的烯醇物種。作者認為,此反應可能通過以下機理進行的(Fig. 2a):首先混合酸酐I與DMAP形成吡啶鹽物種II,其在弱Br?nsted堿(羧酸鹽)作用下形成烯醇物種III并伴隨著羧酸鹽與混合酸酐的酰基交換。為了避免混合酸酐和吡啶鹽的水解,作者選用氘代丙酮作為氘源。烯醇物種III將被氘代羧酸氘化得到α-氘化酰基吡啶物種IV,隨后與羧酸鹽發生酰基交換得到α-氘代羧酸產物。
基于上述機理假設,作者利用4-(4-甲氧基苯基)丁酸1作為模板底物進行條件優化。通過條件篩選,作者發現使用K2CO3, Piv2O和DMAP的三重催化體系在氘代丙酮中反應24小時可以以94%的氘代率得到相應的產物1-d2。此外,作者通過控制實驗表明三種催化劑均很重要,缺一不可(Fig. 2b)。接下來,作者使用1作為原料進行了克級規模試驗,反應72小時后以重水淬滅可以以95%的氘代率得到產物1-d2,證明此轉化的實用性(Fig. 2c)。
為了進一步驗證上述機理,作者進行了控制實驗(Fig. 2d)。實驗結果表明DMAP可以有效促進烯醇化過程的進行。此外,計算結果表明通過酰基吡啶物種II的烯醇化過程是可行的。

(圖片來源:Nature Synthesis)
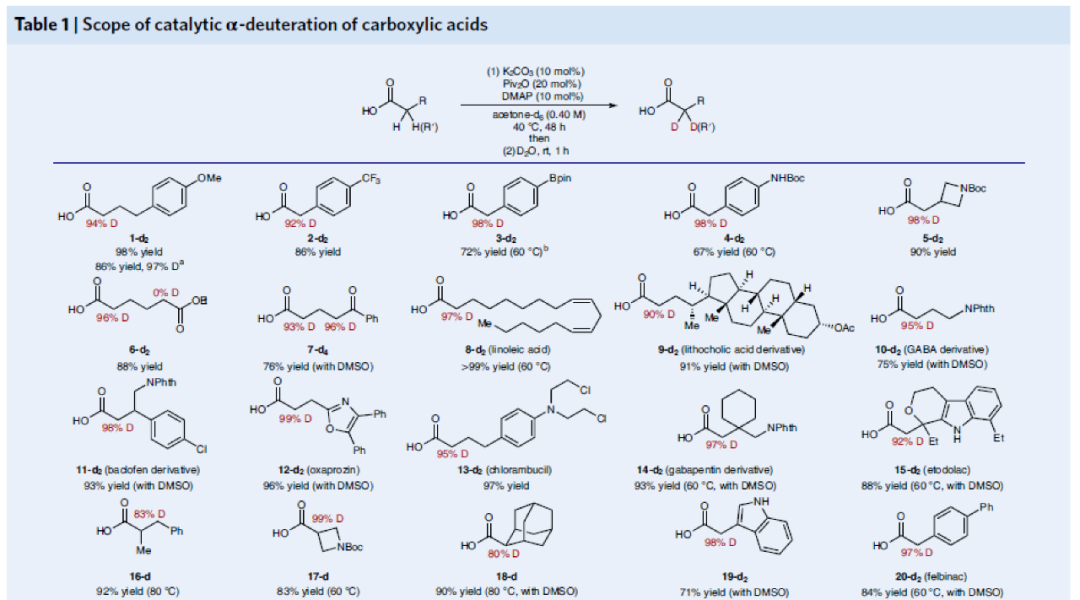
在得到最優反應條件后,作者對此羧酸α-氘化反應的底物范圍進行了考察(Table 1)。實驗結果表明此轉化具有良好的官能團兼容性和底物適用性。包括三氟甲基(2-d2)、頻哪醇硼酯(3-d2)、Boc保護的胺基(4-d2)、氮雜環丁烷(5-d2)等基團均可兼容。值得注意的是,對于天然產物(亞油酸6-d2、亞油酸衍生物7-d2、GABA衍生物8-d2-10-d2)和藥物(氯芬衍生物11-d2、惡丙嗪12-d2、氯霉素13-d2、加巴噴丁衍生物14-d2、依托多拉酸15-d2)等復雜分子也均可以兼容。此外,α-取代的羧酸也可以兼容(16-d2-18-d2)。除了烷基羧酸外,α-芳基羧酸(如聯苯乙酸、伊索克酸、消炎痛、舒林酸、酮洛芬、洛索洛芬等)也可以以類似的效率實現氘化過程(19-d2-27-d2)。此外,此反應對連有雜原子(S,O,N)的羧基α-碳原子的氘化過程仍然有效(28-d2-38-d2)。由此,一系列保護的α-氨基酸(丙氨酸、纈氨酸、絲氨酸、賴氨酸、蛋氨酸)和多肽衍生物也均可以利用此方法實現α-碳原子的氘代(32-d2-38-d2)。
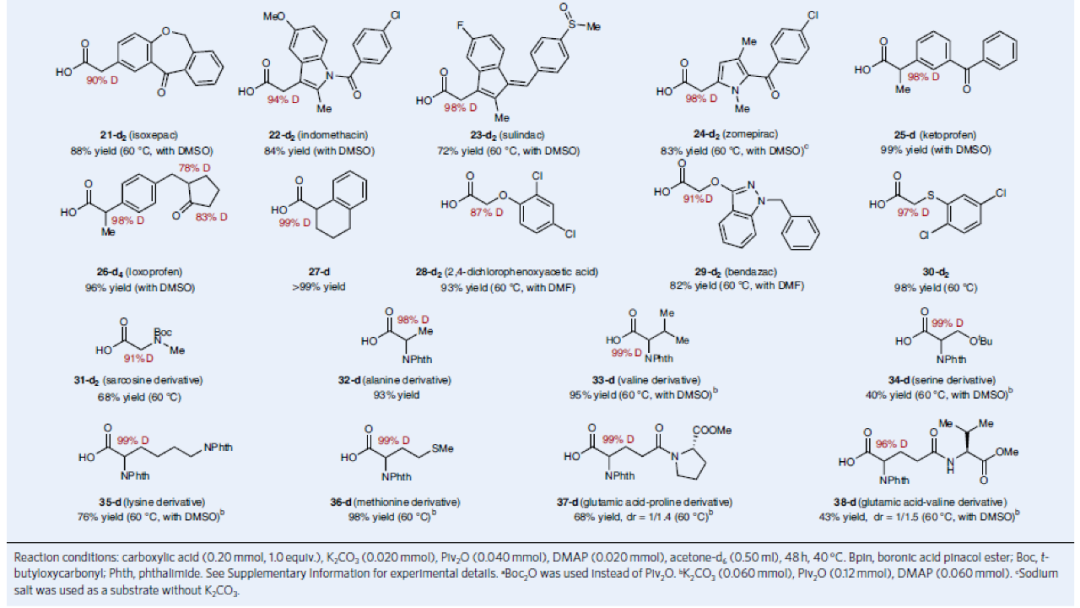
(圖片來源:Nature Synthesis)
接下來,作者對合成出的α-氘化產物進行了多種合成轉化(Fig. 3)。首先,作者使用合成出的產物1-d2,通過縮合、還原以及Curtius重排等過程實現了羧基的合成轉化,并且這些轉化過程對氘代率并沒有影響。隨后,作者利用衍生產物43-d2的脫羧反應分別實現了芐位氘化產物44-d2、α-氘化頻哪醇硼酯45-d2以及β-氘化酮46-d2的合成(Fig. 3a)。此外,作者分別成功實現了47-d2(Fig. 3b)和4-d2(Fig. 3c)的脫羧氘化反應,實現了端位氘代甲基產物的合成。以上合成轉化證明了此反應具有良好的實用性和應用性。
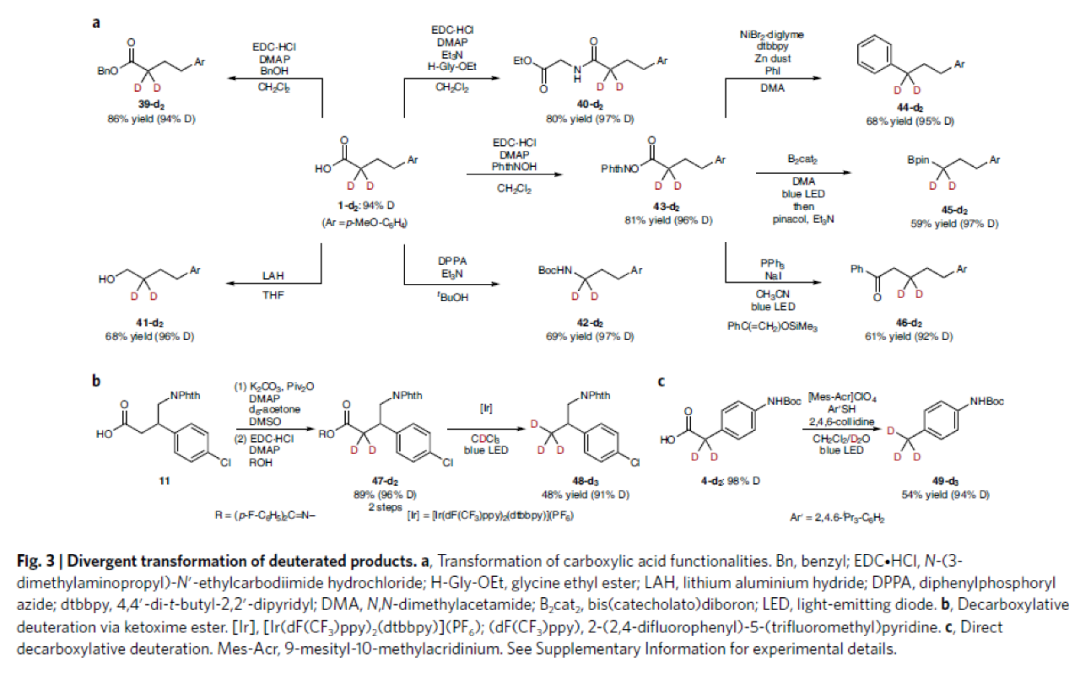
(圖片來源:Nature Synthesis)
最后,作者利用發展出的方法實現了氘化EP3受體拮抗劑60-d3的全合成(Fig. 4a)并對其其代謝穩定性進行評估(Fig. 4b)。實驗結果表明,氘代的EP3受體拮抗劑60-d3相比于非氘化的EP3受體拮抗劑60在人類細胞中的代謝穩定性得到增強。
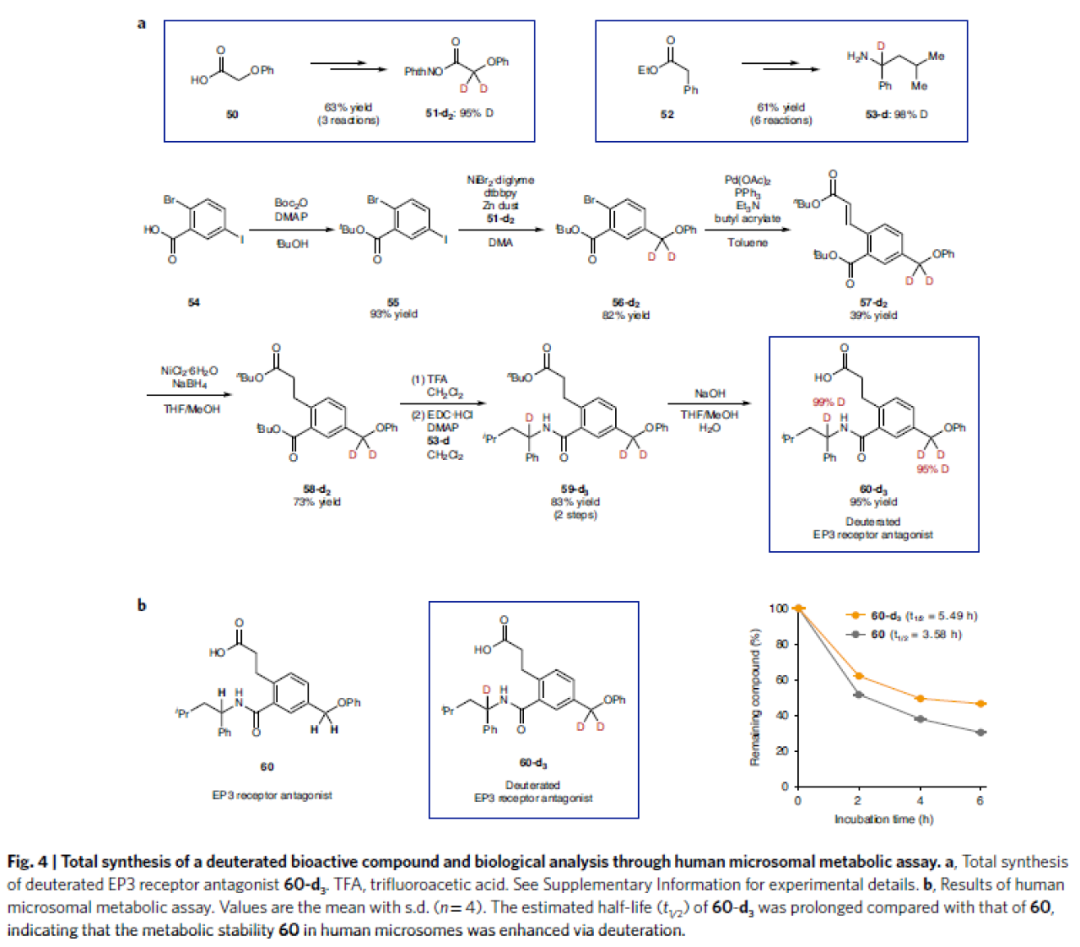
(圖片來源:Nature Synthesis)
總結
日本九州大學R. Yazaki 和T. Ohshima課題組發展了一種三重催化體系(K2CO3, Piv2O, DMAP),高效實現了羧酸α-位的氘化反應。反應條件溫和,可操作性強,且具有良好的化學選擇性和底物適用性。重要的是,此轉化可以兼容一系列天然產物和藥物等結構復雜分子,且可以進行大量合成。此外,作者對合成出的氘化產物進行了多種合成轉化并利用發展出的方法實現了氘化EP3受體拮抗劑60-d3的全合成,進一步證明了此反應的實用性。
文獻詳情:
長按或掃碼左側二維碼查看原
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn