

在過去的幾十年里,利用氟獨特性質的合成方法得到了廣泛發展。通常含氟底物顯示出與非氟化對應物不同的反應模式。在這方面,C-F鍵的選擇性轉化為難以合成的具有結構多樣性的脫氟化合物提供了一個新的策略。同時包含烯基單元和氟取代烷基的烯丙基氟化物代表了一類重要的有機氟化物。與其它有機鹵化物相比,它們表現出獨特的反應性和選擇性。首先,與氟烷基相連的 π 側鏈體系會顯著降低相關的脂肪族 C-F 鍵解離能,因此在溫和條件下易于其裂解。其次,氟烷基取代基的固有電子特性和空間效應使 C-C 雙鍵容易受到親核進攻或自由基加成,隨后發生 β-氟消除,從而在烯丙基上引入具有多種功能性的基團。此外,當引入具有兩個親核中心的功能性試劑時,可以通過一鍋法或兩步法進行連續的C-F鍵取代反應完成環化。
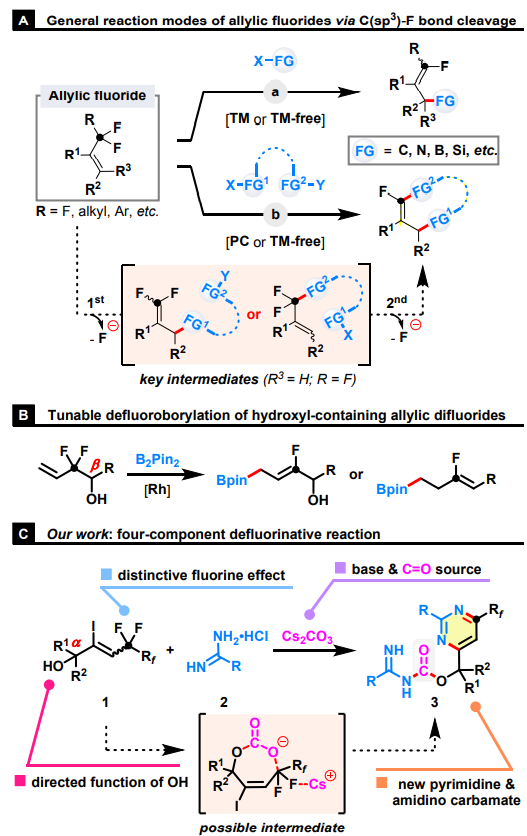
圖1. 研究背景及本文的工作(圖片來源:Green Chem.)
受上述反應的啟發,作者利用兩個惰性烯丙基C(sp3)-F鍵斷裂來組裝復雜的脒基甲酸酯(圖1)。這種多鍵形成串聯策略是通過在溫和的反應條件下使用含羥基的烯丙基氟化物、脒和Cs2CO3巧妙實現的。合成的關鍵可歸因于原位生成的碳酸根陰離子對C-F鍵活化的引導功能。此外,全氟烷基還發揮活化作用以調節 C-C 雙鍵和烯丙基 C-F 鍵的反應性。這項工作具有幾個明顯的優勢:(1)能夠以高效的四組分反應從“易于制備”的起始原料中區域選擇性地提供“難以制造”的氟化產物;(2)利用惰性C-F鍵的轉化,構建具有四個新的C-N/C-O鍵和一個六元雜環結構;(3)使用Cs2CO3作為廉價、綠色和易得的CO等價物,避免了極其危險、易燃、易爆和有毒的一氧化碳氣體或其它敏感試劑的參與;(4)一種無催化劑和無添加劑的反應,底物范圍廣,操作簡單,步驟經濟,滿足綠色化學的要求。
作者以5,5,6,6,7,7,8,8,8-九氟-3-碘-2-甲基-3-辛烯-2-醇(1a)和苯甲脒鹽酸鹽(2a)作為模板底物,通過對溫度、堿、溶劑和時間的篩選,最終發現以Cs2CO3作為羰基源和堿,DMA作溶劑,室溫下反應24小時可以89%的分離收率得到目標嘧啶雜環脒基甲酸酯化合物(圖2)。
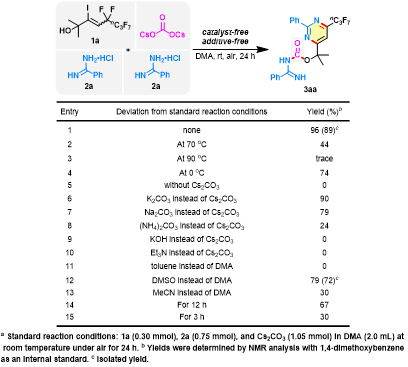
圖2. 條件優化(圖片來源:Green Chem.)
在最優反應條件下,作者系統研究了底物適用范圍(圖3)。首先,研究了脒類鹽酸鹽上取代基的影響,以5,5,6,6,7,7,8,8,8-九氟-3-碘-2-甲基-3-辛烯-2-醇(1a)作為反應底物,帶有不同基團的苯基甲脒鹽酸鹽,包括甲氧基、乙氧基、甲基、鹵素、硝基和氰基等,都能以中等至良好的收率獲得相應的嘧啶雜環脒基甲酸酯化合物(3aa-3ak),說明苯甲脒芳環上具有不同電性(給電子或吸電子)或空間位阻要求(對位、間位和鄰位)的取代基不影響反應性能。噻吩基、環丙基取代的脒類鹽酸鹽也能順利完成該轉化,得到相應產物(3al-3am)。同時分離出無環狀結構的脒基甲酸酯3al',猜測是脫氟過程中形成的可能中間體。
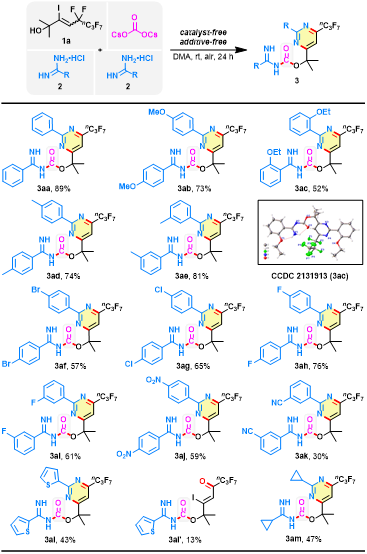
圖3. 底物擴展一(圖片來源:Green Chem.)
作者進一步探索了α-位羥基烯丙基氟化物的底物適用范圍(圖4)。4~10個碳的全氟烷基鏈長度對反應結果的影響較小,均能得到嘧啶雜環脒基甲酸酯化合物(3ba-3da)。但是具有三氟甲基的烯烴(1e)未能產生任何單氟化產物(3ea),這可能是由于三個氟原子的屏蔽特性所致。其它具有與羥基相鄰的全取代碳手性中心的烯丙基氟化物(1f-h)已成功應用于當前的脫氟轉化。雖然1i 和1j 反應收率較低,但相應的產物3ia和3ja很難通過常規方法合成得到。此外,1k、1l和1m也是合適的反應底物,均能順利反應。
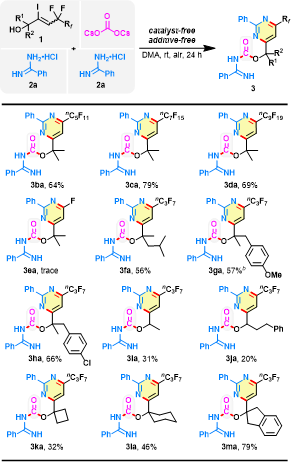
圖4. 底物擴展二(圖片來源:Green Chem.)
隨后,作者嘗試將模板反應放大至克級規模(圖5),在克級規模下沒有出現明顯產率下降。作者還對3aa進行了部分衍生化,在PhINTs 或 TfOH 存在的情況下,氧化胺化和水解順利進行,提供潛在的藥物分子4和5。
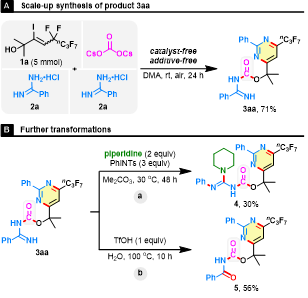
圖5. 規模化合成及合成應用(圖片來源:Green Chem.)
為了揭示反應機理,作者進行了一系列控制實驗(圖6)。首先,增加羥基和C-C雙鍵之間的束縛烷基鏈的長度(1n),反應結束后沒有檢測到預期的產物3na。其次,將簡單的叔醇1o或預合成的雜環醇1p作為反應底物,反應結果被證明是無效的。這些結果表明:(1)全氟烷基對CO捕獲很重要;(2)雜環醇1p不是真正的中間體,即脒2與含羥基的烯丙基氟化物1的競爭縮合可能不參與反應過程;(3) 排除了自由基中間體的存在,因為在模板反應中加入自由基捕獲劑TEMPO并沒有抑制脫氟官能化。
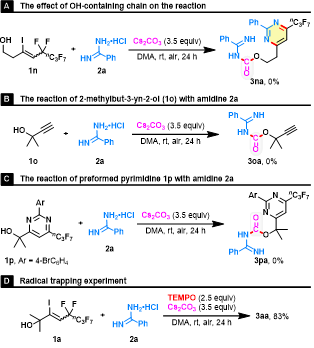
圖6. 機理研究(圖片來源:Green Chem.)
在這些控制實驗和先前報道的 C-F 鍵活化的基礎上,作者提出了一種合理的機制(圖7)。首先,含羥基的烯丙基氟化物1與Cs2CO3 反應生成活性的非環碳酸酯 A,該碳酸酯在親氟 Cs+ 的幫助下通過親核脫氟取代進行分子內環化,生成不穩定的B。物種B可以通過HRMS分析檢測得到。另外,靠近羥基部分的空間擁擠的季碳中心有利于轉化也說明反應可能經歷環狀中間體。此外,多氟烷基獨特的氟效應對烯丙基 C-F 鍵的活化起著至關重要的作用。生成的B在堿性條件下被脒2親核進攻,隨后消除氟原子以形成開環的脒基甲酸C。接下來,中間體C與另一分子脒2通過中間體 D-E完成縮合、脫碘和芳構化形成相應的氟化產物3。
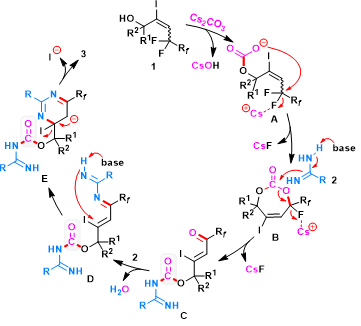
圖7. 可能的反應機理(圖片來源:Green Chem.)
總結 褚雪強、沈志良團隊開發了一種在無過渡金屬條件下的烯丙基氟化物、脒和Cs2CO3的四組分脫氟反應。以中等至良好的收率合成了多種有用且具有潛在生物活性的含嘧啶環的脒基甲酸酯化合物,反應具有良好的官能團耐受性。該串聯方法涉及兩個烯丙基C(sp3)-F鍵官能團化、Cs2CO3作為綠色羰基源提供CO單元、形成四個新的C-N/C-O鍵和一個六元嘧啶環結構,提供了一種新的合成高度官能團化的脒基甲酸酯衍生物方法。此外,所得產物可以轉化為多種含氟化合物。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn