

(圖片來源:J. Am. Chem. Soc.)
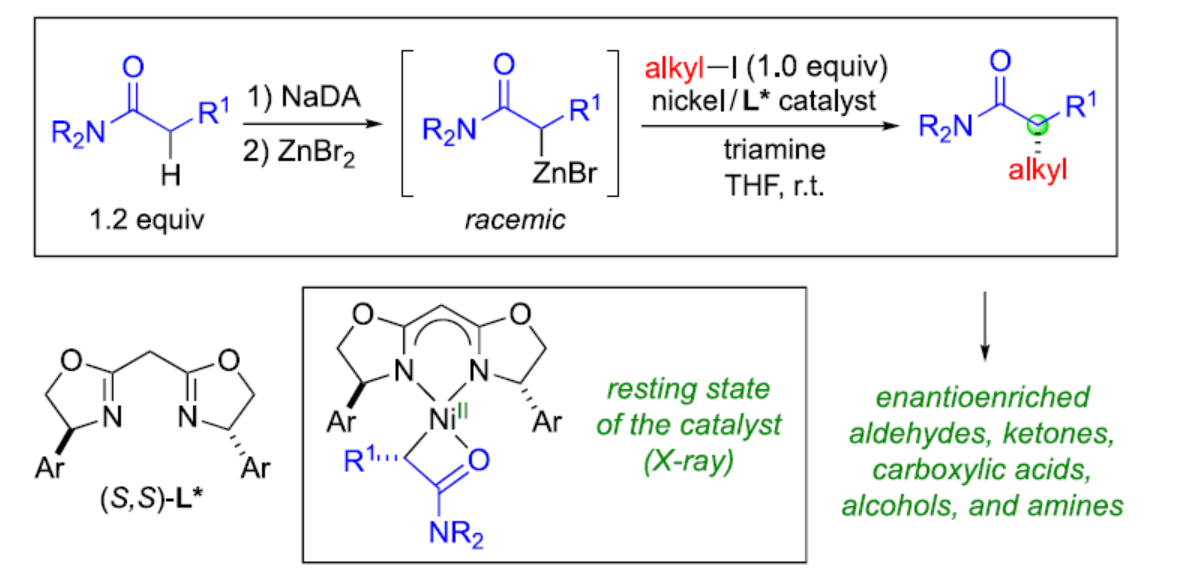
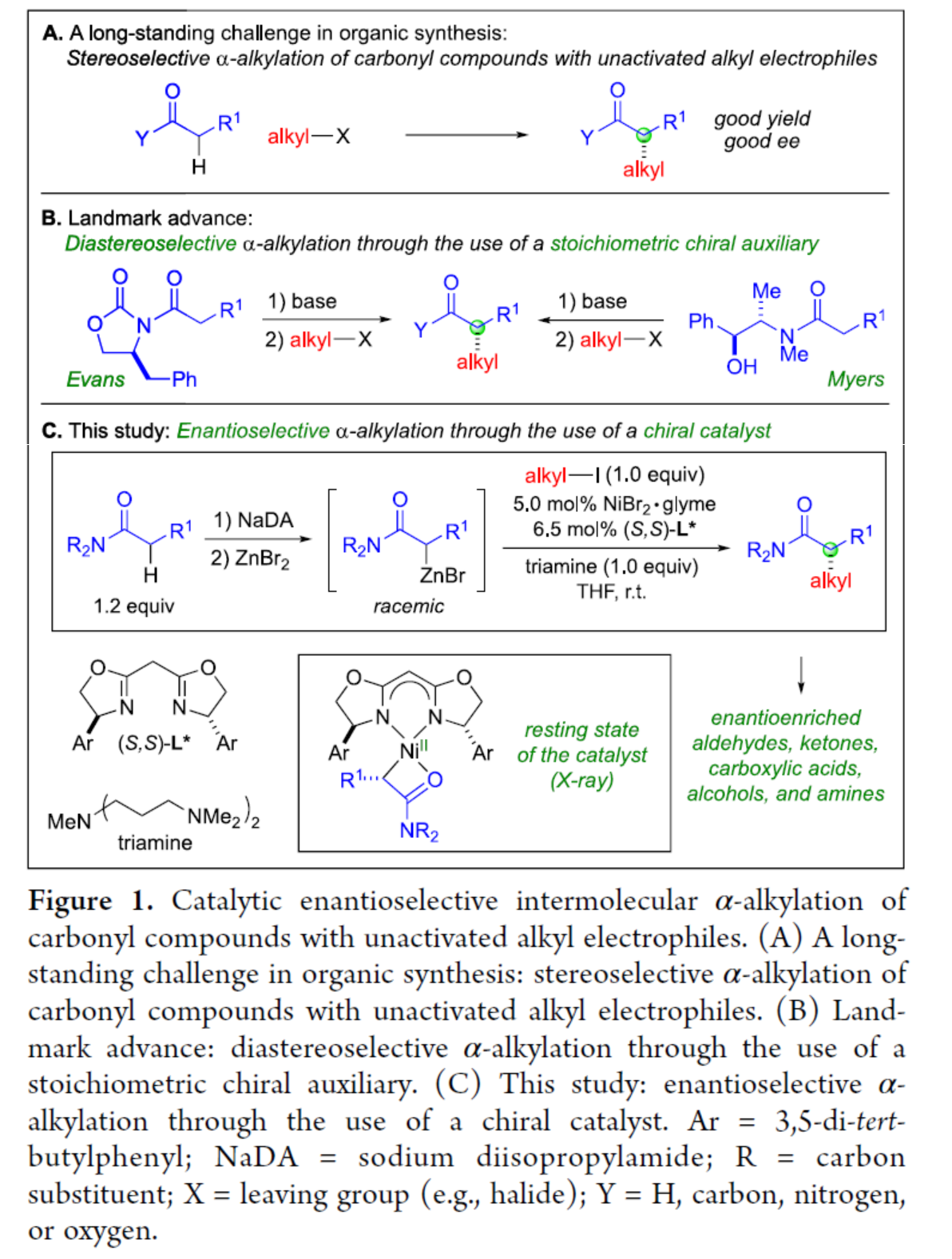
含有α-手性中心的羰基骨架廣泛存在于各類生物活性分子中,因此對于此類骨架的構建一直是有機合成的長期目標(Figure 1A)。烯醇化物的α-烷基化反應是構建此類化合物最為直接的方法。目前,Evans、Myers等團隊通過使用化學計量的手性輔助劑,實現了羰基衍生物的非對映立體選擇性α-烷基化反應(Figure 1B)。然而,通過使用手性催化劑實現對映選擇性α-烷基化反應仍有待進一步的研究。此外,對于不對稱催化α-烷基化反應,主要集中于一些特定的底物。近日,加州理工學院Gregory C. Fu課題組報道了一種鎳催化酰胺與非活化烷基親電試劑的催化對映選擇性α-烷基化反應,合成了一系列含有α-手性中心的酰胺衍生物,涉及外消旋Reformatsky試劑的形成過程(Figure 1C)。同時,通過后期衍生化實驗,可獲得一系列具有價值的手性化合物
(圖片來源:J. Am. Chem. Soc.)
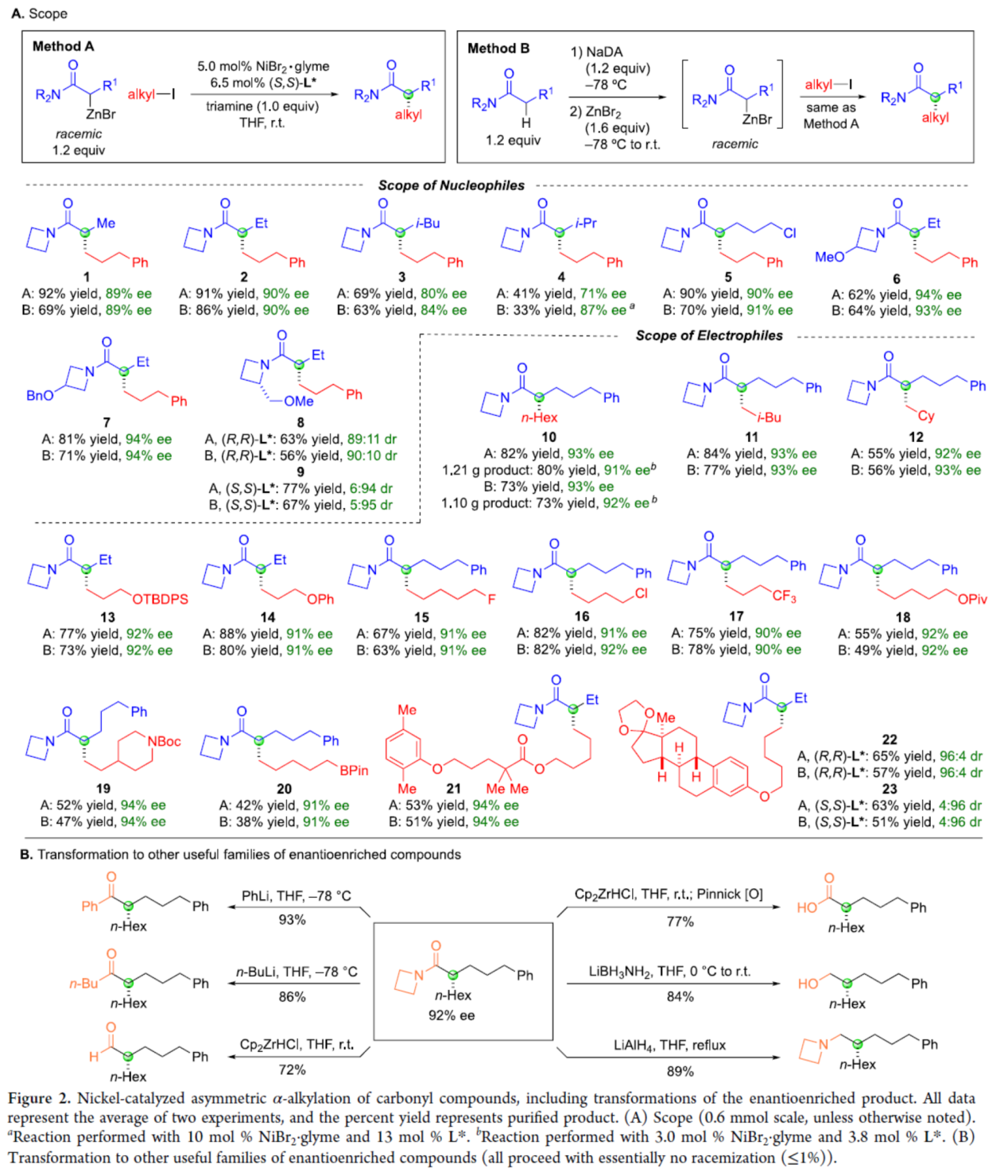
最初,作者采用外消旋Reformatsky試劑作為親核試劑,在Method A條件下與烷基碘進行反應,合成了一系列手性α-烷基化產物。隨后,作者采用酰胺為底物,通過去質子化生成相應Reformatsky試劑,再經原位鎳催化的不對稱α-烷基化反應,可通過一鍋法,以相似的收率和對映選擇性獲得手性α-烷基化產物。同時,在對底物范圍擴展時發現(Figure 2A),當酰胺底物R1為各種烷基時,均可順利反應,獲得相應的產物1-9,收率為33-92%,ee為71-94%。其中,對于氮雜環丁烷帶有手性中心的底物,反應的立體化學不受影響,如產物8和9。其次,一系列非活化的烷基碘底物,均與體系兼容,獲得相應的產物10-23,收率為38-88%,ee為90-94%。其中,克級規模實驗,同樣能夠獲得與小試相似的結果,如10。此外,合成的手性α-烷基化產物可進一步轉化為一系列對映體富集的化合物,如羧酸、醇、醛、酮和胺的衍生物(Figure 2B)。
(圖片來源:J. Am. Chem. Soc.)
緊接著,作者對反應的機理進行了研究(Figure 3)。首先,通過對外消旋有機鋅親核試劑Zn-2的晶體學分析揭示了固態二聚羰基-橋接的C-金屬化結構(Figure 3A)。二聚體Reformatsky試劑是異手性(heterochiral)的,具有手性中心碳的C2-C3-C4、C2-C3-Zn1和C4-C3-Zn1鍵角范圍為106°-115°。同時,通過NMR對Reformatsky試劑的研究發現,Zn-2的結構與C-金屬化結構一致,與O-結合的鋅烯醇化物不一致。在紅外光譜中,Zn-2在1597 cm-1處具有明顯的吸收峰,歸因于羰基的C=O拉伸。其次,通過紫外-可見光譜發現,NiC是偶聯反應過程中催化劑的靜止狀態(Figure 3B)。同時,UV-vis光譜顯示λmax = 449 nm,作者認為鎳(II)配合物可能是造成這種吸光度的原因。因此,作者合成了鎳(II)配合物(Figure 3C)。NiA經LiHMDS處理,可獲得98%收率的NiB,并且顯示出不同于催化偶聯的UV-vis光譜,但與使用一當量Reformatsky試劑Zn-2與NiA反應時生成的光譜基本相同,從而表明在催化開始時通過Zn-2對NiA的去質子化形成了NiB。NiB可進一步反應,生成NiCEt和NiCOMe配合物。這兩種烷基鎳(II)配合物的紫外可見光譜與催化偶聯的光譜非常相似,并與這種配合物在反應過程中處于催化劑的靜止狀態是一致的。同時,作者還對NiCOMe配合物進行了相關的X-射線晶體結構分析。通過1H NMR對NiCEt的分析表明,在α-碳上存在兩種差向異構體,比例為4:1。NOESY實驗表明,主要的非對映異構體有利于在α-碳上形成S構型。此外,非對映異構體(S與R)可相互轉化,可使差向異構體的混合物(4:1)以高對映選擇性獲得相應的α-烷基化產物。
(圖片來源:J. Am. Chem. Soc.)
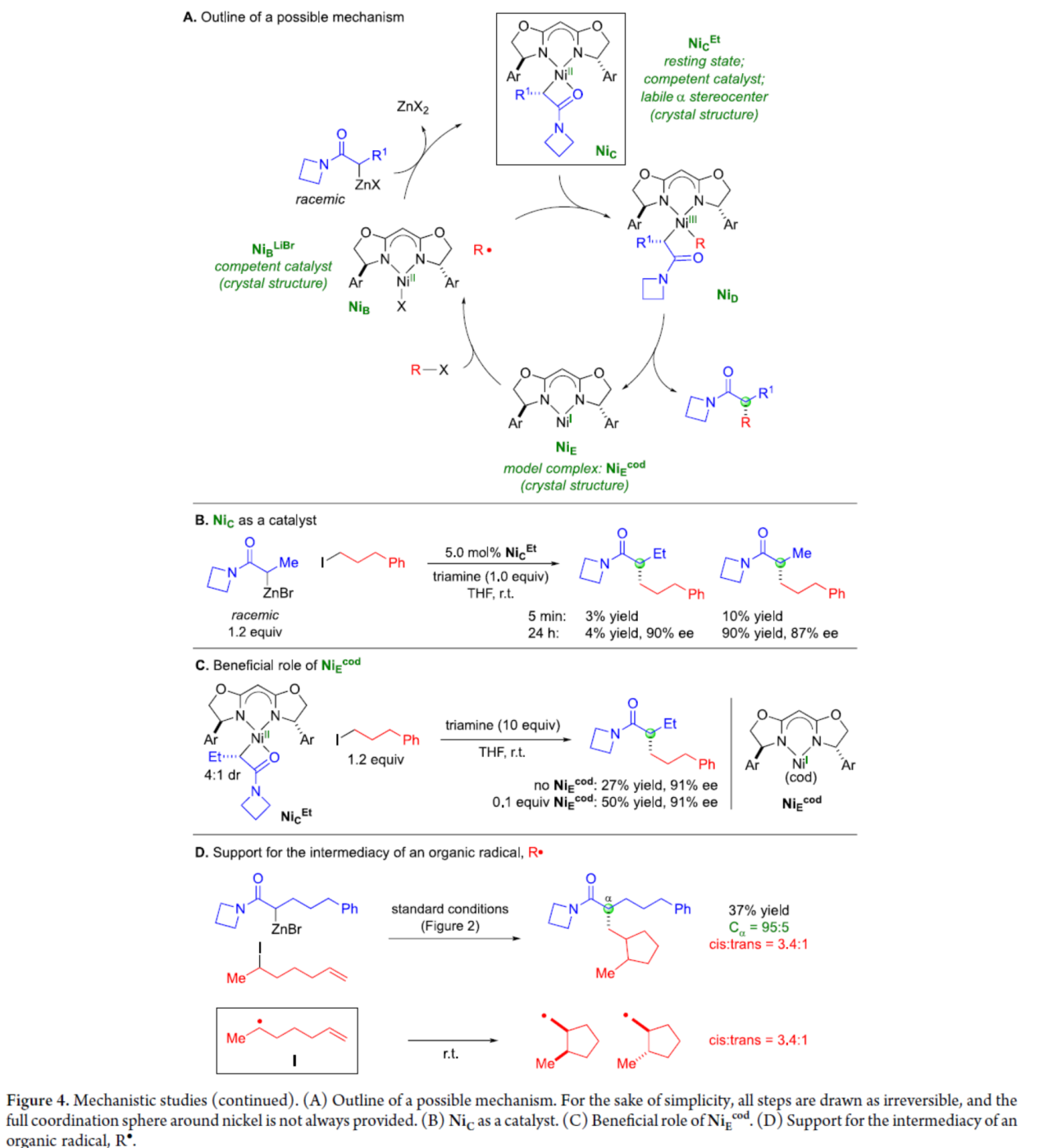
基于上述的研究以及相關文獻的查閱,作者提出了一種合理的催化循環過程(Figure 4A)。首先,NiBr2·glyme、L*和Reformatsky試劑反應生成NiC,這是鎳在催化偶聯過程中的靜止狀態。鎳(I)金屬自由基NiE從親電試劑(R-X)中攫取一個鹵原子,得到烷基自由基(R?)和NiB(可與Reformatsky試劑反應生成NiC)。烷基自由基R?與NiC偶聯,生成二烷基鎳-(III)配合物NiD。NiD經還原消除,可生成對映體富集的α-烷基化產物并再生鎳(I)配合物NiE。
其次,當使用了NiCEt作為催化劑的對比實驗表明,NiCEt和Reformatsky試劑之間的有機基團交換相對于NiCEt形成碳-碳鍵的速率,并未迅速發生(Figure 4B)。在NiCEt與烷基親電試劑的反應體系中加入NiEcod時,反應的收率明顯提高,表明NiEcod配合物可促進碳碳鍵的形成(Figure 4C)。此外,當使用6-碘庚烯與Reformatsky試劑的反應,進一步證明了反應形成了有機自由基中間體R?(Figure 4D)。
(圖片來源:J. Am. Chem. Soc.)
總結:加州理工學院Gregory C. Fu課題組報道了一種使用手性鎳催化劑,實現了外消旋Reformatsky試劑與非活化烷基親電試劑的對映匯聚性偶聯反應,合成了一系列含有α-手性中心的酰胺衍生物。同時,使用酰胺底物,通過一鍋法也可實現相應手性產物的合成。同時,該反應具有良好的官能團兼容性,且通過后期衍生化實驗可獲得一系列具有價值的手性化合物(對映選擇性不受影響)。機理研究表明,反應涉及烷基鎳(II)靜止狀態關鍵中間體的形成。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn