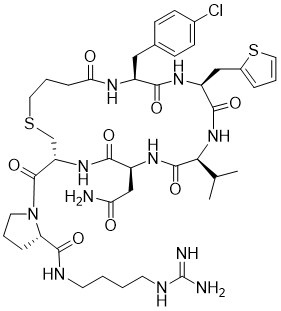
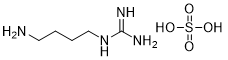
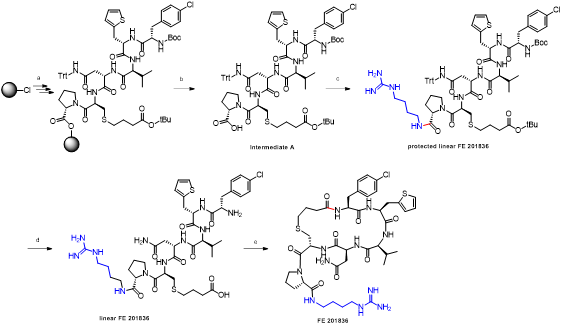
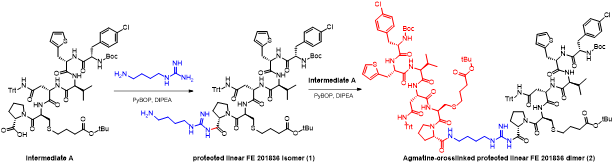
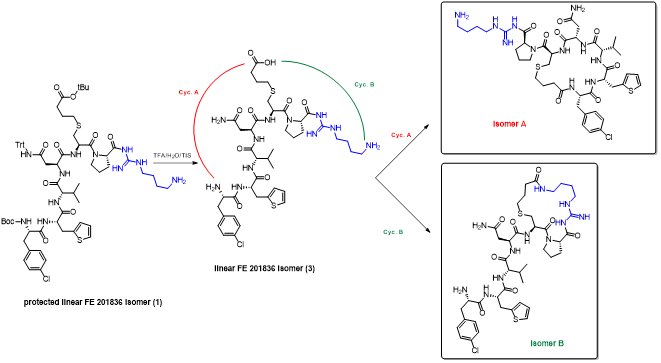
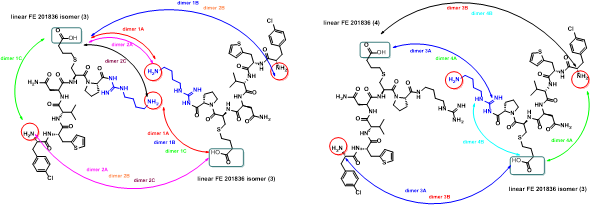
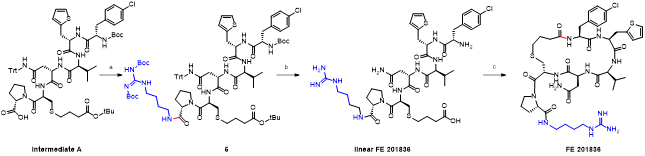
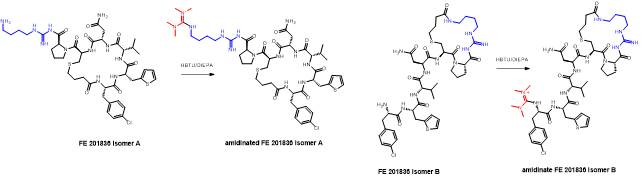胍丁胺又名1-(4-氨基丁基)胍,是一種精氨酸經精氨酸脫羧酶 (ADC)脫羧作用而衍生的化合物。它具有廣泛的治療應用,包括糖尿病、神經外傷和神經退行性疾病,阿片類藥物成癮,情緒障礙,認知疾病和癌癥。胍丁胺結構也存在于多種天然化合物,如 E-642 或以及像 blenoxane 的多肽類藥物,并經常用作精氨酸在肽 C 末端替代以探索受體-配體作用。氨基的amidination是最常見的一種合成胍化合物的方法。碳二亞胺、O-甲基異脲、硫脲、異硫脲、 氨基(亞氨基)甲磺酸、氯甲脒、1H-吡唑-1-甲脒,N-三氟甲脒,和氰胺 傳統上被用于將胺轉化為相應的受保護或未受保護的胍化合物。盡管在合成方面取得了某些應用,在工業中大量生產胍丁胺多肽藥物仍然受到傳統工藝的限制。因為相應的amidination條件通常要求金屬基催化劑、加熱、氧化劑或長反應時間。此外,多肽中親核官能團的存在,可能進一步限制amidination策略的應用。去氨加壓素的類似物多肽FE 201836, 一種作為血管加壓素-2受體激動劑和針對夜尿癥的環狀硫醚肽,在其多肽的 C 端帶有胍丁胺殘基(Scheme 1)。FE 201836 有一個 Thi (噻吩基丙氨酸)殘基和硫醚結構,它們都對親電試劑高度敏感,可以發生例如氧化和碘化的副反應。目標胍丁胺部分可以通過1,4-丁二胺前體上氨基的amidination反應實現,但這個過程可能會對Thi和硫醚產生副反應。鑒于這些限制,一個使用溫和的合成策略引入胍丁胺成為重點內容。胍丁胺硫酸鹽(Scheme 2) 是一種市售化合物,對很多疾病具有廣泛的治療潛力。它也經常被用作營養補充劑。這種原料可能被用作胍丁胺替代品制備 FE 201836 肽。在 FE 201836 合成過程中,前體線性肽中間體 A 首先在 CTC 樹脂上進行固相合成, 然后被 10% (v/v) HFIP(六氟異丙醇)/DCM(二氯甲烷)切割,并在MTBE (甲基叔丁基醚)中沉淀分離。胍丁胺硫酸鹽在隨后的步驟中與中間體 A 縮合,制備側鏈保護的線性 FE 201836。然而,胍丁胺硫酸鹽難溶于普通有機溶劑,不能直接與濃度合適的多肽溶液偶聯。因此,胍丁胺硫酸鹽首先在水溶液中用 2 equiv NaOH 中和,然后凍干分離;通過如此手段獲得的free base 胍丁胺硫酸鹽溶解在 DMF 中(1.92當量),與 1當量的多肽中間體 A ,在1.05 當量 PyBOP和 2.5當量的 DIPEA(二異丙基乙胺)存在下進行液相縮合反應,組裝側鏈保護的線性 FE 201836。后者受到TFA(三氟乙酸)/TIS(三異丙基硅烷)/H2O的脫保護處理得到線性 FE 201836。在隨后的酰胺環化反應中,線性 FE 201836多肽的羧酸與氨基在1.3 equiv HBTU 作用下對接,并合成目標FE 201836多肽。FE 201836的流程合成Scheme 3 所示。Scheme 3. Free base 胍丁胺介導的FE 201836合成路線 (a: 固相多肽合成; b: 10% HFIP/DCM; c: freebase agmatine/PyBOP/DIPEA/DMF; d: TFA/TIS/H2O; e: HBTU/DIEPA/DMF)Free base胍丁胺的偶聯反應在室溫下2小時內完成。側鏈保護線性 FE201836中間 產品經 RP-HPLC 分析,檢測到兩個豐度為 9.5 和 10.9% 的雜質。LC/MS 分析顯示它們可能是異構體 1,以及通過胍丁胺交聯的側鏈保護線性 FE 201836 二聚體 2。隨后,該側鏈保護的線性 FE 201836 中間品粗產物用濃縮的 TFA 溶液以去除保護基團。同時產生的線性 FE 201836 位置異構體雜質 3 和胍丁胺交聯的線性 FE 201836 二聚體,其化學結構的認證得到NMR數據的支持。該位置異構雜質和二聚雜質產生的根本原因在于多肽中間體 A 的羧基與胍丁胺胍基之間的反應。一般認為,胍基的親核性在酸性到弱堿性的情況下基本上受到抑制。胍基的親核性在普遍有機反應的pH 條件下通過質子化顯著減弱。然而,胍化合物被視為超級有機堿并具有明顯的親核性,這種性質可以賦予它們親核催化劑的作用。在本課題反應中,胍丁胺中的胍基在與肽分子偶聯之前被中和,其親核性被喚醒。去質子化的胍基因此與其4-氨基形成競爭反應,與肽分子上羧基反應而形成位置異構體雜質 1。這個過程原則上類似于在 Fmoc-Arg-OH在其羧基活化過程中的內酰胺副反應。位置異構雜質 1上有一個未配對的氨基,可以在反應中與另一個多肽中間體 A 肽分子作用,產生胍丁胺交聯的二聚體雜質 2 (Scheme 4)。Scheme 4. Free base 胍丁胺介導的位置異構體以及二聚體雜質的形成過程。線性 FE 201836 位置異構體雜質的命運研究 (Fate Study)值得注意的是,側鏈保護的線性 FE 201836 位置異構體 1 會干擾后續環化反應。在經過TFA處理后,所得線性 FE 201836 位置異構體 3 帶有一個羧基和兩個氨基,理論上可以引發兩種位置異構雜質(異構體A和B)(Scheme 5)。此外,線性 FE 201836 位置異構體 3 也可以在環化步驟中與另一個分子 3 或普通線性 FE 201836分子4作用,分別產生六種或四種二聚雜質 (Scheme 6)。Scheme 5. 由側鏈保護的線性FE 201836位置異構體雜質1 所引發的FE 201836 異構體 A/B 的形成。Scheme 6. 兩分子線性FE 201836位置異構體雜質3形成的二聚體雜質,以及一分子線性FE 201836位置異構體雜質3與一分子線性FE 201836形成的二聚體雜質。探尋從中間體里檢測到的異構雜質的命運總是很有必要的,包括它們在隨后的合成步驟中的轉化,最終異構體雜質的化學結構,這些異構體雜質在產品中的可檢測性和去除率。為此,通過色譜純化分離得到線性FE 201836位置異構體雜質3,并作為反應物進行接下來的環化。通過LC/MS分析產物,異構體 A 和異構體B被檢測出,其豐度為60.8% 和5.1%(對應性并不確定)。FE 201836 異構體 A 和 B 均有一個未配對的氨基,它們可能在環化反應中與過量的 HBTU 反應,轉化為相應的胍對應物(Scheme 7)。如此得到的amidinated異構體 A 和 B 均已在粗品中檢測到,其中之一的含量高達 23.0%。此外,在反應混合物中檢測到二聚體,這應該歸因于由線性 FE 201836 異構體所誘導六種可能的異構二聚體之一(Scheme 6)。因為這六個二聚體雜質中的每一個都有一個未配對的氨基,它們仍然容易受到HBTU的amidination的影響。事實上,在粗產物中已經檢測到2 個amidinated的異構二聚體。Scheme 7. FE 201836異構體A/B的amidination產物。綜合以上實驗和分析可以得出的結論是,線性 FE 201836 位置異構體可以進行多種反應,包括環化、二聚化和amidination。兩個線性 FE 201836 位置異構體雜質之間的二聚化實際上是有利于目標肽的合成,因為兩個位置異構體雜質被消耗以形成另一種二聚體雜質,該二聚體雜質可以通過色譜純化從產品中輕松去除。然而,線性 FE 201836位置異構體也可以與線性FE 201836分子二聚化而形成混合二聚體,如Scheme 6 所示。此類副反應消耗線性 FE 201836 分子并降低反應收率。命運研究得出的最突出結論是,由線性 FE 201836 位置異構體雜質所導致的FE 201836 異構體A/B,以及二聚雜質,一旦形成,可以采用反相高效液相色譜法檢測到,其檢測方法具有高可檢測性并明確區別于目標產品 FE 201836。因此,從FMEA 的視角(Failure Mode Effect Analysis),產品質量的完整性將通過如此高的可檢測性得以保障,因為它們的去除可以明確地遵循和評估。通過 Bis-Boc-胍丁胺合成FE 201836鑒于由free base胍丁胺所引發的位置異構體雜質,以及該工藝的低收率和低粗品低純度(71.0%),應該在FE 201836 合成中使用合適的胍丁胺替代品。胍基上的 Boc 保護基團可以顯著提高提高母體胍丁胺分子在有機物溶劑中的溶解度,因此可以避免不必要的胍基中和步驟。實際上,Fmoc-Arg(Boc)2-OH 已經廣泛用作肽合成。同樣,Bis-Boc-胍丁胺也被認為是FE 201836合成中一種潛在可行的構建塊,以繞過胍丁胺硫酸鹽中和的步驟,并徹底避免各種位置異構體和相關二聚雜質的形成。Bis-Boc-胍丁胺定向合成FE 201836的過程如Scheme 8 所示。Scheme 8. Bis-Boc-Agmatine 引導的 FE 201836 合成路線 (a: Bis-Boc-agmatine/PyBOP/DIPEA/DMF; b: TFA/TIS/H2O; c: HBTU/DIEPA/DMF).事實證明,1.05 equiv bis-Boc-agmatine, 1.05 equiv PyBOP 和 2.5 equiv DIPEA足以使縮合反應在室溫條件下 30 分鐘內完成。在這個過程中沒有異構體或二聚體雜質產生。得到純度為 92.8% 的中間體 5,未校正的收率為 96.7%。使用由 60 equiv TFA, 1.5 equiv TIS 和 6 equiv H2O溶液對 多肽5 進行脫保護,得到純度為 91.0%線性 FE 201836 中間體,其未校正收率為100%。所得的線性 FE 201836通過“偽高稀釋策略“環化反應獲得最終產品 FE 201836,粗品純度為 87.8%,在這個過程中產生的常規二聚雜質小于含量 1.5%。粗品通過 LC/MS進行分析,不含環狀異構體、amidinated二聚體、胍丁胺交聯二聚體、和二聚體異構體。粗品純度從 70.9%(free base 胍丁胺工藝)顯著提高到 87.8%(Bis-Boc-胍丁胺),并且下游純化工藝的復雜性明顯減輕。Bis-Boc-胍丁胺代替free base胍丁胺因此全局顯著優化了整體生產工藝。
在本研究闡述了胍丁胺中胍基所引發的副反應。來自free base胍丁胺的去質子化胍基與其4-氨基產生競爭反應,產生位置異構雜質。該位置異構雜質上的未配對氨基可以參加合成路線上的下游反應并形成多種雜質。Bis-Boc-胍丁胺,可以很容易地制備并應用于胍丁胺肽的合成。在這個過程種沒有引發異構雜質和相關二聚體雜質。胍基官能團上的雙 Boc 保護基團可以很容易地被 TFA 定量去除。使用Bis- Boc-胍丁胺原料合成FE 201836可以顯著提高產品純度和產率。這項研究還強調了中間產品異構雜質的研究方法,這種理念和策略對于確保API 產品質量的完整性至關重要。
文獻詳情:
Yi Yang* and Lena Hansen. Regioisomer Formation with Agmatine Guanidino Group, Its Implications for Agmatine Peptide Cyclization, and Application of Bis-Boc-Agmatine. Organic Process Research & Development. 2022. https://doi.org/10.1021/acs.oprd.2c00098