- 首頁
- 資訊
PNAS:山大孫金鵬、于曉團隊揭示GPBAR偏好性配體差異調控非小細胞肺癌細胞惡性表型的新機制
來源:山東大學齊魯醫學院 2022-07-26
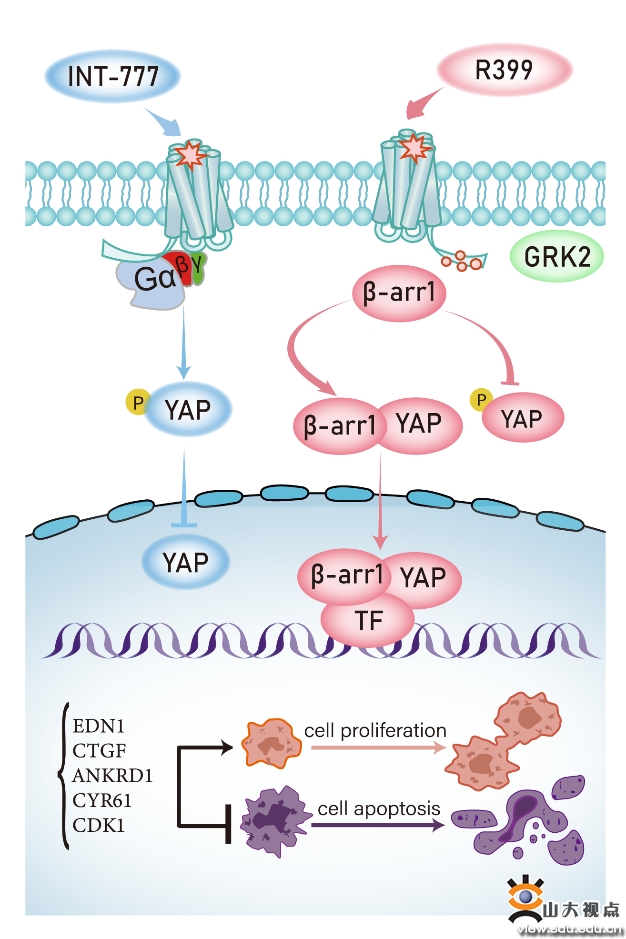
導讀:7月16日,孫金鵬教授團隊、于曉教授團隊聯合山東大學第二附屬醫院杜魯濤教授、浙江大學張巖教授共同在PNAS雜志上(中科院JCR期刊一區,5年IF=12.291)在線發表了最新的研究成果“Structural basis and molecular mechanism of biased GPBAR signaling in regulating NSCLC cell growth via YAP activity”的研究論文。山東大學基礎醫學院楊帆教授,博士研究生馬麗娟、吳襄和浙江大學毛春友研究員為共同第一作者,孫金鵬教授、于曉教授、張鵬舉教授、張巖教授和杜魯濤教授為共同通訊作者,山東大學為第一作者單位和通訊作者單位。
作為“肝臟-膽汁酸-微生物-器官”軸的核心組分,G蛋白偶聯膽汁酸受體 (G protein-coupled bile acid receptor, GPBAR) 不僅參與調控機體膽汁酸代謝、炎癥反應、糖脂代謝等多種生命活動,而且與多種腫瘤的發生發展密切相關。但是目前GPBAR在非小細胞肺癌 (Non-small cell lung cancer, NSCLC) 中的作用及機制尚不清楚,尤其是不同配體驅動的GPBAR活化對NSCLC的調控作用國內外報道甚少。前期,孫金鵬教授和于曉教授研究團隊系統地解析了GPBAR的配體識別激活機制,揭示了膽汁酸受體偏好性信號轉導途徑的結構基礎,這些研究對理解膽汁酸與GPBAR的生理功能,以及靶向該受體的新藥研發起到了推動作用 (Nature 2020)。延續以上工作,在本研究中,研究團隊進一步揭示了INT-777和R399驅動的GPBAR偏好性信號轉導 (Gs vs. β-arrestin) 差異性調控YAP活性,從而影響NSCLC惡性表型的分子機制,解析了R399激活GPBAR偏好β-arrestin 1的結構基礎,為開發高效低毒的GPBAR靶向藥物提供重要線索和思路。圖1 INT-777和R399通過偏好性信號轉導雙向調控YAP通路和NSCLC細胞惡性表型孫金鵬教授團隊主要從事膜受體G蛋白偶聯受體 (GPCR) 的相關研究,聚焦于GPCR功能多樣的細胞機制以及針對GPCR的藥物發展,發展了Arrestin所介導的GPCR偏向性信號轉導的藥理學理論,創新性地提出了GPCR磷酸化編碼的“笛子模型”(Nature Commun 2015,2021, PNAS 2021),進一步揭示了磷酸化編碼別構調控SH3蛋白的多聚脯氨酸碼頭分選及別構建調控機制 (Nature Chem Biol 2018; Nat. Commun 2021),以及證明了配體依賴的受體7次跨膜核心對Arrestin功能的指導 (Nature Commun 2020,Faculty 1000專題評論);闡明了多個GPCRs對胰島功能,糖代謝和體外組織再造的調控作用,為進一步靶向GPCR偏向性信號途徑的藥物設計提供了指導 (Biol Psychiatry 2017,Diabetologia 2014,Br J Pharmacol 2015);闡明了快樂激素多巴胺受體以及肝腸軸樞紐膽汁酸受體識別其內源性配體,以及偏好性信號轉導的結構基礎以及癢覺感知的分子機制 (Nature 2020,2021a,2021b,Nature 2022b, Cell 2021) 等。于曉教授團隊長期聚焦于胰島穩態的作用及調節機制,闡明了跨膜信號轉導對胰島β細胞分泌功能及胰島穩態的精確調控機制,包括GPCR下游偏好性信號途徑和第二信使的信號時序等(Cell Metabolism 2022, Nature 2020,EMBO Reports 2021,eLife 2018,Nature Commun 2021);揭示了胰島中δ-β細胞環路在胰島穩態維持中的重要作用(J Clin Invest. 2017,Cell Discov. 2020,Cell Death Dis. 2018);開發了選擇性調節G蛋白偶聯受體和PEST磷酸酶亞家族活力來對胰島穩態失衡發展新的干預策略(Cell 2021,PNAS 2021,Cell Research 2014,Cell Reports 2016)等。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn