



正文
由于全球老年人癡呆癥患病率不斷上升以及對社會的影響越來越大,阿爾茨海默癥(AD)已經(jīng)引起了越來越多的關(guān)注,其中對AD發(fā)病機(jī)制和診斷方法的研究一直處于醫(yī)學(xué)和腦科學(xué)的前沿。目前,AD的診斷主要基于使用多種常規(guī)神經(jīng)心理學(xué)測試和醫(yī)療器械(CT、PET、MRI)進(jìn)行的臨床評估。此外,臨床上還包括對血漿或腦脊液中的生物標(biāo)志物的檢查,以估計(jì)疾病的發(fā)展進(jìn)程。但是,這些方法都很難滿足AD診斷所需的敏感性、特異性和非侵入性。
熒光成像因其高靈敏度、微創(chuàng)和實(shí)時(shí)響應(yīng)的特性而在生物分析領(lǐng)域引起了廣泛的關(guān)注。在此背景下,針對AD生物標(biāo)志物設(shè)計(jì)的熒光探針將為AD診斷和病理分析提供強(qiáng)有力的工具。當(dāng)前,對AD早期診斷的研究大多集中在Aβ肽或tau蛋白上,而很少能夠在活體水平上揭示氧化應(yīng)激與AD之間的復(fù)雜關(guān)系。作為超氧自由基和一氧化氮的組合產(chǎn)物,過氧亞硝酸鹽(ONOO-)是一種典型的氧化應(yīng)激反應(yīng)物種,已有證據(jù)表明,ONOO-通過引發(fā)神經(jīng)毒性和神經(jīng)炎癥在AD的發(fā)病機(jī)制中起重要作用。但是,迄今為止,還沒有ONOO-熒光探針可用于AD的活體腦成像。造成這種困境的一個(gè)主要原因可能是當(dāng)前探針的血腦屏障(BBB)穿越能力不足。此外,由于大腦中產(chǎn)生的ROS種類繁多,也要求探針對ONOO-具有優(yōu)異的選擇性。鑒于此,劉志洪教授團(tuán)隊(duì)通過結(jié)構(gòu)調(diào)節(jié)策略合理設(shè)計(jì)了一種新穎的ONOO-激活的近紅外發(fā)射熒光探針Rd-DPA3,旨在研究過氧亞硝酸鹽與AD之間的復(fù)雜關(guān)系,實(shí)現(xiàn)AD進(jìn)展過程的體內(nèi)診斷和評估(圖1)。
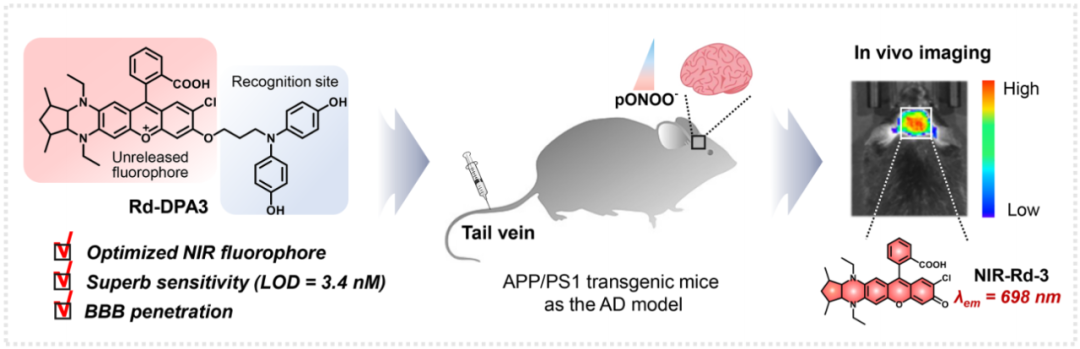
圖 1. 探針Rd-DPA3的結(jié)構(gòu)及作用示意圖(圖片來源:Angew. Chem. Int. Ed.)
在探針分子的構(gòu)建中,首先基于前期工作中發(fā)展的二氨基取代的Rhodol染料(NIR-Rd-1和NIR-Rd-2),作者利用剛性五元環(huán)鎖定類哌嗪類二氨基結(jié)構(gòu)并接枝氯原子開發(fā)了一種新型Rhodol染料NIR-Rd-3,其具有更長的近紅外發(fā)射波長。此外,考慮到ONOO-的強(qiáng)氧化性和親核性,4, 4'-氮雜二基二苯酚被創(chuàng)新性地開發(fā)為對ONOO-具有高選擇性的識別基團(tuán),進(jìn)而連接到NIR-Rd-3熒光團(tuán)上獲得了ONOO-可激活的熒光探針Rd-DPA3。接著,作者首先通過滴定實(shí)驗(yàn)驗(yàn)證了探針Rd-DPA3對ONOO-的響應(yīng)性能。在沒有ONOO-存在的條件下,Rd-DPA3的最大吸收峰位于602 nm,同時(shí)在702 nm處顯示微弱的熒光。而在加入ONOO-反應(yīng)后,Rd-DPA3在700 nm處的熒光顯著增強(qiáng),同時(shí)吸收藍(lán)移至572 nm。重要的是,Rd-DPA3對ONOO-表現(xiàn)出優(yōu)異的靈敏度和選擇性,檢測限低至3.4 nM,其他干擾物質(zhì)(金屬離子,pH,ROS, 蛋白質(zhì))均不會引起探針在700 nm處的熒光增強(qiáng)。在不同pH條件下,探針均具有良好的穩(wěn)定性,并且能夠維持對ONOO-出色的響應(yīng)能力(圖2)。
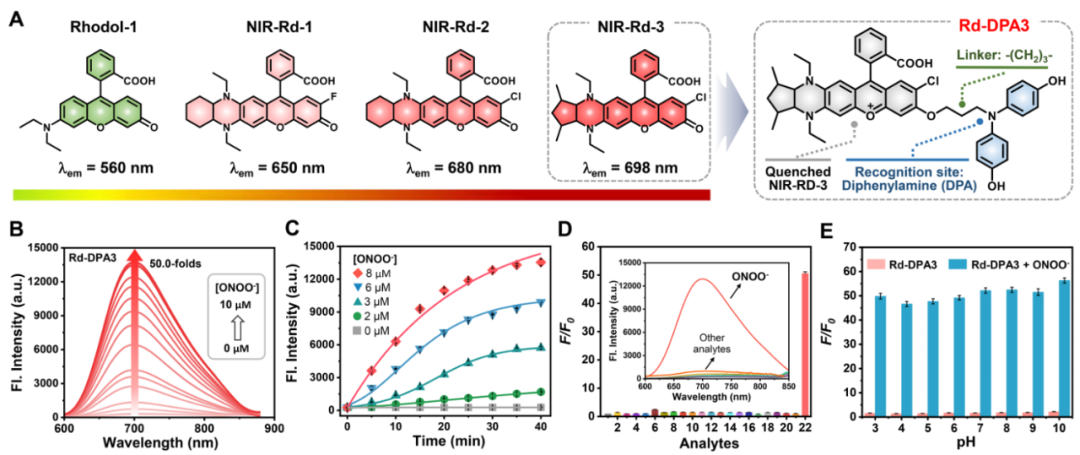
圖 2. Rd-DPA3對ONOO-的光譜響應(yīng)(圖片來源:Angew. Chem. Int. Ed.)
然后,作者進(jìn)一步通過高分辨質(zhì)譜研究了Rd-DPA3與ONOO-的反應(yīng)機(jī)制。實(shí)驗(yàn)結(jié)果證明,在單分子Rd-DPA3中,ONOO-首先進(jìn)攻雙氨基酚部分形成烷基胺修飾的熒光團(tuán),隨后烷基胺基團(tuán)繼續(xù)與ONOO-發(fā)生1, 3-消除反應(yīng)生成NIR-Rd-3。對于Rd-DPA3,4, 4'-氮雜二基二酚基團(tuán)不僅是ONOO-的反應(yīng)位點(diǎn),而且還可以通過PeT效應(yīng)有效地淬滅NIR-Rd-3的熒光。此外,密度泛函理論(DFT)計(jì)算也與作者提出的檢測機(jī)制一致(圖3)。
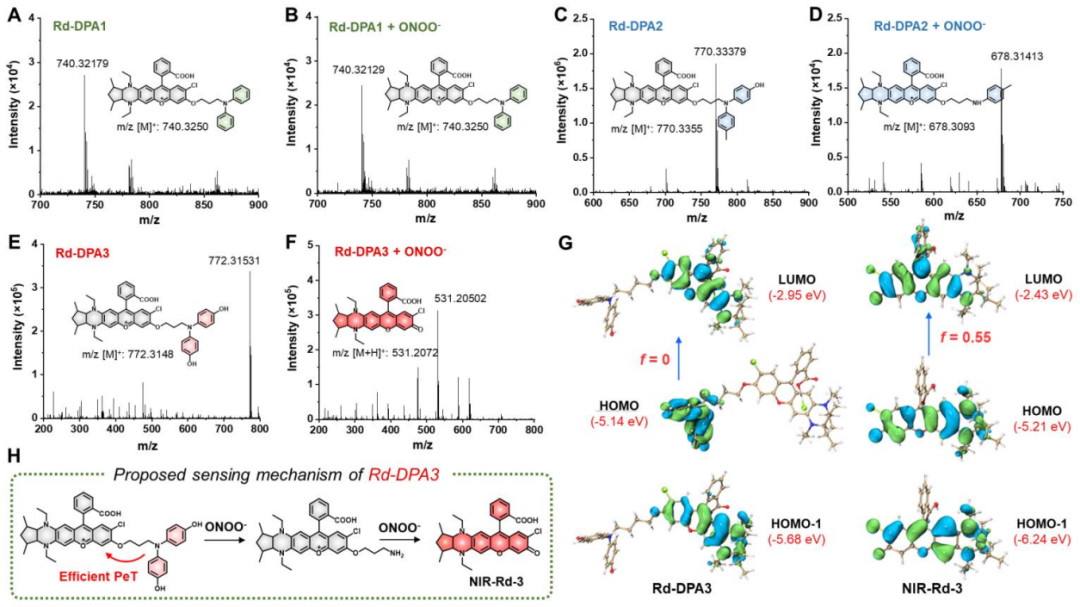
圖 3. Rd-DPA3與ONOO-反應(yīng)機(jī)制的探究(圖片來源:Angew. Chem. Int. Ed.)
接著,作者在活細(xì)胞中研究了探針Rd-DPA3的成像能力。首先,實(shí)驗(yàn)結(jié)果表明該探針具有良好的生物相容性和線粒體定位性能,并且可以選擇性地反映活細(xì)胞中外源性和內(nèi)源性O(shè)NOO-濃度的變化。由于金屬離子(Fe2+, Cu2+等)穩(wěn)態(tài)的紊亂與AD的進(jìn)展密切相關(guān),作者進(jìn)一步通過在PC12細(xì)胞中添加Fe2+,模擬AD過程中由于金屬離子穩(wěn)態(tài)失衡所導(dǎo)致氧化應(yīng)激的細(xì)胞模型。。結(jié)果顯示,隨著Fe2+濃度的增加,細(xì)胞內(nèi)熒光逐漸增強(qiáng),表明在Fe2+誘導(dǎo)的氧化應(yīng)激過程中產(chǎn)生了ONOO-。值得注意的是,加入尿素(UA,一種高效的ONOO-清除劑)后,PC12細(xì)胞中的紅色熒光信號急劇降低,這表明UA有效降低了細(xì)胞內(nèi)ONOO-水平。同時(shí),這些實(shí)驗(yàn)結(jié)果證明了Rd-DPA3能夠監(jiān)測AD細(xì)胞模型中ONOO-的波動(圖4)。
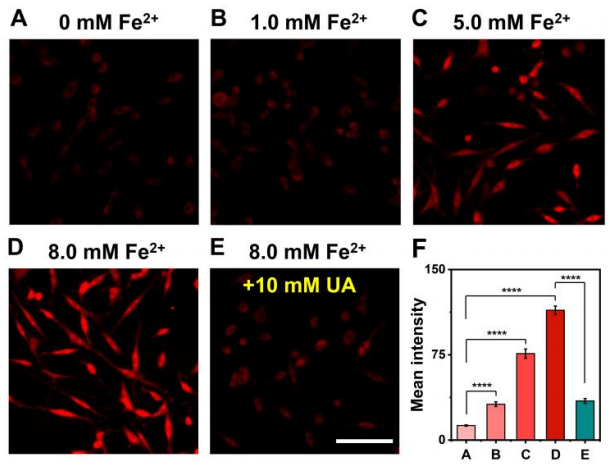
圖 4. AD細(xì)胞模型中ONOO-的監(jiān)測(圖片來源:Angew. Chem. Int. Ed.)
隨后,作者進(jìn)行了活體成像的研究。首先,作者評估了探針的血腦屏障(BBB)穿透能力。經(jīng)計(jì)算,55.54%的Rd-DPA3成功穿透了人工模擬BBB,顯示出探針在體內(nèi)腦成像的巨大潛力。然后,探針經(jīng)過尾靜脈注射到各個(gè)實(shí)驗(yàn)組的小鼠模型中。在AD模型小鼠中,熒光強(qiáng)度在0-6小時(shí)內(nèi)顯著升高,并在6-11小時(shí)內(nèi)保持穩(wěn)定;相比之下,在對照組中只能觀察到輕微的熒光增強(qiáng),從而證明ONOO-的過度表達(dá)是AD的標(biāo)志之一。此外,為了確認(rèn)注射后探針集中在小鼠大腦中,解剖小鼠大腦進(jìn)行了離體NIR成像。體外成像結(jié)果表明,AD模型腦部的熒光強(qiáng)度遠(yuǎn)高于對照組,進(jìn)一步證實(shí)了探針在腦中的BBB穿越能力和ONOO-檢測性能。同時(shí),在氯碘羥喹或姜黃素(兩種著名的治療阿爾茨海默病的化學(xué)藥物)處理的AD小鼠中,腦部的實(shí)時(shí)熒光成像表明ONOO-表達(dá)在0-12小時(shí)下降到低水平。這樣的結(jié)果表明Rd-DPA3可以通過測量大腦中的ONOO-水平來幫助藥理學(xué)家研究藥物在治療阿爾茨海默病中的作用機(jī)制(圖5)。除此之外,作者進(jìn)一步對不同年齡AD大腦中ONOO-的積累進(jìn)行了研究。3個(gè)月,8個(gè)月和12個(gè)月大的AD模型小鼠分別被注射了Rd-DPA3,并記錄了小鼠的實(shí)時(shí)成像。結(jié)果顯示,來自大腦的熒光信號隨著年齡的增長而顯著增加,為AD大腦中ONOO-的年齡依賴性積累提供了體內(nèi)證據(jù)(圖6)。
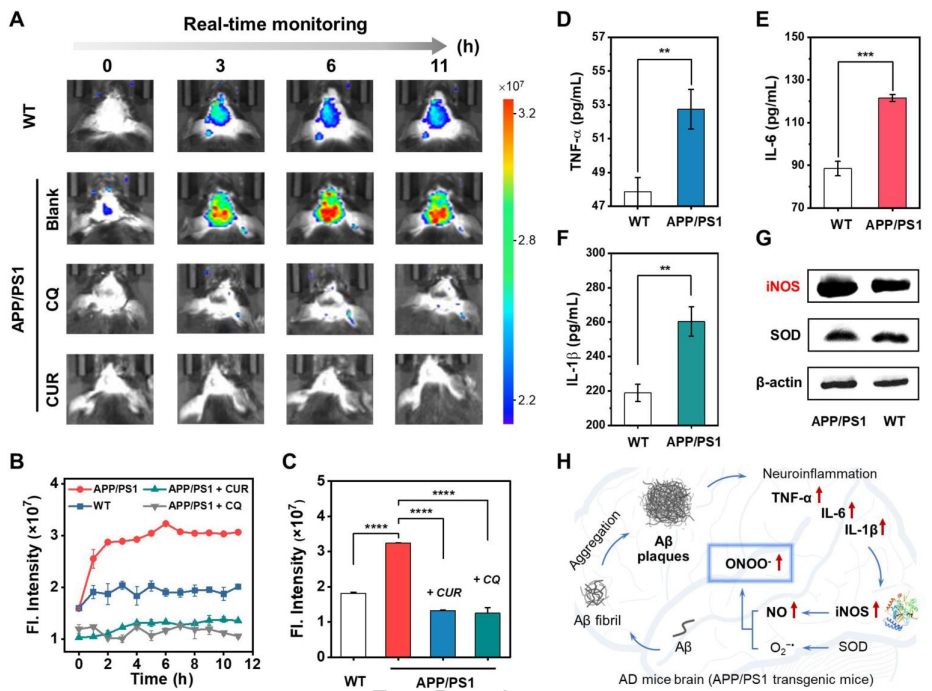
圖 5. AD小鼠中ONOO-的體內(nèi)成像(圖片來源:Angew. Chem. Int. Ed.)

圖 6. ONOO-在年齡相關(guān)AD小鼠中的體內(nèi)成像(圖片來源:Angew. Chem. Int. Ed.)
總結(jié)
湖北大學(xué)劉志洪教授團(tuán)隊(duì)通過結(jié)構(gòu)調(diào)節(jié)優(yōu)化策略合理設(shè)計(jì)了一種過氧亞硝酸鹽(ONOO-)可激活的熒光探針Rd-DPA3,其表現(xiàn)出優(yōu)異的靈敏度和選擇性。在細(xì)胞水平上,Rd-DPA3能夠靶向線粒體并監(jiān)測活細(xì)胞中ONOO-濃度在氧化應(yīng)激過程的變化。此外,由于Rd-DPA3優(yōu)異的BBB穿透能力,首次在AD小鼠模型的大腦中成功實(shí)現(xiàn)了ONOO-濃度波動的實(shí)時(shí)體內(nèi)成像,并證明了阿爾茨海默癥(AD)小鼠大腦中ONOO-含量會隨年齡的增長呈現(xiàn)依賴性積累。該研究結(jié)果有力地支撐了ONOO-可以作為AD的生物標(biāo)志物,進(jìn)一步促進(jìn)了我們對AD診斷和治療的認(rèn)識,為新型ONOO-探針設(shè)計(jì)和AD診斷提供了新的方向。
文獻(xiàn)詳情:

聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn