

正文
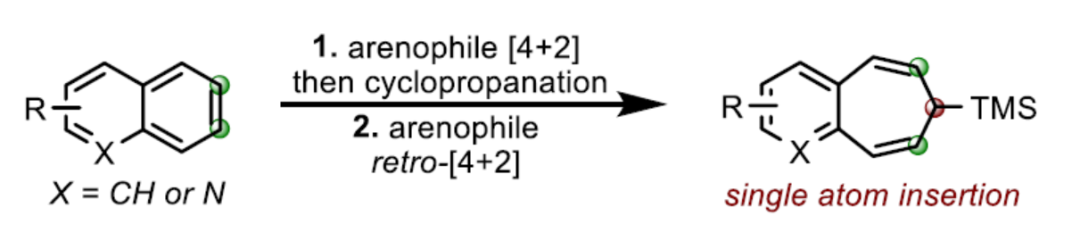
苯并環庚烯是許多天然產物和生物活性化合物中常見的骨架。近日,美國伊利諾伊大學與意大利帕維亞大學David Sarlah課題組報道了一種以非活化多環芳烴為底物,經兩步串聯反應(涉及親芳烴體(arenophile)的去芳構化[4+2]-環加成以及鈀催化的環丙烷化,隨后通過環翻轉(cycloreversion)引發擴環反應),合成了一系列苯并環庚烯衍生物。同時,該策略作為Buchner反應(僅限于單環芳烴)的一種可行性替代方法。
(圖片來源:Angew. Chem. Int. Ed.)
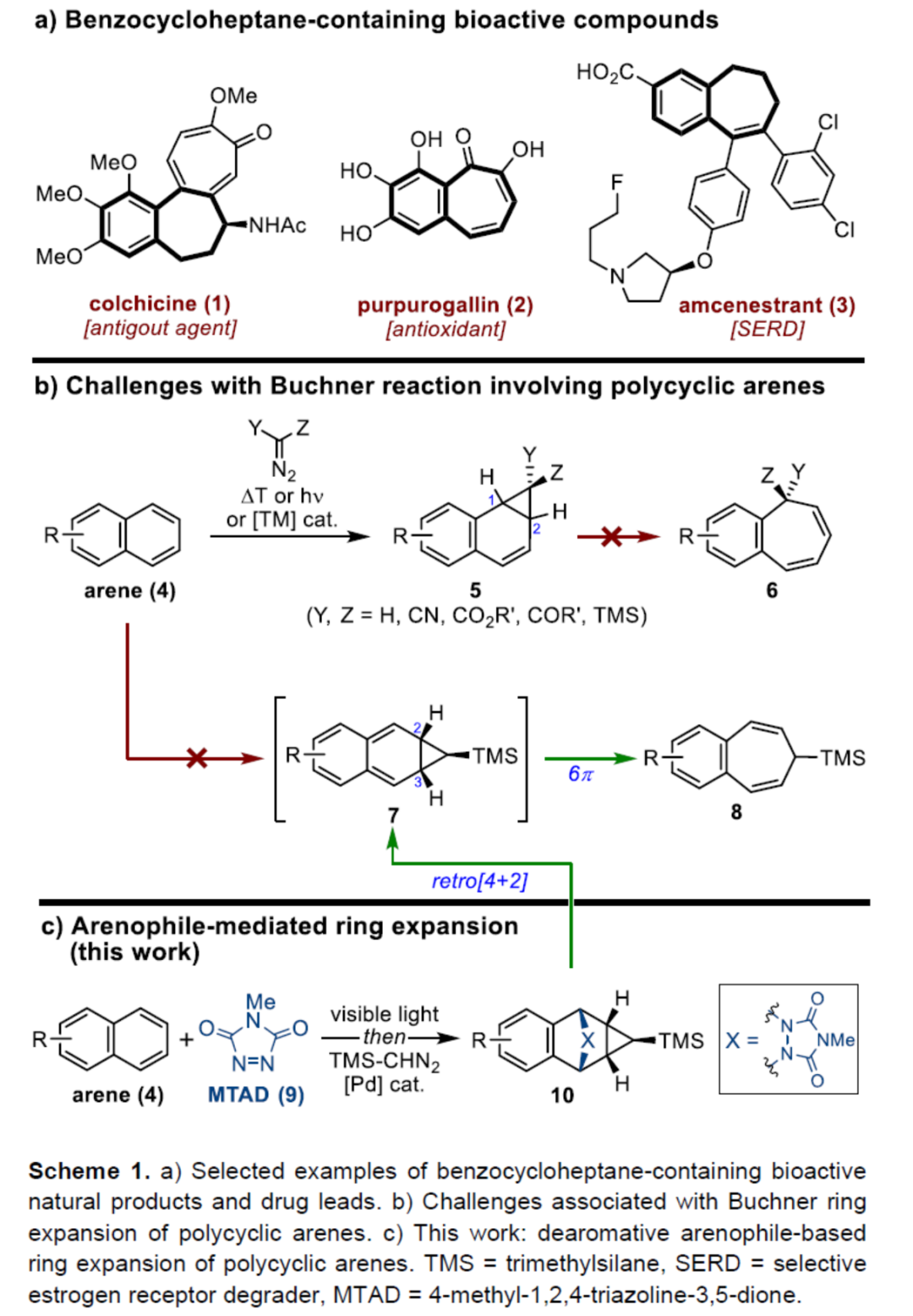
七元碳環是分子科學(如藥物和材料化學)中具有價值的中間體。特別是,含有苯并稠合不飽和七元環的化合物通常是具有生物活性的天然產物和重要的先導藥物(Scheme 1a)。例如,秋水仙堿(colchicine,1)是一種眾所周知的天然產物,用于治療痛風和家族性地中海熱。紅倍酚(purpurogallin,2)是具有多種生物活性的苯并托酚酮(benzotropolone)類抗氧化劑的中心單元。此外,這種骨架還存在于藥物化學中,例如amcenestrant(3),一種研究性口服選擇性雌激素受體降解劑(SERD),目前正在對激素受體陽性晚期乳腺癌患者進行研究。鑒于它們的重要性,化學家們已開發了幾種合成苯并環庚烯的策略,如從環化反應到四氫萘酮和二氫萘衍生物的擴環反應。然而,此類方法常需多步操作和特定的底物,從而僅限有特定的幾個例子。
另一方面,多環芳烴的去芳構化擴環是直接合成此類化合物的有效途徑,但此類策略仍未得到相關的研究。Buchner擴環反應是合成環庚三烯衍生物的有效方法,涉及卡賓加成/去芳構化環丙烷化,然后是蒈二烯(norcaradienes)的6π電環化開環的過程。然而,該策略僅對苯衍生物有效。由于多環芳烴固有的反應性,環丙烷化反應經常發生在1,2-位(4→5,Scheme 1b)。由于價鍵互變異構過程中的幾何限制和去芳香化的過程,相應的1,2-苯并蒈二烯(1,2-benzonorcaradienes,5)不易進一步擴環成苯并稠合的環庚三烯6。作者認為,環丙烷化可轉移到C2-C3-位(即4→7),該中間體可迅速經電環化擴環(7→8),由同時進行的重新芳構化(rearomatization)驅動。在此,David Sarlah課題組報道了一種可見光介導的多環芳烴與親芳烴體(arenophile)4-甲基-1,2,4-三唑啉-3,5-二酮(MTAD,9)的環加成反應,然后通過原位Pd-催化TMS-重氮甲烷的環丙烷化反應,從而合成多環化合物10(Scheme 1c)。
(圖片來源:Angew. Chem. Int. Ed.)
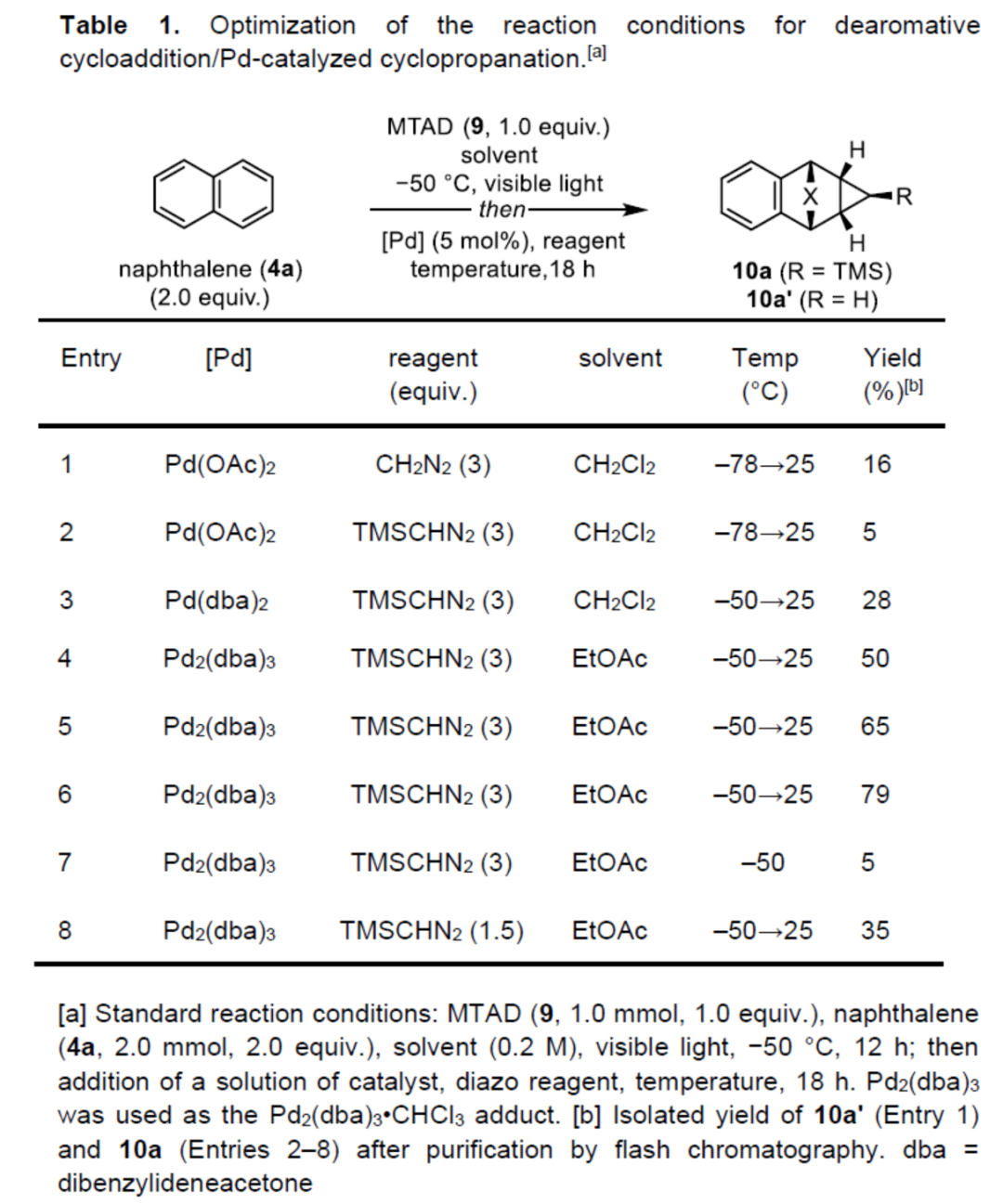
首先,作者以萘4a與MTAD(9)作為模型底物,進行了相關去芳構化反應條件的篩選(Table 1)。首先,在可見光輻射下于乙酸乙酯溶劑中-50 oC下反應,隨后以Pd2(dba)3作為催化劑,TMSCHN2作為重氮試劑,并將反應溫度升高至25 oC下繼續反應18 h,可以79%的收率得到環丙烷化產物10a。
(圖片來源:Angew. Chem. Int. Ed.)
在獲得了上述最佳環丙烷化反應條件后,作者對合成苯并環庚三烯的條件進行了優化。當多環產物10在含有KOH的i-PrOH溶劑中40 oC下反應2 h,然后在氧氣氣氛下進行銅催化的氧化,可使環翻轉反應順利進行(Table 2)。在此過程中,脲唑經部分水解/脫羧,生成的環狀氨基脲中間體可進一步氧化,從而實現氮氣的釋放和擴環的過程。通過該策略,萘衍生的環丙烷化中間體以75%的收率生成產物8a。同時,1-和2-取代的萘衍生物,均可順利進行反應,獲得相應的官能團化的3,4-苯并環庚三烯衍生物。其中,含有腈基、鹵素、三氟甲基、硅基等基團的底物,均與體系兼容。對于含有羰基和甲酰基的底物,需在環加成步驟中將其保護為相應的縮醛,并可在酸性后處理過程中進行脫保護,如8k-8n。在所有情況下,Pd-催化的環丙烷化可獲得單一的非對映異構體10,其很容易自發環化為擴環產物8。同時,4a的克級規模實驗,可獲得與小試相似收率的產物8a。此外,多環雜芳烴(如喹啉及其衍生物),也是合適的底物,獲得相應的產物11a-11e。

(圖片來源:Angew. Chem. Int. Ed.)
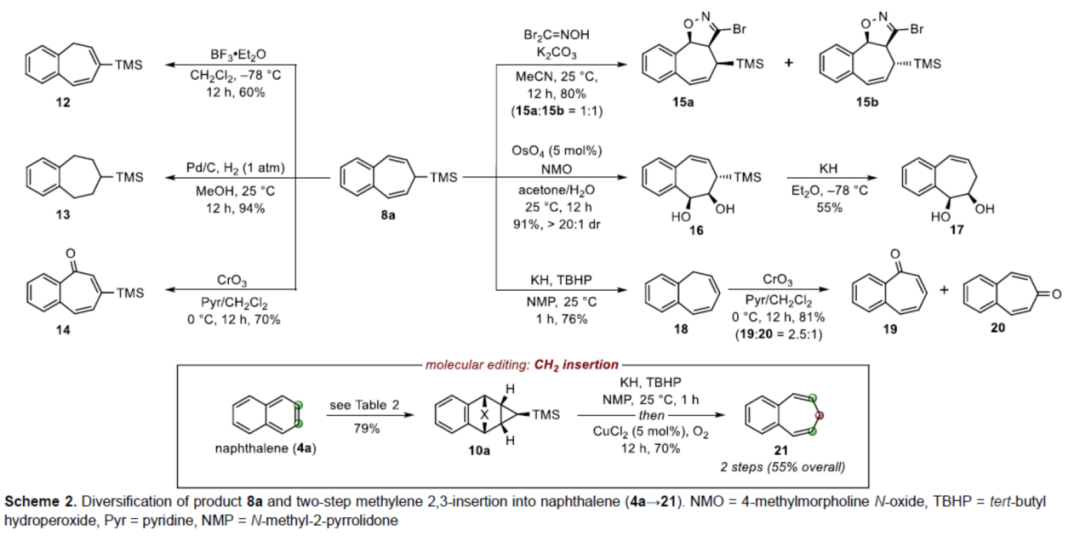
緊接著,作者對反應的實用性進行了研究(Scheme 2)。首先,8a使用BF3?OEt2催化可實現烯烴異構化(12),而在標準的氫化條件下可獲得苯并環庚烷化合物(13),使用CrO3/吡啶氧化可獲得2,3-苯并環庚三烯酮衍生物(14)。其次,8a與氧化腈[3+2]偶極環加成反應,可生成異噁唑啉的非對映異構體混合物15a和15b。8a經非對映選擇性Upjohn二羥基化反應,可獲得二醇化合物16,作為單一的非對映異構體,可經KH處理后進行去硅基化(16→17)。同時,8a中的TMS基團也可直接去除,且發生烯烴異構化,獲得1,2-苯并環庚間三烯(1,2-benzotropilidene)18。18經CrO3/吡啶氧化,可獲得2,3-苯并環庚三烯酮(19)和4,5-苯并環庚三烯酮(20)。最后,為了確保非取代3,4-苯并環庚間三烯(21)的合成,去硅基化與中間體10a上的環翻轉步驟需同時進行(Scheme 2, inset),構成第一個直接和實用的CH2插入多環芳烴2,3-位的策略。
(圖片來源:Angew. Chem. Int. Ed.)
總結
David Sarlah課題組報道了一種簡單且非活化的多環芳烴和雜芳烴的去芳構化擴環策略,涉及親核芳烴的去芳構化[4+2]-環加成以及鈀催化的環丙烷化,隨后通過環翻轉引發擴環反應,合成了一系列(氮雜)苯并環庚烯衍生物。同時,該策略作為Buchner反應(僅限于單環芳烴)的一種可行性替代方法。
文獻詳情:
Paolo Piacentini, Tanner W. Bingham, David Sarlah*. Dearomative Ring Expansion of Polycyclic Arenes. Angew. Chem. Int. Ed. 2022, https://doi.org/10.1002/anie.202208014

聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn