



(圖片來(lái)源:J. Am. Chem. Soc.)
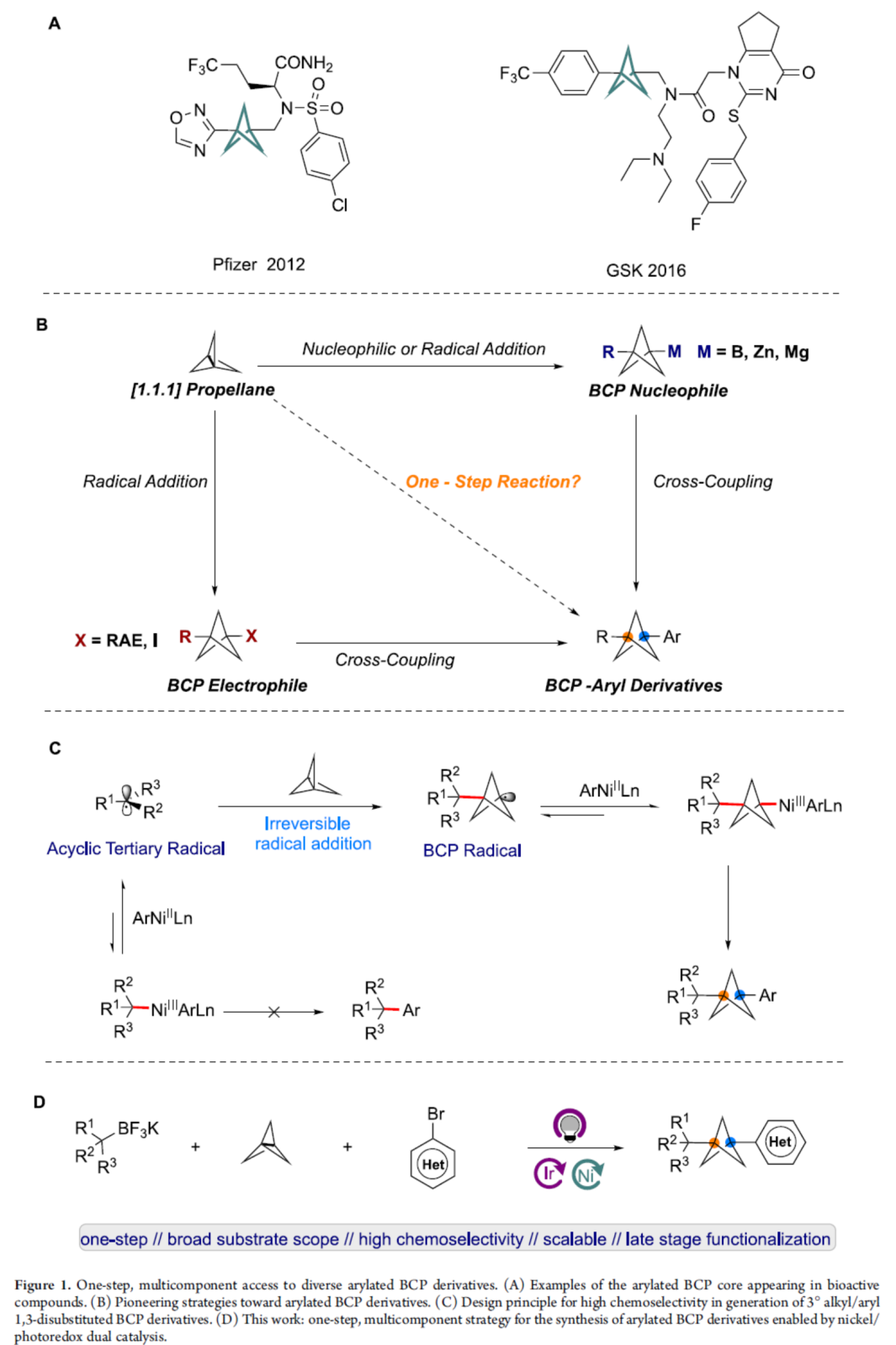
在現(xiàn)代藥物發(fā)現(xiàn)中,生物等排體取代是改善藥物和候選藥物各種物理化學(xué)性質(zhì)的重要途徑。其中,雙環(huán)[1.1.1]戊烷(BCP)骨架是一種對(duì)位二取代芳基生物等排體,也是叔丁基或炔烴生物等排體,具有有利的藥代動(dòng)力學(xué)特性,如被動(dòng)滲透性、水溶性、代謝穩(wěn)定性等。芳基取代的BCP衍生物是藥學(xué)上重要的骨架(Figure 1A),但其合成仍具有難度。其中,通過(guò)[1.1.1]螺槳烷的多步反應(yīng)是制備芳基取代BCP衍生物的常用方法(Figure 1B)。例如,化學(xué)家們報(bào)道了芳基鹵化物和BCP親核試劑(衍生自[1.1.1]螺槳烷)之間的Kumada-、Negishi-和Suzuki-型偶聯(lián)反應(yīng),但需合成和使用反應(yīng)性有機(jī)金屬試劑,導(dǎo)致官能團(tuán)兼容性差。同時(shí),Baran和Anderson課題組還報(bào)道了芳基金屬試劑與BCP氧化還原活性酯或碘化物的交叉偶聯(lián)反應(yīng),但對(duì)于BCP親電試劑合成至少需從[1.1.1]螺槳烷經(jīng)一步反應(yīng)。并且,大多數(shù)反應(yīng)均集中于α-一級(jí)或-二級(jí)芳基-BCPs的制備上,且需多步操作。然而,僅有少數(shù)合成α-季碳BCP-芳基衍生物的方法,且僅限于特定的子結(jié)構(gòu)。作者認(rèn)為,成功的MCR(Multicomponent reactions,多組分反應(yīng))方法的一個(gè)關(guān)鍵因素是對(duì)[1.1.1]螺槳烷的選擇性烷基加成,而不是直接加成到鎳中心,這利用了無(wú)環(huán)三級(jí)烷基自由基和BCP自由基在鎳催化劑捕獲方面明顯不同的反應(yīng)性。無(wú)環(huán)三級(jí)自由基更容易從Ni(III)中心解離形成Ni(II)和無(wú)環(huán)烷基三級(jí)自由基,而對(duì)于環(huán)狀三級(jí)烷基自由基,能量學(xué)有利于Ni(III)配合物的形成。基于這一假設(shè),光生成的三級(jí)烷基自由基經(jīng)不可逆的自由基加成至[1.1.1]螺槳烷中而非鎳中心,生成BCP自由基。隨后,用鎳催化劑進(jìn)行自由基捕獲,生成形式的Ni(III)配合物,該配合物經(jīng)還原消除生成芳基化BCP產(chǎn)物(Figure 1C)。近日,美國(guó)賓夕法尼亞大學(xué)Gary A. Molander課題組報(bào)道了一種鎳/光氧化還原雙重催化[1.1.1]螺槳烷、芳基鹵與烷基三氟硼酸鉀鹽的三組分雙碳官能團(tuán)化反應(yīng),合成了一系列芳基化雙環(huán)[1.1.1]戊烷衍生物(BCPs)(Figure 1D)。
(圖片來(lái)源:J. Am. Chem. Soc.)
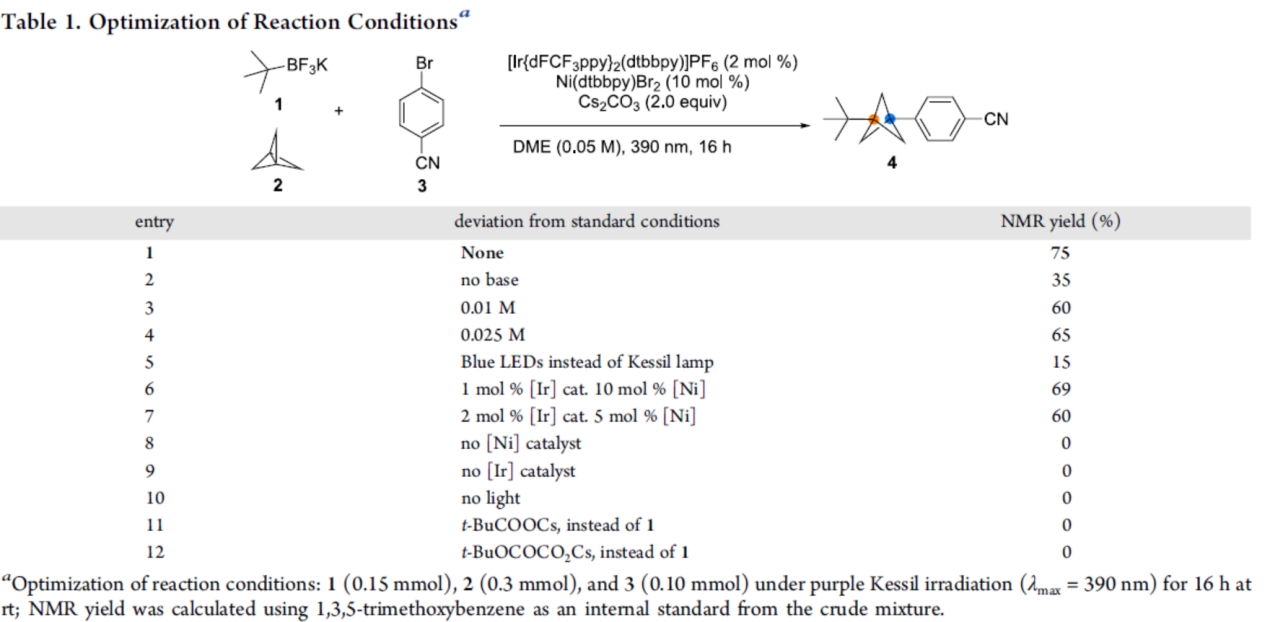
首先,作者以t-BuBF3K(1)、螺槳烷2與4-溴芐腈3作為模型底物,進(jìn)行了相關(guān)三組分偶聯(lián)反應(yīng)條件的篩選(Table 1)。當(dāng)以[Ir(dFCF3ppy)2dtbbpy]PF6作為光催化劑,Ni(dtbbpy)Br2作為金屬催化劑,Cs2CO3作為堿,DME作為溶劑,可在390 nm LED輻射下25 oC反應(yīng)16 h,可以75%的收率得到芳基化雙環(huán)[1.1.1]戊烷產(chǎn)物4。
(圖片來(lái)源:J. Am. Chem. Soc.)
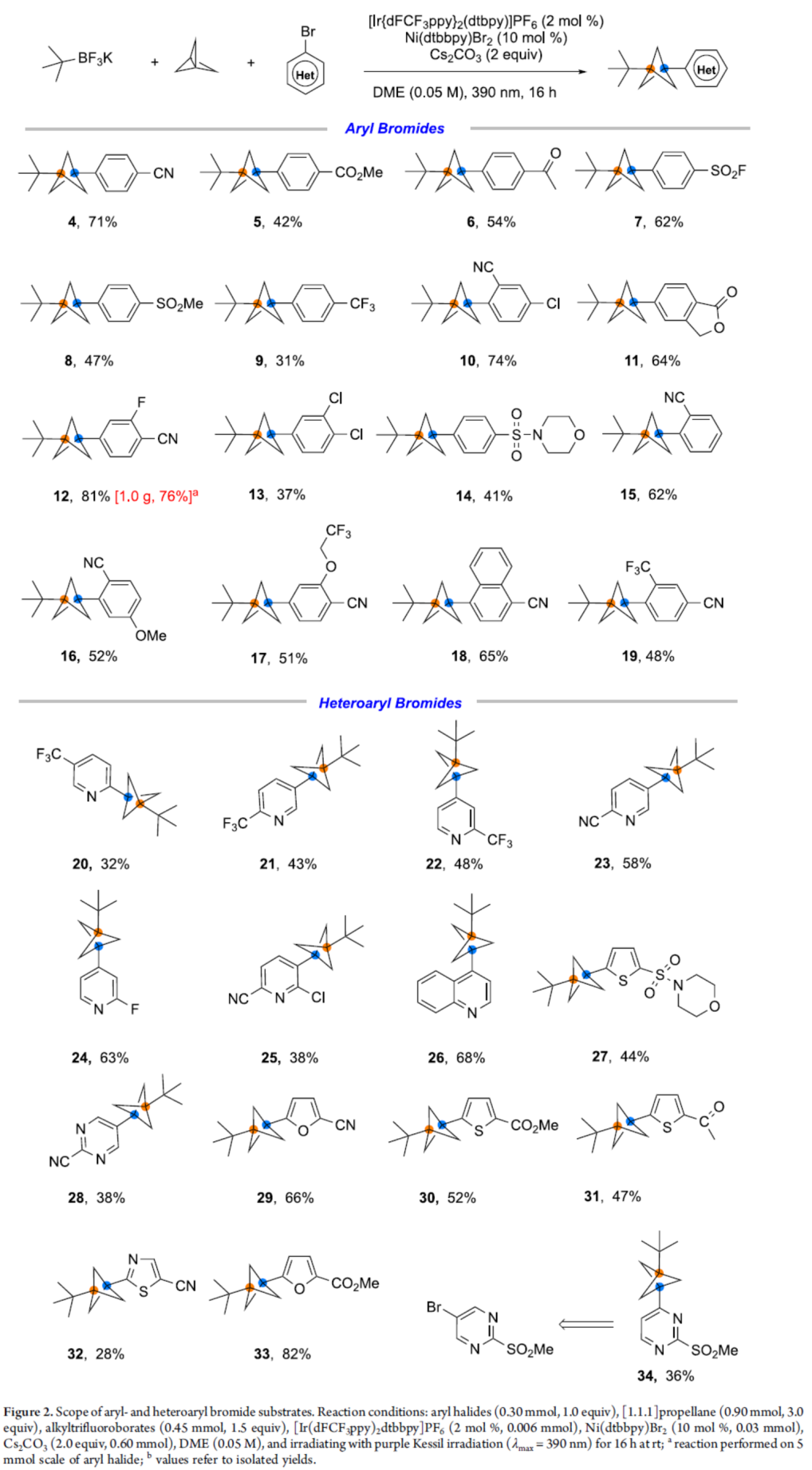
在獲得上述最佳反應(yīng)條件后,作者對(duì)(雜)芳基溴底物范圍進(jìn)行了擴(kuò)展(Figure 2)。首先,一系列具有不同電性取代的芳基溴,均可順利反應(yīng),獲得相應(yīng)的產(chǎn)物4-19,收率為31-81%。值得注意的是,一系列活性基團(tuán),如腈基、酯基、羰基等,均與體系兼容。克級(jí)規(guī)模實(shí)驗(yàn),可以76%的收率獲得產(chǎn)物12。其次,雜芳基溴,如吡啶基、嘧啶基、呋喃基、喹啉基、噻唑基、噻吩基等,均與體系兼容,獲得相應(yīng)的產(chǎn)物20-33,收率為28-82%。此外,當(dāng)以5-溴-2-(甲基磺酰基)嘧啶為底物時(shí),可獲得36%收率的非預(yù)期產(chǎn)物34,可能是由于競(jìng)爭(zhēng)性 Minisci-型反應(yīng)導(dǎo)致。
(圖片來(lái)源:J. Am. Chem. Soc.)
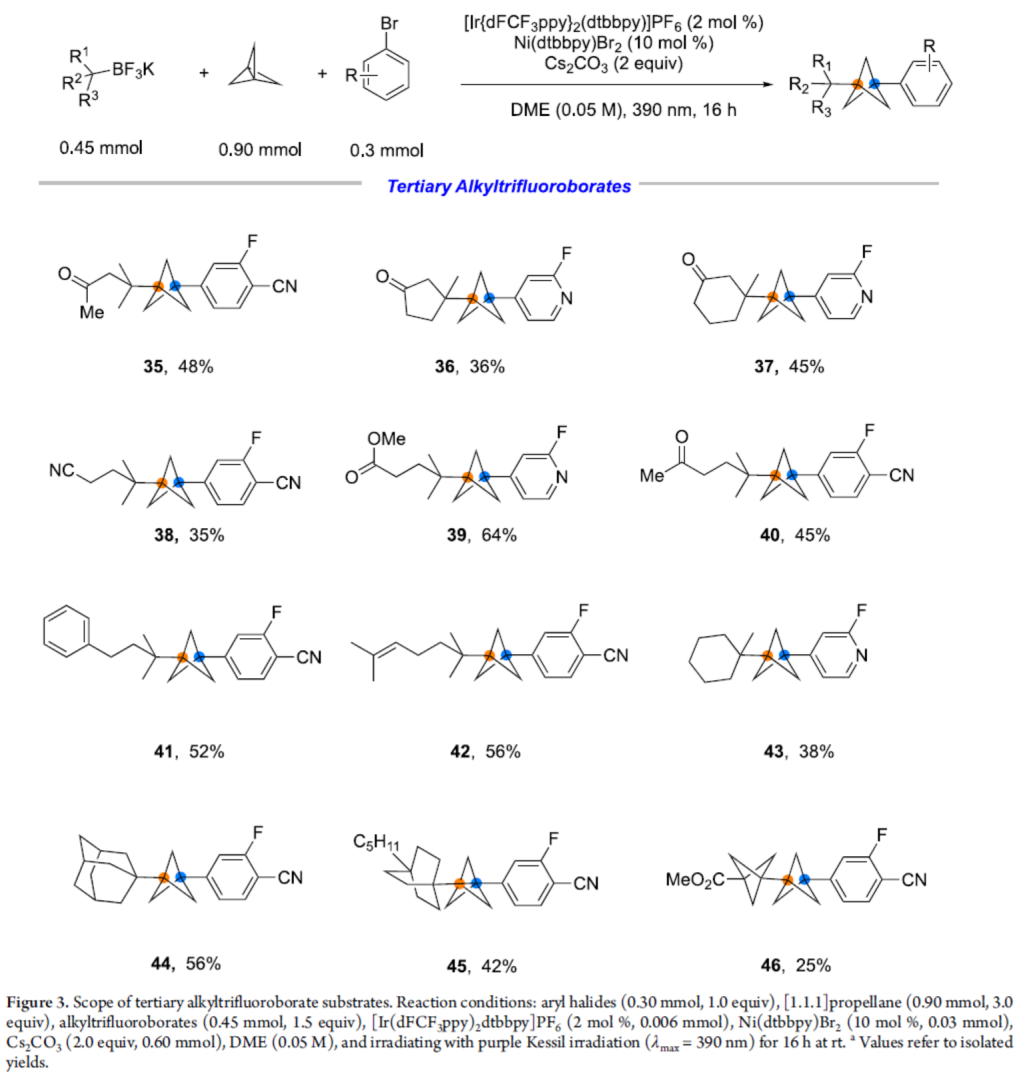
緊接著,作者對(duì)三級(jí)烷基三氟硼酸鹽的底物范圍進(jìn)行了擴(kuò)展(Figure 3)。研究表明,一系列不同取代的烷基三氟硼酸鹽,均可順利反應(yīng),獲得相應(yīng)的產(chǎn)物35-46,收率為25-64%。其中,含有羰基、酯基、烯基等活性基團(tuán)的底物,均可與體系兼容。
(圖片來(lái)源:J. Am. Chem. Soc.)
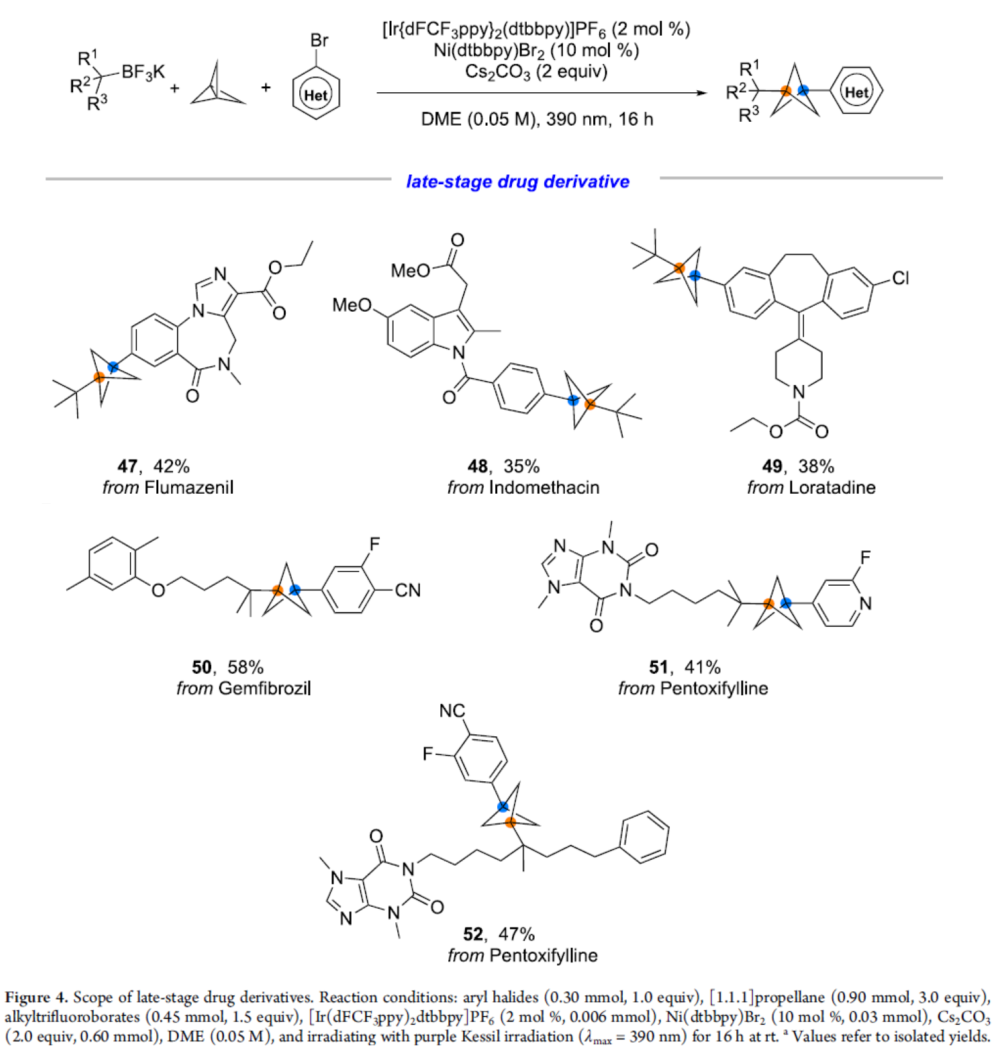
為了進(jìn)一步證明反應(yīng)的實(shí)用性,作者對(duì)一些復(fù)雜的藥物分子進(jìn)行了后期衍生化實(shí)驗(yàn),獲得相應(yīng)的產(chǎn)物47-52,收率為35-58%(Figure 4)。
(圖片來(lái)源:J. Am. Chem. Soc.)
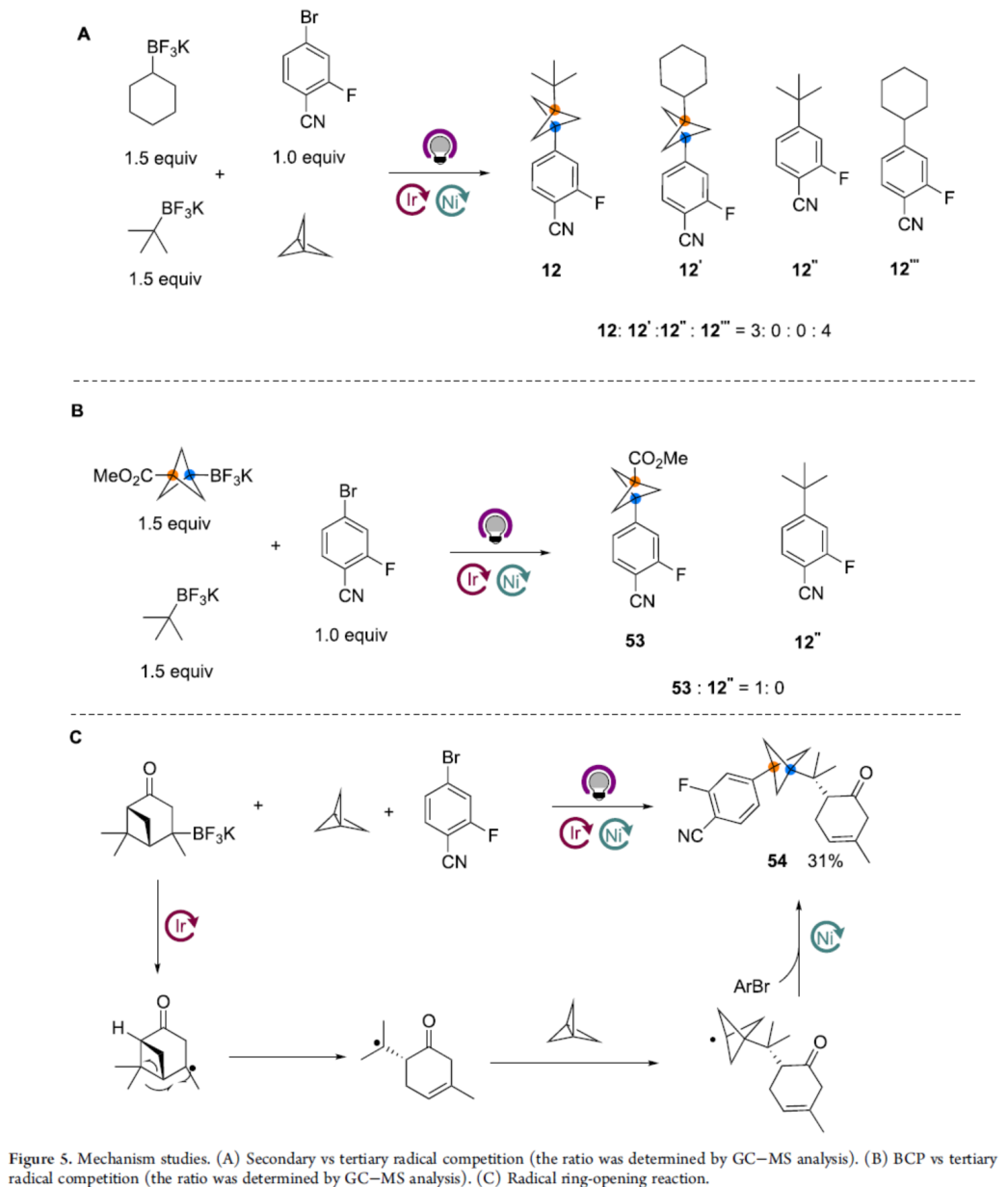
此外,作者還對(duì)反應(yīng)機(jī)理進(jìn)行了相關(guān)的研究(Figure 5)。首先,二級(jí)(環(huán)己基)和三級(jí)(叔丁基)自由基之間的競(jìng)爭(zhēng)性實(shí)驗(yàn)表明,三級(jí)自由基只參與該MCR過(guò)程,而二級(jí)自由基僅參與雙組分反應(yīng)(Figure 5A)。其次,BCP和三級(jí)(叔丁基)自由基之間的競(jìng)爭(zhēng)性實(shí)驗(yàn)表明,BCP橋頭自由基更容易與鎳催化劑結(jié)合進(jìn)入交叉偶聯(lián)催化循環(huán),而無(wú)環(huán)三級(jí)自由基則非常緩慢(Figure 5B)。此外,使用馬鞭烯酮衍生的烷基三氟硼酸鹽,可獲得開(kāi)環(huán)產(chǎn)物57,從而表明MCR過(guò)程涉及自由基途徑(Figure 5C)。
(圖片來(lái)源:J. Am. Chem. Soc.)
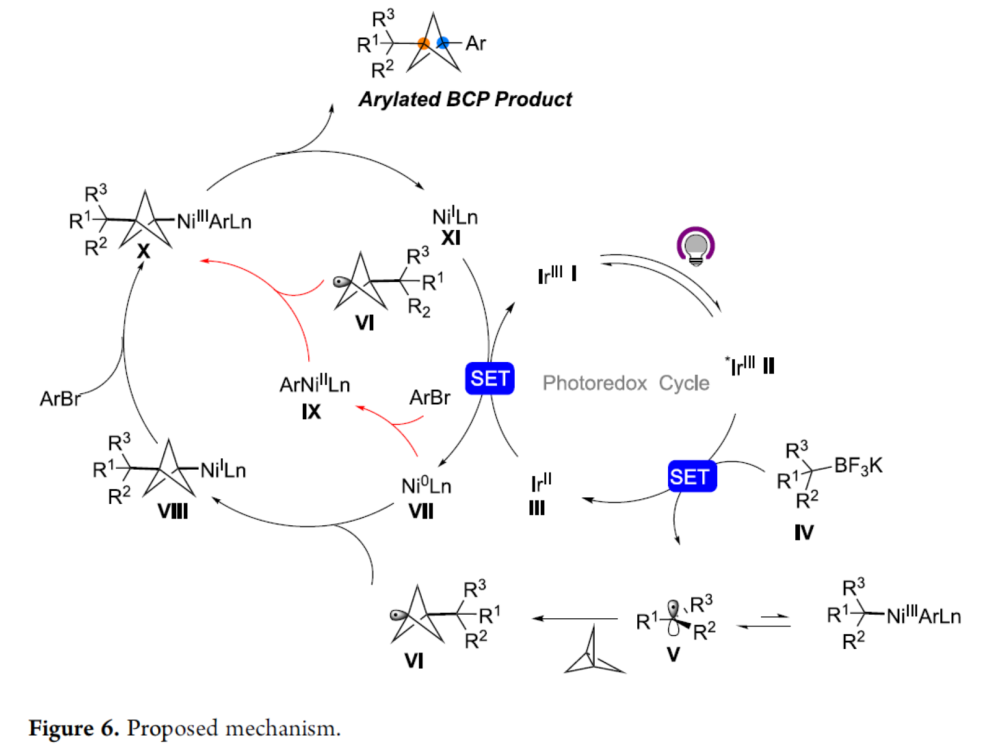
基于上述的研究以及相關(guān)文獻(xiàn)的查閱,作者提出了一種合理的催化循環(huán)過(guò)程(Figure 6)。首先,烷基三氟硼酸鹽試劑與Ir* II的單電子氧化生成三級(jí)烷基自由基V。自由基V可與[1.1.1]螺槳烷進(jìn)行不可逆的自由基加成,生成BCP自由基VI,可被Ni(0)配合物VII捕獲生成烷基鎳(I)配合物VIII。隨后,VIII與(雜)芳基溴進(jìn)行快速的氧化加成,生成Ni(III)配合物X,其經(jīng)過(guò)還原消除,可獲得目標(biāo)偶聯(lián)產(chǎn)物和Ni(I)配合物XI。此外,反應(yīng)還存在另一種途徑,即Ni(0)配合物VII還可與(雜)芳基溴反應(yīng),生成Ni(II)配合物IX,可捕獲BCP自由基VI以生成Ni(III)配合物X。隨后,Ni(III)配合物經(jīng)快速且高效的C-C鍵形成,從而生成芳基化BCP產(chǎn)物。
(圖片來(lái)源:J. Am. Chem. Soc.)
總結(jié):美國(guó)賓夕法尼亞大學(xué)Gary A. Molander課題組報(bào)道了一種鎳/光氧化還原雙重催化實(shí)現(xiàn)一步三組分自由基偶聯(lián)反應(yīng),合成了一系列芳基化雙環(huán)[1.1.1]戊烷衍生物,且避免了對(duì)[1.1.1]螺槳烷的預(yù)官能團(tuán)化處理。同時(shí),通過(guò)該策略可在一個(gè)步驟中形成兩個(gè)C-C鍵以及三個(gè)季碳中心。此外,該策略具有反應(yīng)條件溫和、底物范圍廣泛、官能團(tuán)兼容性高等特點(diǎn)。
文獻(xiàn)詳情:
Weichen Huang, Sebastian Keess, and Gary A. Molander*.Dicarbofunctionalization of [1.1.1]Propellane Enabled by Nickel/Photoredox Dual Catalysis: One-Step Multicomponent Strategy for the Synthesis of BCP-Aryl Derivatives.JACS.https://doi.org/10.1021/jacs.2c05304

聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀(guān)點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話(huà):18676881059,郵箱:gongjian@huaxuejia.cn