



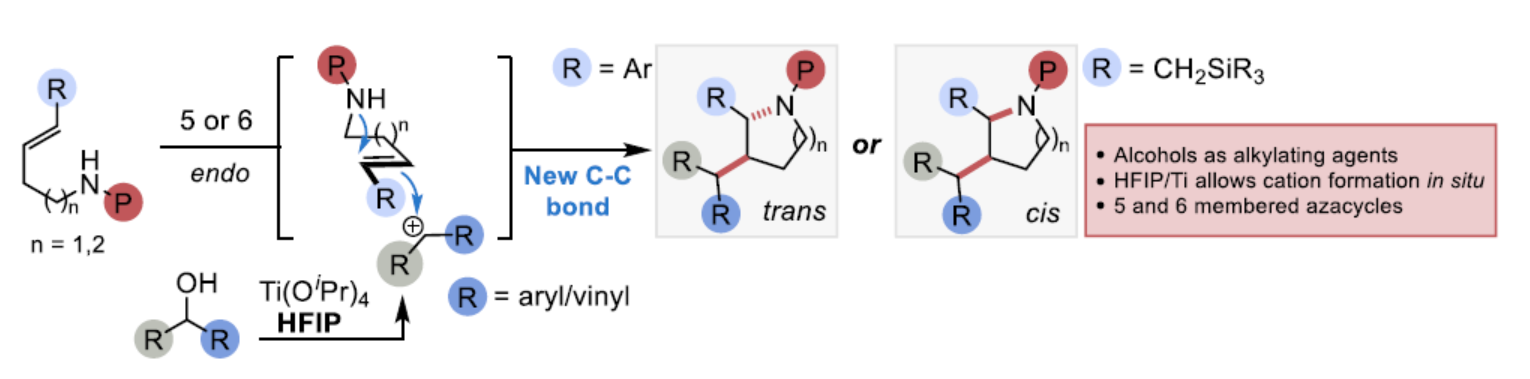
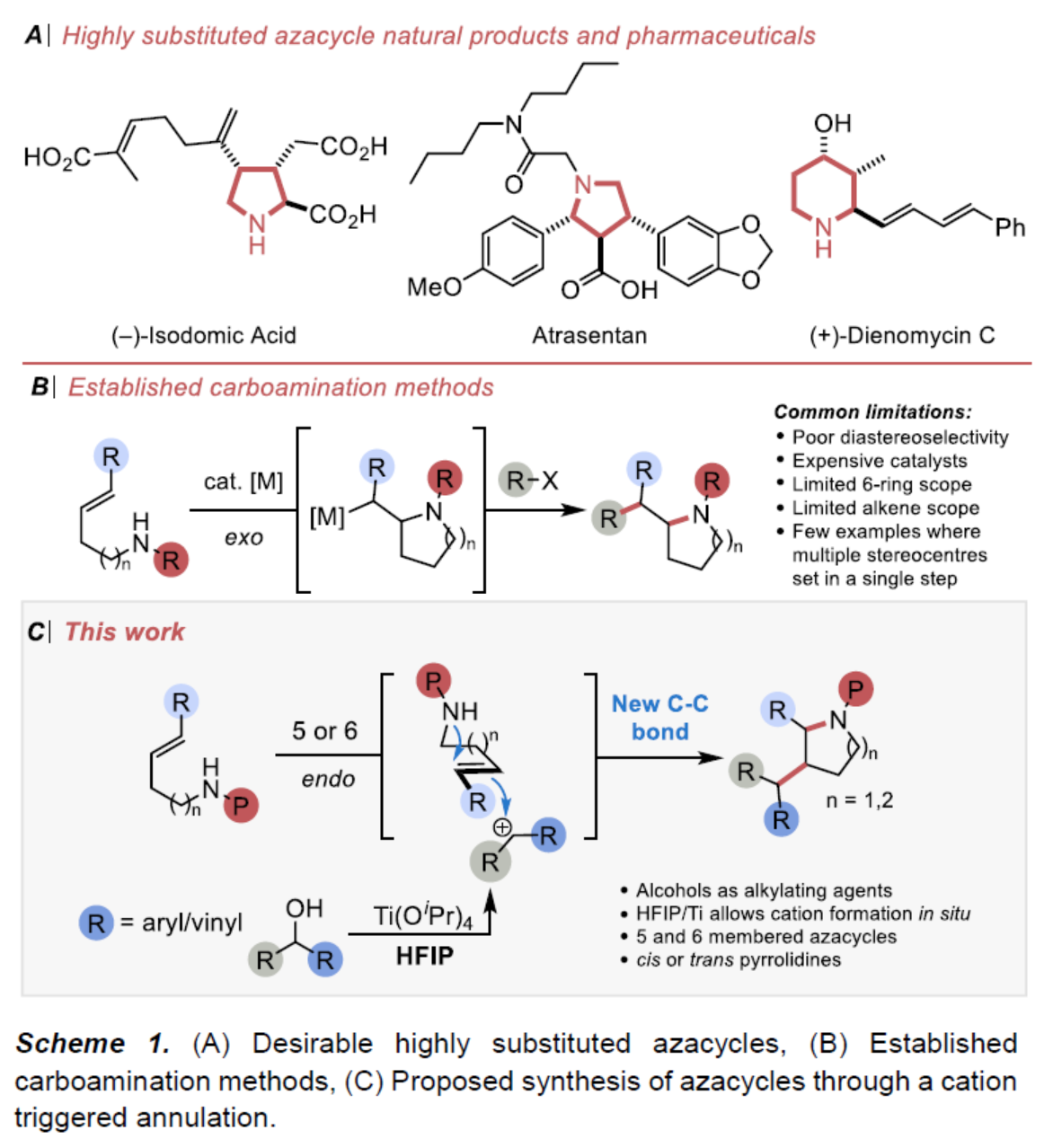
含氮飽和雜環(huán)骨架廣泛存在于各類天然產(chǎn)物和生物活性分子中(Scheme 1A)。因此,化學(xué)家們已開發(fā)大量的合成路線,其中烯烴的氫胺化是合成雜環(huán)化合物的常用方法。目前,使用過渡金屬、Lewis酸或Br?nsted酸活化胺或烯烴底物已得到大量的研究,并獲得一系列2-取代的N-雜環(huán)化合物。相反,更為高效的碳胺化反應(yīng)(可在一步反應(yīng)中同時(shí)構(gòu)建C-C和C-N鍵以及兩個(gè)新的立體中心)仍有待進(jìn)一步探索。同時(shí),對于文獻(xiàn)中的例子僅限于過渡金屬催化過程,烯烴以環(huán)外方式進(jìn)行反應(yīng),可在環(huán)內(nèi)生成一個(gè)立體中心,在環(huán)外生成第二個(gè)立體中心。因此,對于在雜環(huán)化合物內(nèi)生成多個(gè)立體中心的方法,仍有待進(jìn)一步的研究。近日,牛津大學(xué)Timothy J. Donohoe課題組報(bào)道了另一種合成雜環(huán)化合物的策略。該策略除了環(huán)化和C-N鍵的形成以外,外部醇親電試劑的活化還引發(fā)了C-C鍵的形成。其中,烯烴以endo方式反應(yīng),獲得2,3-二取代N-雜環(huán)化合物。值得注意的是,HFIP在反應(yīng)過程中具有至關(guān)重要的作用,通過原位形成的碳正離子,使醇類能夠充當(dāng)烷基化試劑,從而引發(fā)環(huán)化反應(yīng)并生成水作為化學(xué)計(jì)量的副產(chǎn)物。
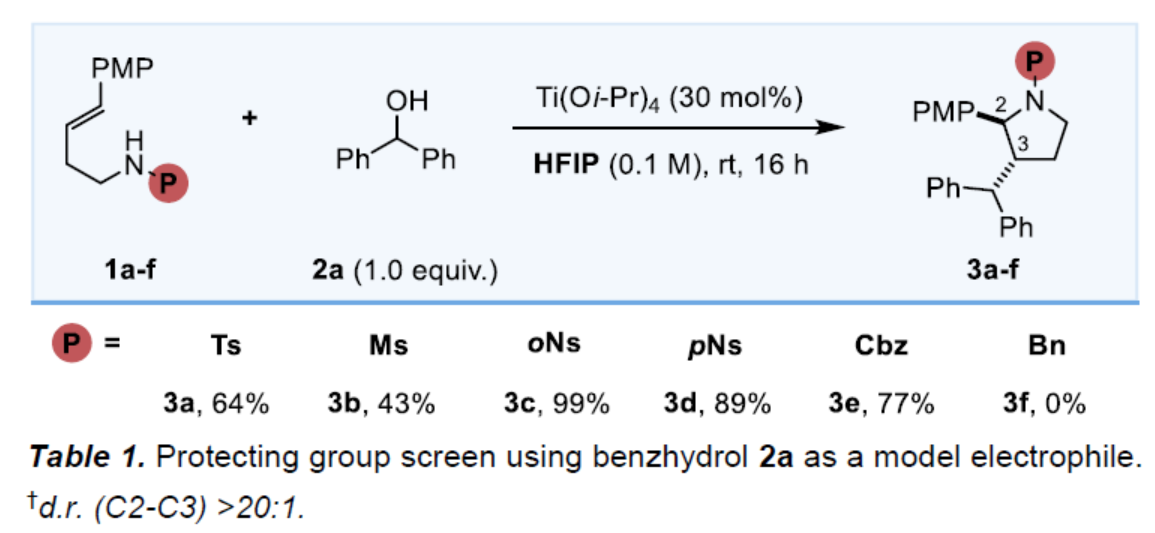
首先,作者對高烯丙基胺底物進(jìn)行了篩選(Table 1)。當(dāng)以N-oNs取代的高烯丙基胺1c與二苯甲醇2a(陽離子前體)作為底物,Ti(Oi-Pr)4作為促進(jìn)劑,在HFIP溶劑(0.1 M)中室溫反應(yīng)16 h,可以99%的收率得到手性吡咯烷產(chǎn)物3c。
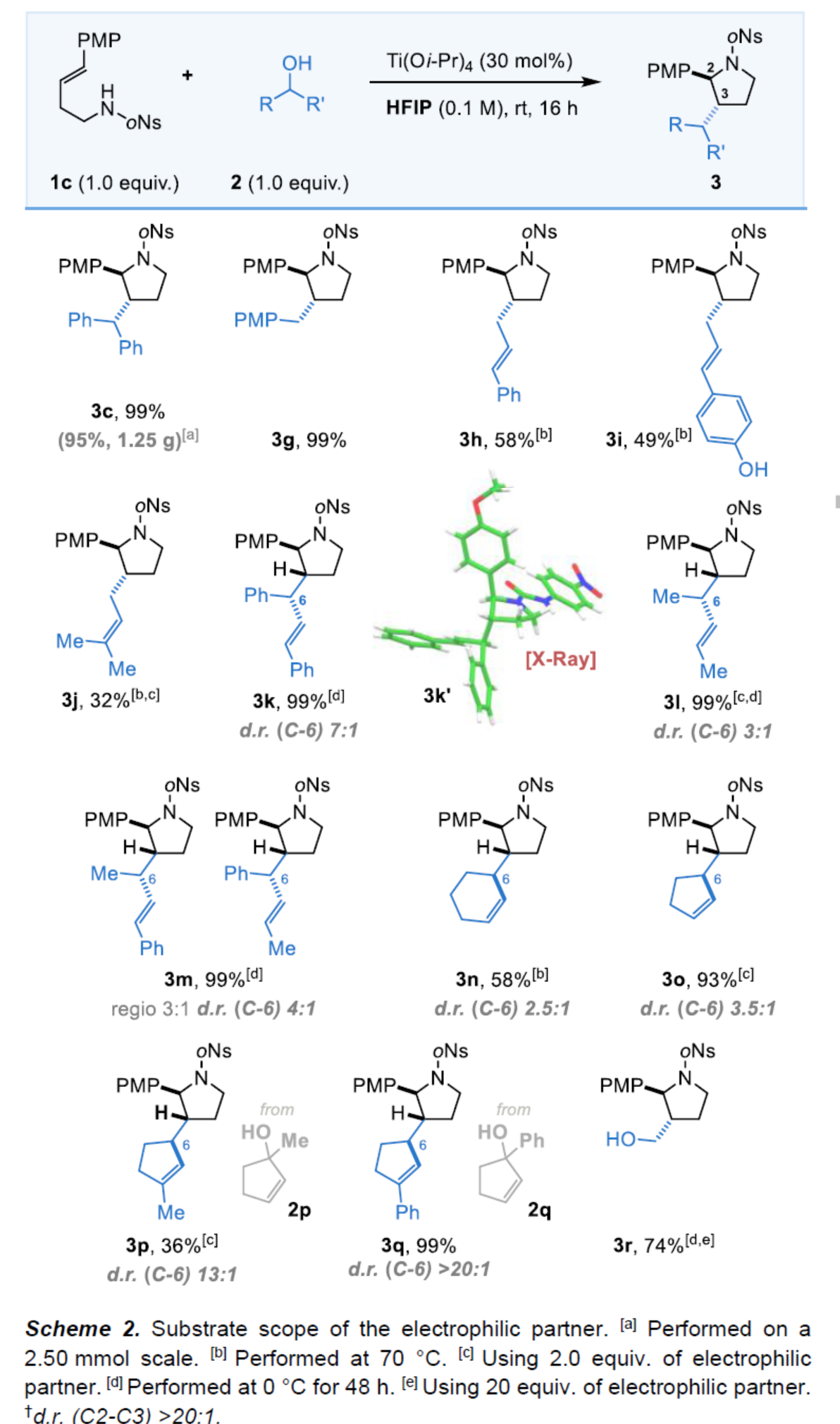
在獲得上述最佳反應(yīng)條件后,作者對醇底物2的范圍進(jìn)行了擴(kuò)展(Scheme 2)。首先,一系列簡單的芐醇和烯丙醇,均可與1c順利反應(yīng),獲得相應(yīng)的產(chǎn)物3g-3j,收率為32-99%。值得注意的是,克級規(guī)模實(shí)驗(yàn),可以95%的收率獲得產(chǎn)物3c。然而,叔醇作為親電試劑時(shí),反應(yīng)的效率偏低(收率降至0-33%)。當(dāng)使用含有手性中心的無環(huán)α-取代烯丙醇時(shí),可獲得具有三個(gè)連續(xù)立體中心的產(chǎn)物3k-3m,收率為99%,環(huán)內(nèi)具有出色的2,3-反式立體化學(xué)選擇性,外環(huán)立體中心具有良好的非對映選擇性。當(dāng)使用帶有兩個(gè)不同末端取代基的烯丙醇時(shí),還觀察到部分區(qū)域控制性(3m),這是由于優(yōu)先進(jìn)攻非對稱烯丙基陽離子中間體的位阻最小端。此外,一系列多種環(huán)狀烯丙醇也與體系兼容,獲得相應(yīng)的產(chǎn)物3n-3q,收率為36-99%。令人高興的是,環(huán)戊烯醇和環(huán)己烯醇都在環(huán)外立體中心具有中等至良好的非對映控制性(3n-3o)。使用甲基或苯基取代的叔環(huán)戊烯衍生的烯丙醇2p和2q,可使吡咯烷3p和3q在環(huán)外中心具有出色的非對映控制性以及完全的區(qū)域選擇性。此外,多聚甲醛也是合適的底物,可以74%的收率獲得吡咯烷產(chǎn)物3r。
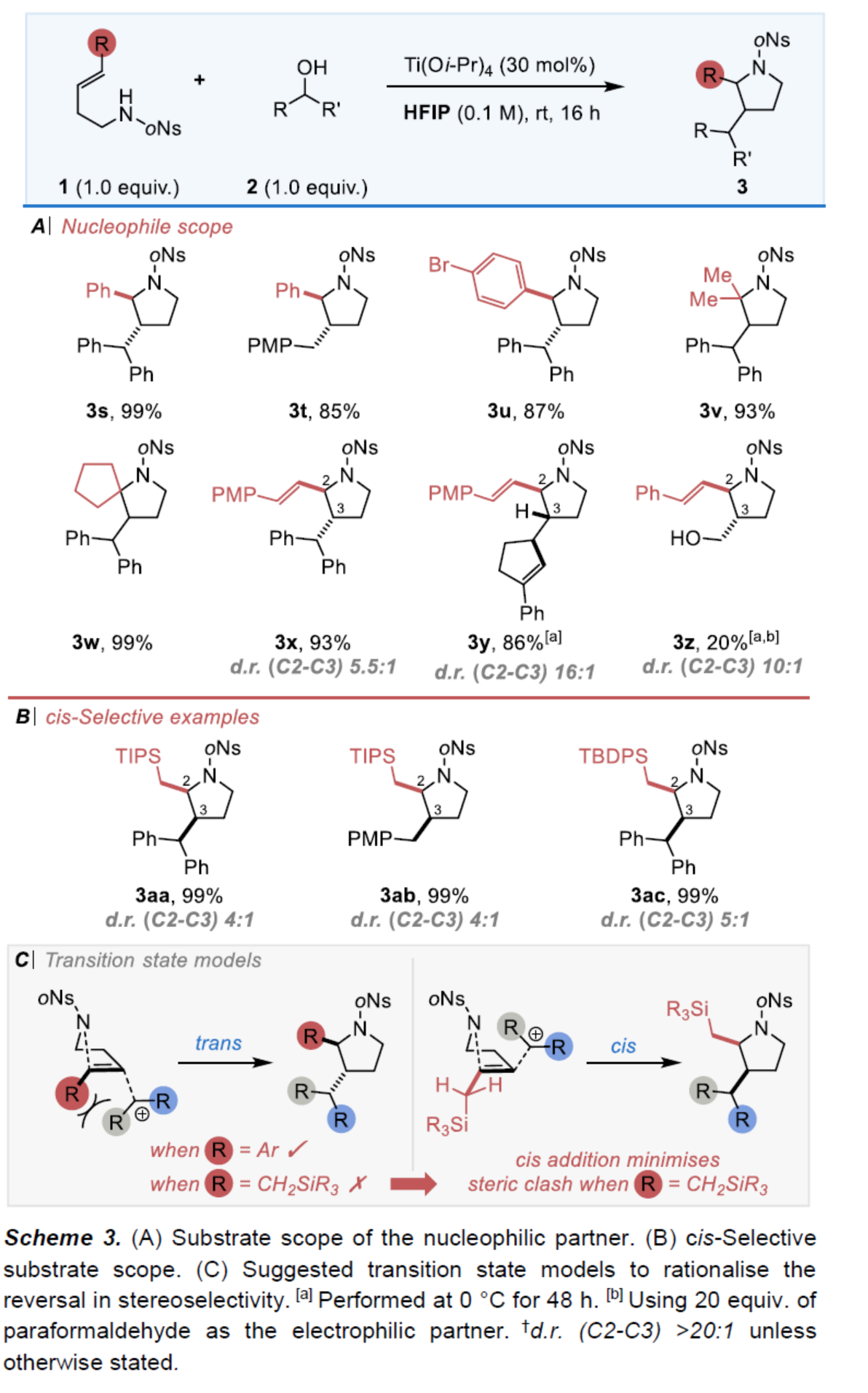
緊接著,作者對高烯丙基胺底物1的范圍進(jìn)行了擴(kuò)展(Scheme 3)。首先,當(dāng)高烯丙基胺底物中的R為芳基、二甲基、環(huán)戊基時(shí),均可順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物3s-3w,收率為85-99%。當(dāng)高烯丙基胺底物中的R為烯基時(shí),可獲得相應(yīng)的產(chǎn)物3x-3z,收率為20-93%,具有完全區(qū)域選擇性和良好的(反式)非對映體控制性。其次,烯丙基硅烷也是合適的底物,獲得相應(yīng)的2,3-順式產(chǎn)物3aa-3ac,收率為99%。此外,作者還提出了過渡態(tài)模型,從而使立體選擇性的逆轉(zhuǎn)更為合理化。其中,硅基的空間位阻對于選擇性至關(guān)重要。
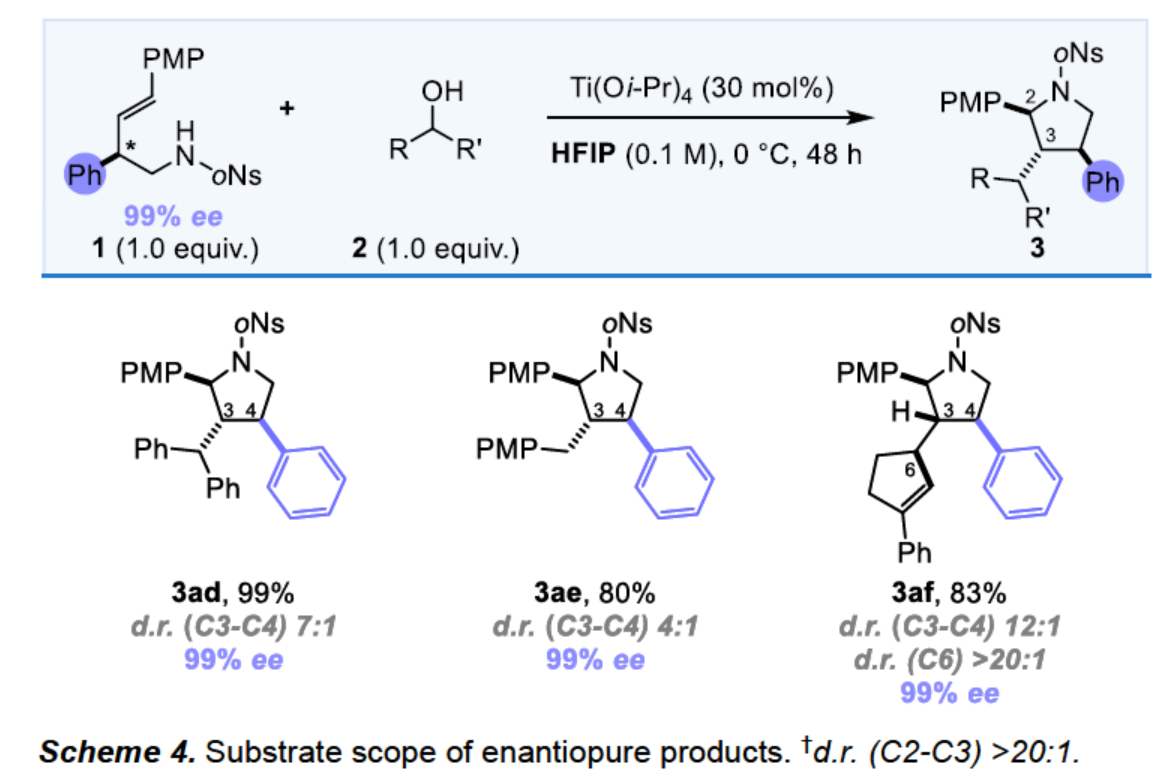
值得注意的是,當(dāng)以手性高烯丙基胺為底物時(shí),可與醇2順利反應(yīng),獲得具有三或四個(gè)連續(xù)立體中心的手性吡咯烷產(chǎn)物3ad-3af,收率為80-99%(Scheme 4)。
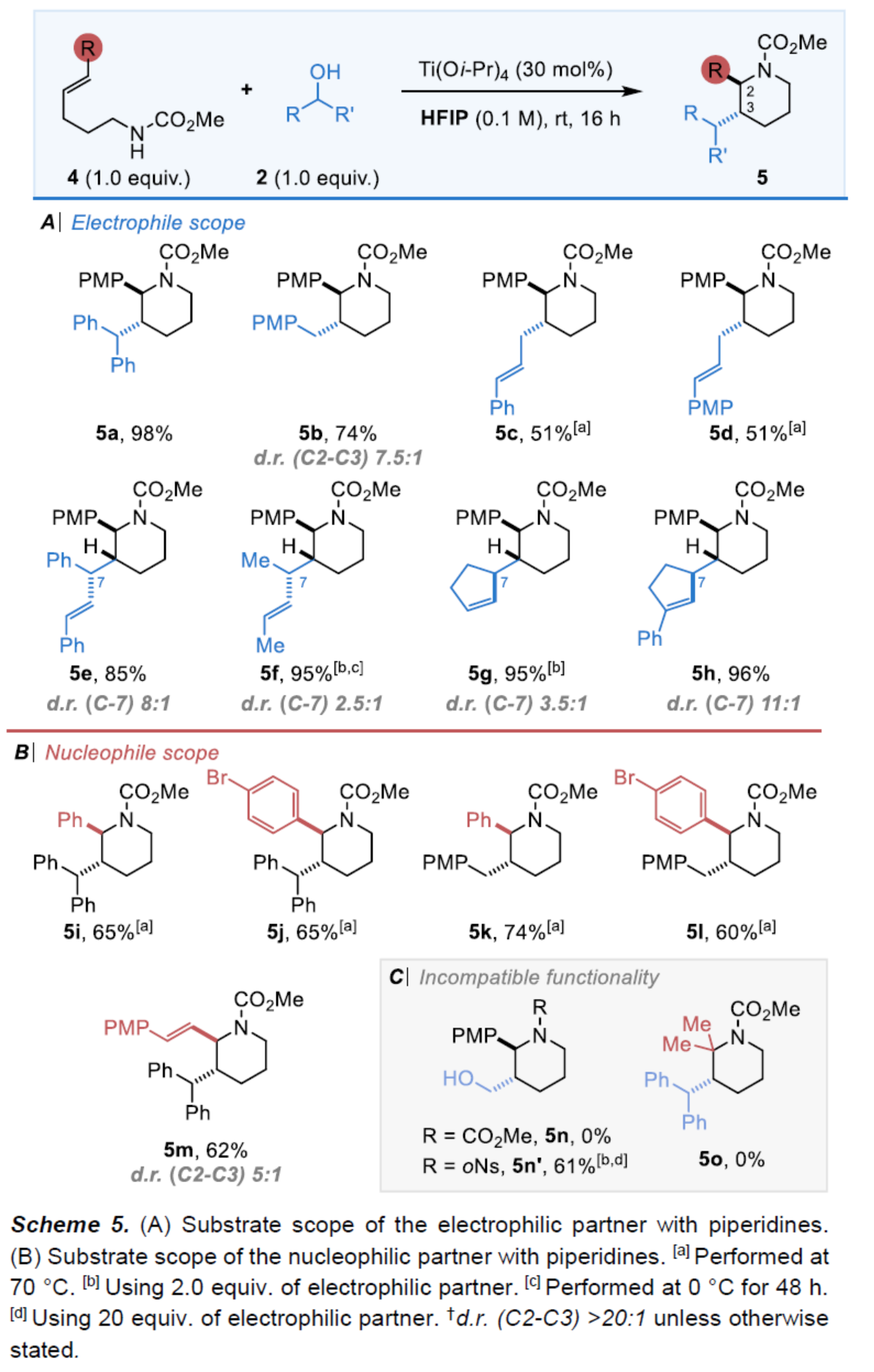
隨后,當(dāng)以N-CO2Me保護(hù)的雙高烯丙基胺(bishomoallylic amine)4為底物時(shí),可與各種醇2順利反應(yīng),獲得相應(yīng)的手性哌啶衍生物(Scheme 5)。首先,二苯甲醇、芐醇、烯丙基醇、環(huán)戊烯醇等親電試劑,均可順利反應(yīng),獲得相應(yīng)的手性哌啶產(chǎn)物5a-5h,收率為51-98%。其次,當(dāng)親核試劑中的R為芳基、溴代芳基以及烯基時(shí),也與體系兼容,獲得相應(yīng)的手性哌啶產(chǎn)物5i-5m,收率為60-74%。然而,多聚甲醛與N-CO2Me保護(hù)的胺4未發(fā)生反應(yīng)(5n),但可與N-oNs取代的雙高烯丙基胺順利反應(yīng),可以61%的收率獲得手性哌啶產(chǎn)物5n’。同時(shí),當(dāng)親核試劑中的R為甲基時(shí),反應(yīng)也未能順利進(jìn)行,如5o。
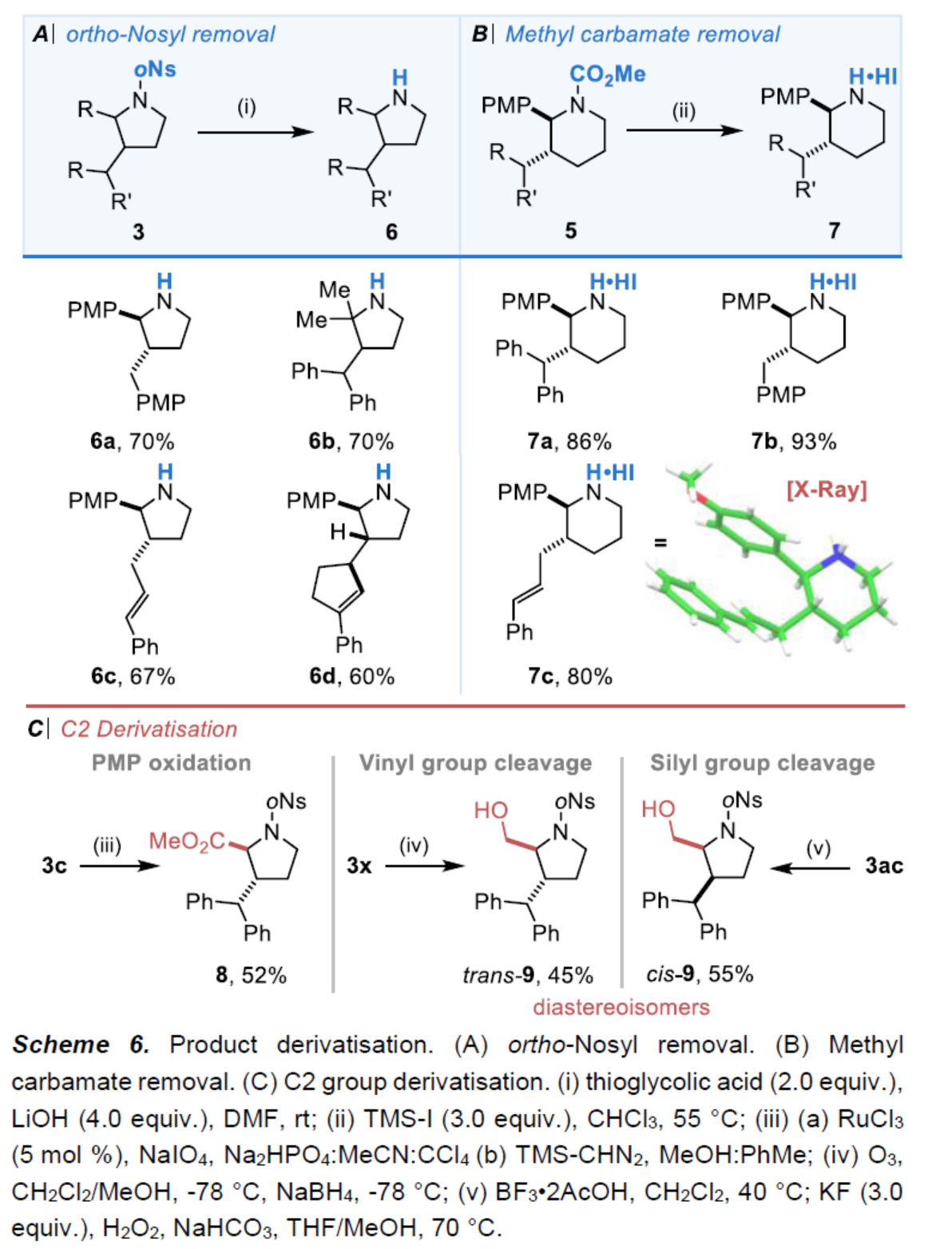
最后,作者對反應(yīng)的實(shí)用性進(jìn)行了研究(Scheme 6)。首先,手性吡咯烷產(chǎn)物3中的N-oNs保護(hù)基以及手性哌啶產(chǎn)物5中的N-CO2Me保護(hù)基,可輕松去除,獲得高收率的相應(yīng)游離胺化合物6與7。其次,3c中C2-位的-PMP經(jīng)Ru-催化氧化反應(yīng),可以52%的收率獲得酯基取代的吡咯烷化合物8。3x中C2-位的乙烯基經(jīng)臭氧分解以及隨后的還原淬滅,可以45%的收率獲得含有羥基的吡咯烷化合物trans-9。3x中C2-位的硅基經(jīng)Fleming-Tamao氧化,可以55%的收率獲得含有羥基的吡咯烷化合物cis-9,且與上述條件下獲得的產(chǎn)物trans-9具有相反的構(gòu)型。
總結(jié):牛津大學(xué)Timothy J. Donohoe課題組報(bào)道了一種Ti(Oi-Pr)4促進(jìn)醇與胺的環(huán)化反應(yīng),合成了一系列吡咯烷和哌啶衍生物。其中,使用HFIP作為溶劑可促進(jìn)反應(yīng)性親電試劑的形成,不僅醇類而且多聚甲醛都可作為烷基化試劑用于引發(fā)5或6-endo-trig環(huán)化。值得注意的是,通過改變親核烯烴底物中的取代基,可選擇性合成2,3-反式或2,3-順式的吡咯烷的非對映異構(gòu)體。此外,通過后期的脫保護(hù)以及C2-位的衍生化實(shí)驗(yàn),從而進(jìn)一步證明了反應(yīng)的實(shí)用性。
文獻(xiàn)詳情:

聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn