

2015年,基因編輯這個詞可謂是最活躍的科技詞匯之一;CRISPR作為最受歡迎的基因編輯神器更是突破不斷。雖然今年它最終沒能摘得諾獎,但是技術的一次次更新和突破讓科學界根本無法忽視這一技術的巨大實力和無限潛力。
Cas9酶是基因編輯系統中一個非常關鍵的組成部分,而脫靶效應一直是CRISPR技術需要克服的重大技術問題。在任何臨床應用之前,醫生和監管機構必須確保Cas9酶不會引起非目標基因組的損傷。
11月30日,發表在《科學》雜志上的一項研究中,麻省理工學院-哈佛醫學院Broad研究所CRISPR大神張鋒的研究小組又取得了一項突破性的成果。研究人員通過創建了3個新版本的Cas9酶大大降低了CRISPR/Cas9系統的脫靶效應;有效改善了這一技術的最大局限性之一。
張鋒的團隊通過改變構成化膿性鏈球菌Cas9酶的約1,400個氨基酸中的3個氨基酸將“脫靶編輯”顯著減少至無法檢測到的水平。他說,不同于其他降低CRISPR/Cas9系統錯誤率的方式,這些新酶的使用不需要改變許多研究人員現在參照的CRISPR/Cas9系統的protocol。
新版本的Cas9酶如何形成的?
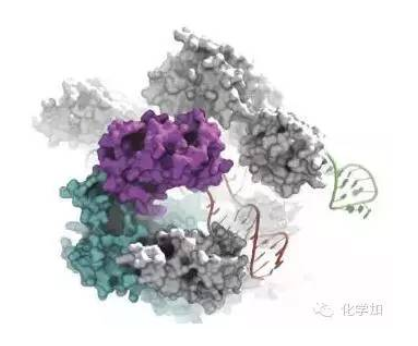
The Cas9 enzyme cuts DNA (in red) to which it is guided by an RNA sequence (in green)
在這項研究中,科學家們利用了Cas9蛋白的結構知識來降低脫靶切割(off-target cutting),即帶負電荷的DNA是結合到帶正電荷的Cas9蛋白的凹槽。基于這樣的原理,他們預測,相較于“靶向”序列,用一些中性氨基酸來替代正電荷的氨基酸,可以減少Cas9與“脫靶”序列的結合。
在試驗了各種可能的改變后,張鋒研究小組發現三個氨基酸突變可大大減少“脫靶”切割。利用測試的導向RNAs,研究人員證實“脫靶”切割已降低至檢測不到的水平。研究小組將這種新設計的酶命名為“增強型”化膿性鏈球菌Cas9(eSpCas9),可用于需要高水平特異性的基因組編輯應用。
張鋒實驗室馬上將向全世界的研究人員提供這種eSpCas9。該研究小組相信相同的電荷改變方法也會對張鋒與合作者們在今年早些時候報告的其他RNA引導DNA靶向酶,包括Cpf1、C2C1和C2C3發揮作用。
科學家如何評價新系統

并未參與這項研究的哈佛大學化學生物家David Liu 說:“這項工作實際上實在調和Cas9多余的“熱情”,使它只能作用于目標序列。對很多科研應用而言,使用不變的Cas9也一樣可以。但是當用于治療領域時,研究人員希望能夠降低錯誤率,使之不超過人類細胞正常的DNA突變率。在治療應用中,我們都希望程序能夠以最大的準確度發揮作用,確保不能編輯到基因組中預想之外的位點。”
張鋒將對CRISPR/Cas9系統的改善比作“讓汽車變得更快”的過程:新的Cas9酶就像為CRISPR/Cas9系統加上了更大的發動機。他說:“當然,汽車提速的方法很多;同樣,還可以結合其它的方法產生馬力更強的酶。”
張鋒近期部分成果一覽
在文章的第三段,筆者用了“又獲得突破成果”這樣的說法,這是因為在CRISPR領域,張鋒確實是論文非常高產的研究者之一。以下是今年下半年張鋒發布的部分CRISPR相關的文章(以發布時間排序):
1. 張鋒Cell子刊:第二類CRISPR-Cas基因組編輯系統(10月22日)
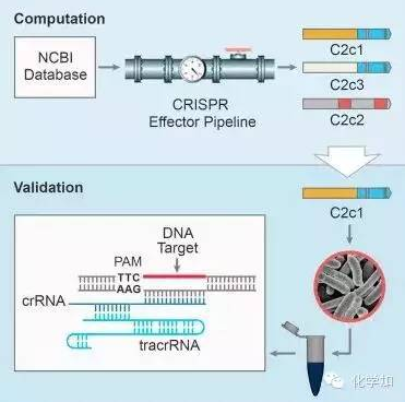
一個國際CRISPR-Cas研究人員小組發現了自然存在的、具有基因組編輯潛力的三個新系統。發現以及確定這些系統的特征有望進一步擴大基因組編輯工具箱,為生物醫學研究開辟新的途徑。
2. 張鋒Cell重大突破:基因編輯家族“新神器”誕生,CRISPR/Cpf1讓一切皆有可能(9月25日)
9月25日,發表在《細胞》雜志上的一項研究中,CRISPR技術先驅、Broad研究所合成生物學家張鋒領導的研究小組找到一種讓該技術更簡單、更精準的方法。一種叫做Cpf1的蛋白可能將克服CRISPR-Cas9系統應用中的一些限制。雖然CRISPR-Cas9系統適用于讓基因失去功能,但是對于真正實現用一個DNA序列的替換另一個還很困難。
3. 張鋒Nature發布CRISPR新成果,開辟鐮狀細胞病治療新途徑(9月16日)
來自Dana-Farber/波士頓兒童醫院癌癥及血液疾病中心的研究人員發現,改變一小段DNA可以避開鐮狀細胞病(SCD)背后的遺傳缺陷。這一發布在《自然》(Nature)雜志上的發現,為開發出一些基因編輯方法來治療SCD和諸如地中海貧血等其他的血紅蛋白疾病開辟了一條途徑。
4. 張鋒Cell重大突破:新型Cas9克服“哺乳動物”基因組編輯挑戰(8月27日)
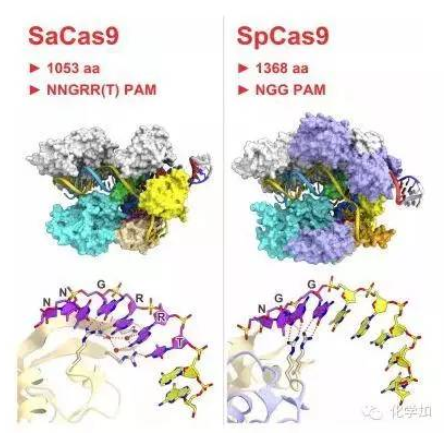
發表于8月27日《細胞》(cell)雜志上的一篇新研究論文中,來自Broad研究所和東京大學的研究人員揭示出了金黃色葡萄球菌Cas9復合物(SaCas9)的晶體結構——這種高效的酶克服了在哺乳動物體內進行基因組編輯一個主要的挑戰。
5. 張鋒參與Cell發布CRISPR重要新成果(7月16日)
一直以來研究人員都無法在哺乳動物細胞中實現高通量的靶向基因編輯,CRISPR-Cas9系統的應用標志著遺傳篩查一個重大的突破。現在,來自哈佛-麻省理工Broad研究所的研究人員將這一篩查技術應用于小鼠骨髓源性樹突狀細胞,研究了PAMPs觸發的免疫反應的調控機制。通過綜合分析基因敲除結果及蛋白質和mRNA表達改變,他們利用CRISPR篩查以前所未有的分辨率剖析了免疫調控網絡。這一重要的成果發布在7月16日的《細胞》(Cell)雜志上。
6.Genome Research:張鋒CRISPR新論文(6月10日)
6月10日,來自哈佛大學醫學院Dana-Farber癌癥研究院、哈佛大學統計系和麻省理工學院-哈佛大學布羅德研究所的研究人員,在國際基因組研究權威期刊《Genome Research》發表題為“Sequence determinants of improved CRISPR sgRNA design”的學術論文。在這項研究中,該研究小組系統地評估了提高CRISPR篩選中單導向RNA(sgRNA)效率的DNA序列特征,并建立了一個新的序列模型,用于預測CRISPR/Cas9基因敲除實驗中的sgRNA效率。
全球矚目的基因編輯大會
12月1日-3日,來自世界各地的科學家們齊聚在華盛頓召開的 International Summit on Human Gene Editing大會,共同探討基因編輯技術所帶來的基礎研究變革、潛在應用,以及由此帶來的社會問題、政府管控以及法律問題等。
參會的“大咖”包括了著名遺傳學家George Church,CRISPR兩大女神Jennifer Doudna及Emmanuelle Charpentier、麻省理工學院-哈佛醫學院Broad研究所張鋒以及我國科學家中科院李勁松研究員等。
“我們希望測量這項技術在全世界的“溫度”。”美國帕薩迪納市加州理工學院病毒學家、此次人類基因編輯國際峰會主席David Baltimore說。那么,這些基因編輯領域頂級的科學家對基因編輯都持怎樣的態度呢?
Jennifer Doudna
Doudna認為,人們應該商議基因組編輯研究的界限,特別是人類生殖細胞的編輯。全面禁止也許會阻礙那些可能在未來帶來治療方法的研究,考慮到CRISPR/Cas9的廣泛使用和易用程度,這也是不實際的。
Doudna向科學家和政策制定者提出了五點建議,希望推動人類和非人類生物學中的CRISPR技術。具體來說,她呼吁研究人員開發出標準方法,以測定基因組編輯技術的效率和脫靶效應,從而有助于比較臨床試驗。她還呼吁國際社會就道德或不道德的研究出臺指引。她認為,監管可確保人類基因組編輯的安全性和有效性。
George Church

Church也舉了一些監管的現有例子,并認為禁止將會使這種活動轉為地下,遠離公眾視線。他認為,禁止人類生殖細胞的編輯無異于為這種最佳的醫學研究潑了一盤冷水,反而推動研究轉向黑市,這帶來了更大的風險和濫用;相反,我們應鼓勵監管機構在安全性和有效性上的高標準,而不是懷有悲觀的假設。
張鋒
張鋒在會上說,快速和高效的基因組編輯前景引起了許多倫理和社會關注。許多安全性問題都與脫靶效應相關。我們希望全新開發的eSpCas9將幫助解決其中的一些問題,但我們并沒有將其視作為是一個神奇子彈。這一領域正在迅速地發展,在我們認為可以將這一技術投入臨床應用前還有許多東西有待了解。
李勁松
盡管筆者沒有收集到李勁松研究員在大會上的發言,但上周發表在《MIT Technology Review》上的一篇文章中,他曾表示,胚胎編輯是不可接受的,“糾正”生殖細胞是唯一可能的策略。
來源:生物探索,經化學加編輯
官微 化學加 2015-12-06發
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn