

近日,吉林大學化學學院李繼貞教授課題組發現FeⅢ/TBHP體系可以通過供給“氧”給C-中心自由基促使其轉變為O-中心自由基,從而通過自由基偶聯實現對喹啉骨架的位置選擇性醚化修飾 (圖 1)。在該方案中,TBHP首先充當甲基自由基來源和“氧”源,實現了對底物的甲氧基化修飾;又充當自由基引發劑和“氧”源,在乙腈溶劑中完成了對底物喹啉環C5位的氰甲氧基化修飾。兩種轉化方式可以由反應溫度和溶劑調控。
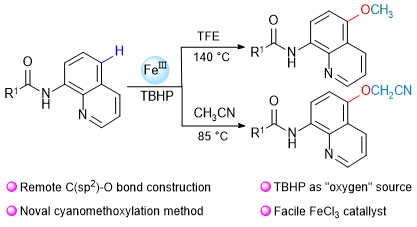
圖1 FeⅢ/TBHP 體系介導的8-氨基喹啉C5 位甲氧基化和氰甲氧基化反應
作者首先設計一系列實驗對反應條件進行了優化,并在最佳反應條件下分別對兩種轉化的底物普適性進行了探索。作者發現在TFE(三氟乙醇)溶劑中一系列8-氨基喹啉底物都以中等到良好的收率順利完成了C5位選擇性甲氧基化轉化,并且該反應對酰胺部分苯環上取代基的位置或電子效應均不敏感。喹啉環上有給電子基團如甲基等取代基的底物能夠順利反應,但遺憾地是喹啉環被吸電子取代基如氯等取代的底物沒有完成反應的轉化(圖 2)。
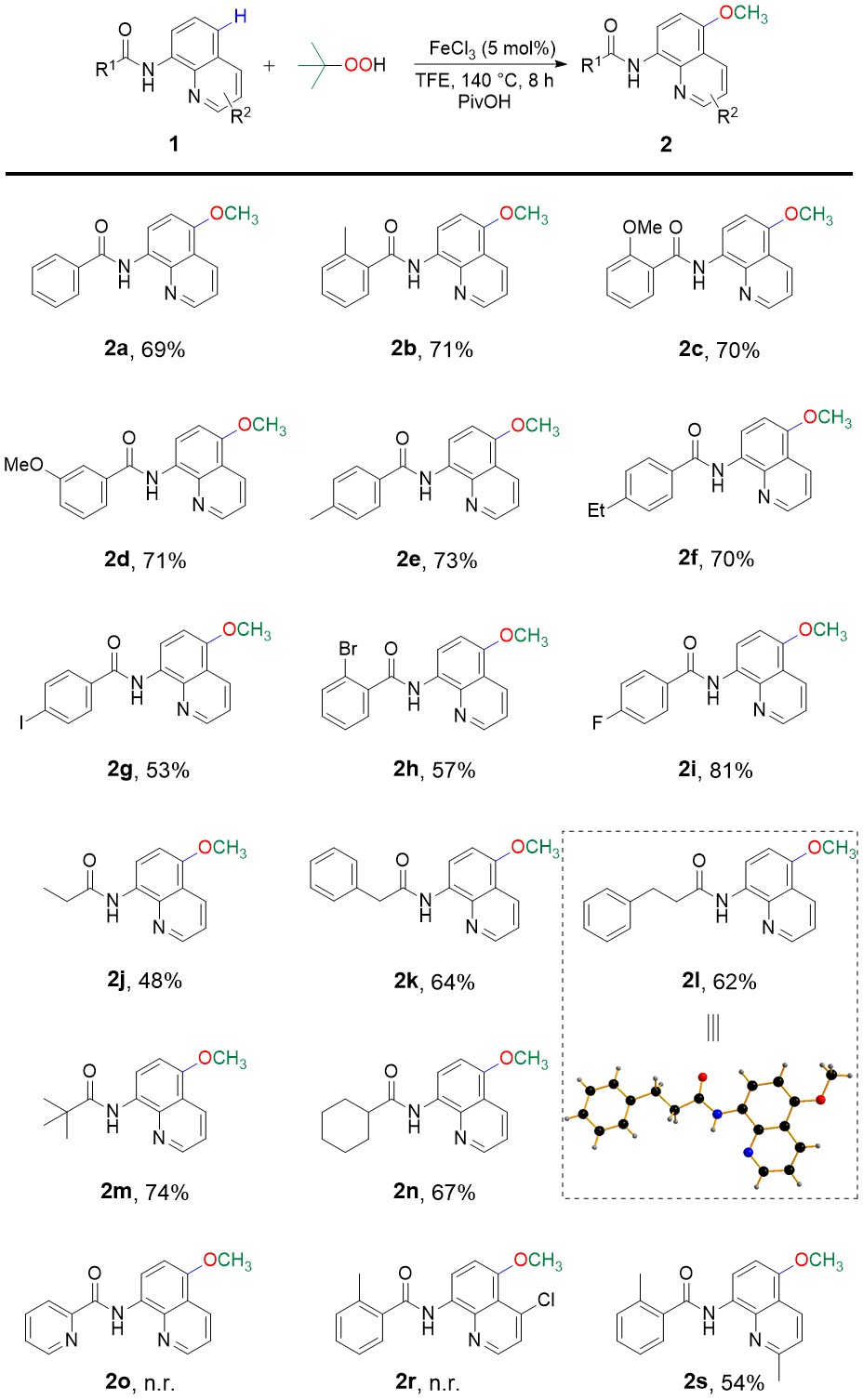
圖2 甲氧基化反應底物范圍探究
隨后,作者對8-氨基喹啉底物的氰甲氧基化反應的適用范圍進行了探索(圖 3),結果表明該方案對各種官能團具有良好的兼容性,酰胺部分苯環上各個位置含有取代基的底物均能被順利轉化。值得注意的是N-(8-喹啉基)-2,2-二甲基丙酰胺底物1m在反應中具有明顯優勢,且其產物3m的結構由X-單晶衍射準確給出。
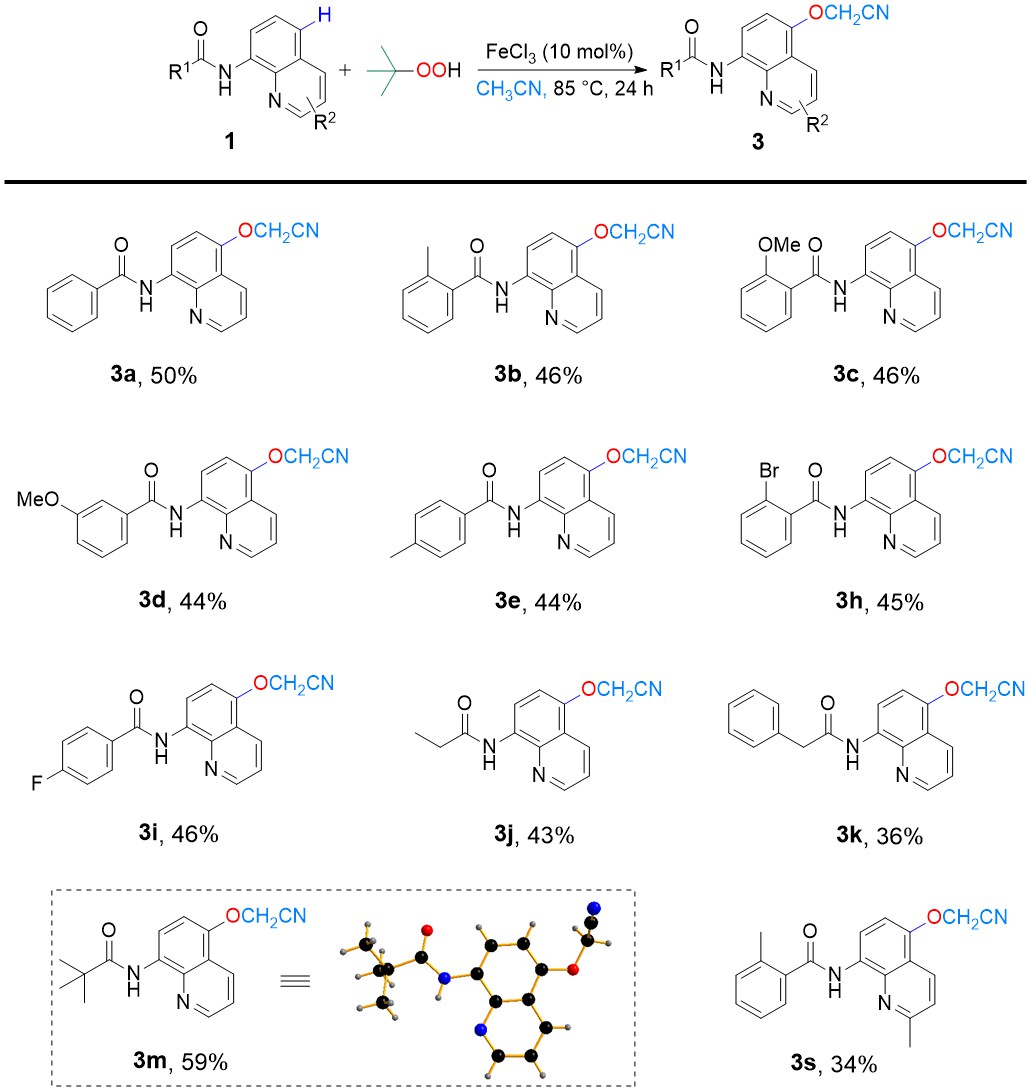
圖3 氰甲氧基化反應底物范圍探究
根據已有的文獻和18O同位素標記等合理的機理探索實驗,作者提出了該方案的可能機理。如圖4所示,首先,TBHP在Fe3+的誘導下產生tBuOO·(1),而Fe2+則誘導TBHP裂解產生tBuO·(2)。tBuOO·經歷雙分子衰變后產生tBuO·并釋放一分子氧氣,這是體系中氧氣的主要來源(3)。tBuO·發生β-切斷產生CH3·,或激活CH3CN產生·CH2CN,二者均可與一分子氧氣結合,發生自由基中心轉移生成相應的過氧自由基CH3OO·和·OOCH2CN,并再次經歷雙分子衰變釋放氧氣后最終生成CH3O·和·OCH2CN。而底物與催化劑偶聯后經歷 SET (單電子轉移)過程被激活為自由基活性物種B,B與CH3O·或·OCH2CN偶聯后生成相應的對位甲氧基化或者氰甲氧基化產物。
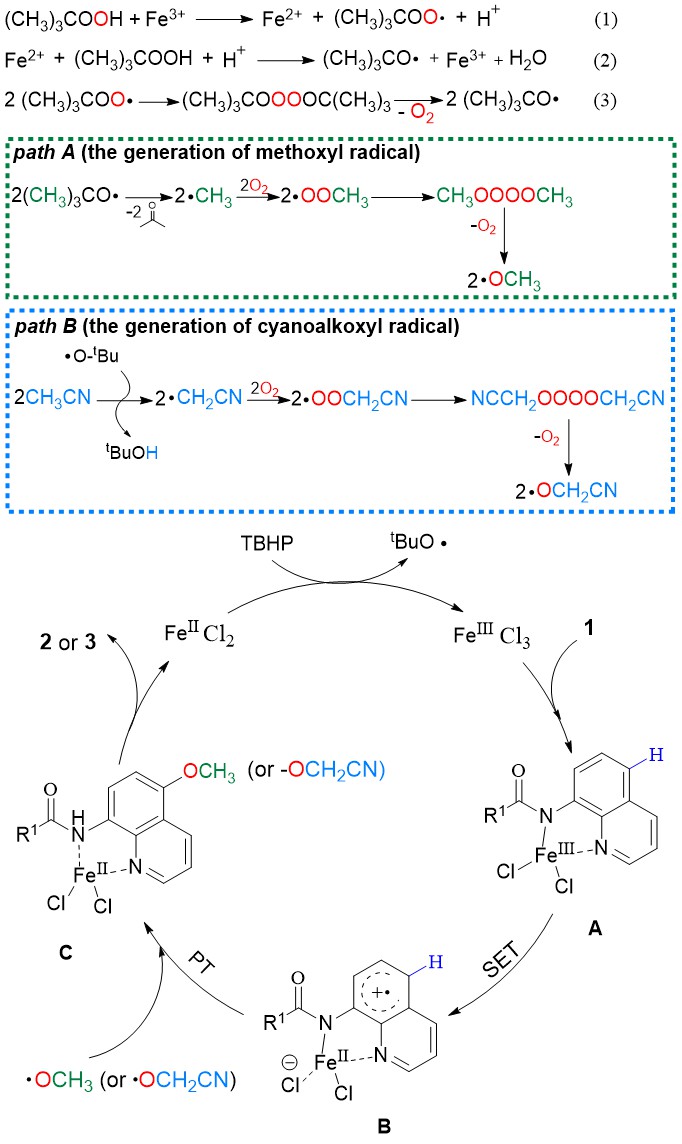
圖 4 醚化反應的可能機理
作者對該醚化反應的應用性也進行了探究(圖 5)。當底物1m被擴大至5 mmol (1.14 g)規模時,產物3m 的分離收率為46%;且產物3c可以通過簡單的堿性水解以85%的轉化率轉變為酰胺衍生物6。
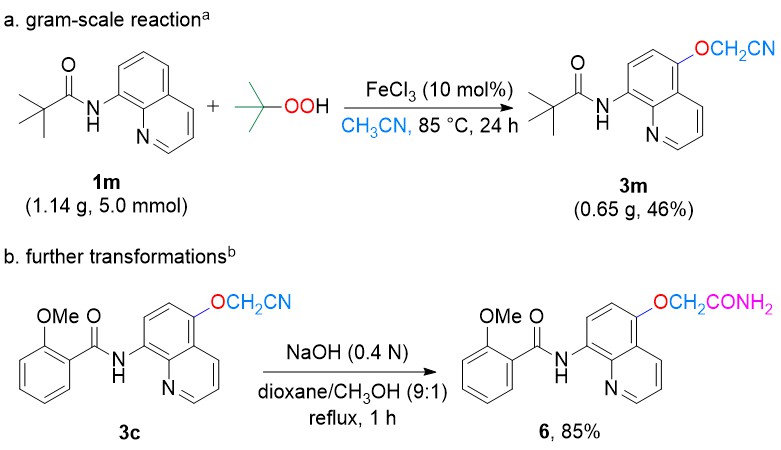
圖5 放大反應和產物轉化研究
總結:該項工作首次利用TBHP作為“氧”源將C-中心自由基物種轉變為O-中心自由基物種,完成了對8-氨基喹啉底物的遠程位置選擇性醚化修飾,獲得了一系列甲氧基化和氰甲氧基化轉化產物,并且氰甲氧基自由基物種被首次報道。氰基的引入對藥物的后期修飾改性十分重要,具有很強的應用潛力。該研究工作點亮了TBHP作為“氧”源獲得多樣性的O-中心自由基的可能性,并為C – O鍵的復雜構建奠定了基礎。
吉林大學化學學院李繼貞教授為論文通訊作者,研究生趙夢菲為論文第一作者。該研究工作得到中科院長春應用化學研究所稀土資源利用國家重點實驗室開放基金(RERU2021002)和國家自然科學基金(NSFC No. 51573069)的支持。
文獻資料:
FeⅢ/ TBHP mediated remote C-O bond construction of 8-aminoquinolines: access to methoxylation and cyanomethoxylation
The article was first published on 16 Jun 2022
Org. Chem. Front., 2022, Advance Article
https://doi.org/10.1039/D2QO00438K

聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn